环硅酸锆钠治疗维持性血液透析患者慢性高钾血症的疗效
2022-03-09董建华王绪臻范文静葛永纯
董建华 王绪臻 范文静 刘 丰 黄 力 李 川 吴 边 孔 凌 葛永纯
维持性血液透析(MHD)患者的高钾血症患病率高达30%~50%。高钾血症与血液透析(HD)患者心律失常和心脏骤停风险密切相关,显著增加患者心血管死亡风险。慢性高钾血症为1年内2次或2次以上血钾>5.5 mmol/L,目前对MHD慢性高钾血症的长期管理越来越受到重视[1]。然而,传统口服降钾药物用于高钾血症长期治疗存在诸多问题无法满足临床需求[2]。环硅酸锆钠作为新型降钾药物,已成为慢性肾脏病(CKD)高钾血症治疗的优选方案。环硅酸锆钠Ⅲb期临床研究(DIALIZE研究)显示,非透析日服用环硅酸锆钠能显著提高长透析间期血钾达标率[3]。但该研究对象为入组前1周内有高钾血症,未单独观察慢性高钾血症的疗效,也未观察不同程度高钾血症患者环硅酸锆钠剂量调整方案。因此,本研究前瞻性观察环硅酸锆钠在MHD患者慢性高钾血症治疗中的疗效,探讨不同程度高血钾治疗达标所需的环硅酸锆钠治疗剂量,为MHD患者慢性高钾血症治疗提供临床参考。
对象和方法
研究对象本研究是一项前瞻性、单中心、临床观察性研究,筛选2021-02-22~2021-05-31于国家肾脏病临床医学研究中心接受MHD伴慢性高钾血症的患者。研究获得本院伦理委员会批准。
相关定义 高钾血症:血钾>5.5 mmol/L。慢性高钾血症:1年内2次或2次以上血钾>5.5 mmol/L[1]。根据血清钾离子浓度和是否存在心律失常等心电图表现将高钾血症分为轻度、中度和重度(图1)[4]。
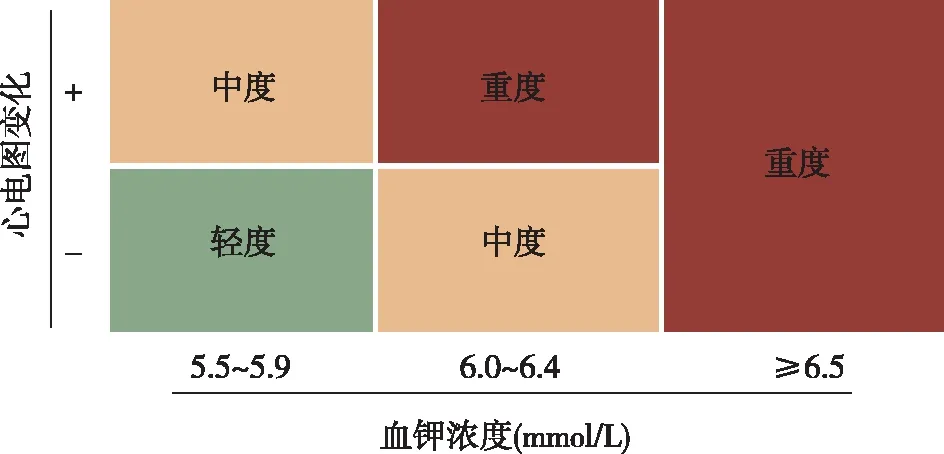
图1 高钾血症严重程度分级[4]
纳入标准 (1)年龄>18岁,性别不限;(2)终末期肾病患者;(3)HD治疗>12月,每周3次,每次4h HD或血液透析滤过(HDF);(4)血管通路为自体动静脉内瘘(AVF)、人工动静脉内瘘或带Cuff中心静脉导管;(5)近1年监测透前血钾≥4次(检测间隔>1月),并且其中2次或2次以上透前血钾>5.5 mmol/L;(6)筛选期短透析间期血钾>5.5 mmol/L,(7)透析血流量≥200 ml/min,单室尿素清除指数(spKt/V)≥1.2;(8)患者自愿参加本临床研究,并签署知情同意书。
排除标准 (1)筛选期血钾检测1周内应用聚磺苯乙烯钠、聚苯乙烯磺酸钙等降钾药物;(2)近3月内有急性冠脉综合征、脑卒中、血栓栓塞事件(不包括血管通路血栓形成);(3)严重酸中毒(碳酸氢根<16 mmol/L);(4)血红蛋白<90 g/L;(5)研究期间有肾移植计划;(6)预期寿命<6月;(7)环硅酸锆钠或其药物成分过敏。
研究方法研究分为三个阶段:筛选期(1周)、剂量调整期(4周)和治疗观察期(8周)。
筛选期 筛选本中心MHD患者中慢性高钾血症者,于短透析间期(每周第2次透析前)检测血钾,血钾>5.5 mmol/L者纳入本研究,并进行患者健康教育和低钾饮食管理。
治疗剂量调整期 环硅酸锆钠治疗初始方案为非透析日5 g/d,治疗目标为透前血钾达到并维持在4.0~5.0 mmol/L。每周监测短透析间期透析前血钾,若患者透前血钾未达标,可在非透析日每周增加5 g/d,最大剂量不超过15 g/d。
治疗观察期 保持患者环硅酸锆钠稳定剂量,每2周监测透析前血钾。患者将于基线、第1周、2周、3周、4周、6周、8周、10周和12周完成访视。每次随访,对患者进行透前和透后血钾检测,记录一般情况和不良事件,并在基线和第12周对患者进行透析指标和生化指标检测。
疗效评价指标主要观察终点:治疗观察期间4次透析前血钾至少3次维持在4.0~5.0 mmol/L的比例。次要观察终点:维持透析前血钾在4.0~5.0 mmol/L所需的环硅酸锆钠治疗剂量,以及透析前后血钾和透前血钾与透析液钾浓度差变化。
透析方案采用普通肝素钠或低分子肝素抗凝,选用高通量透析器(费森尤斯FX60),使用碳酸氢盐透析液中心供液,透析液钾离子浓度2.5 mmol/L,透析液流量500 ml/min。
临床资料、标本的收集和检测患者年龄、性别、合并疾病、透析龄、干体重、血管通路类型、透析治疗模式和透析血流量,降压药物应用。环硅酸锆钠治疗前后监测心率、收缩压、舒张压和透析间期体重增长,检测血红蛋白、血清白蛋白、二氧化碳、钠、钙、磷、甲状旁腺素,检查心电图,及透析前后血尿素氮、血清肌酐,并计算体重增长率和spKt/V。透析前由内瘘静脉穿刺端留取透前血标本,透析结束前停透析液泵,血泵速度降低至50 ml/min持续1 min,由透析管路动脉端采血口留取透后血标本,监测透前、透后血钾变化。
统计学方法所有数据均采用《IBM SPSS 20》软件进行统计分析和处理。计量资料若服从正态分布,以均数±标准差表示;若不服从正态分布,以四分位间距表示。环硅酸锆钠治疗前后检测钾离子水平变化为重复测量数据,分析采用重复测量方差分析(正态分布,若球形假设P<0.01,需应用Greenhouse-Geisser矫正,组间比较应用Bonferroni post hoc test)或Frideman检验(非正态分布)。其余检测指标治疗前后变化采用配对样本t检验(正态分布)或Wilcoxon检验(非正态分布)。P<0.05为差异有统计学意义。
结 果
一般情况筛选本中心308例MHD患者,90例(29.2%)患者符合慢性高钾血症,25例患者纳入本研究并完成临床试验。筛选流程图见图2。

图2 研究筛选流程图spKt/V:单室尿素清除指数;MHD:维持性血液透析;HD:血液透析;Hb:血红蛋白
基线资料25例患者中男性17例、女性8例,年龄54.2±12.8岁,中位透析龄117(74,171)月,干体重60.1±9.8 kg,其中20例行HD、5例行HDF,均以AVF作为血管通路,透析中血流量245±34 ml/min。合并疾病:高血压病13例(52.0%)、冠心病4例(16.0%)、糖尿病2例(8.0%),甲状旁腺切除术后5例(20.0%)。4例(16.0%)应用血管紧张素转换酶抑制剂 (ACEI)/血管紧张素Ⅱ受体拮抗剂(ARB)类药物,在治疗过程未调整或停用ACEI/ARB类药物。
环硅酸锆钠使用前基线透前血钾6.14±0.57 mmol/L,透后血钾4.03±0.45 mmol/L,透前血钾与透后血钾浓度差为2.11±0.58 mmol/L,透前血钾与透析液钾浓度差为3.64±0.57 mmol/L,余基线资料见表1。轻度高钾血症11例、中度6例和重度8例。8例(32.0%)患者表现为心电图异常,包括T波高尖、PR间期延长和(或)P波振幅减低。
环硅酸锆钠剂量和降钾效果治疗剂量调整期结束时,透前血钾为4.83±0.33 mmol/L,19例(76%)透前血钾降至目标范围,余5例透前血钾在5.0~5.5mmol/L,仅1例透前血钾仍为5.82 mmol/L。非透析日环硅酸锆钠维持剂量为5g、10g和15g的患者分别为11例(44%)、13例(52%)和1例(4%)。轻度高钾患者环硅酸锆钠非透析日剂量为5g/d,中度和重度高钾患者环硅酸锆钠剂量为10g/d。在治疗观察期间,透前血钾维持在4.85±0.36 mmol/L,17例(68%)患者短透析间期4次透析前血钾中至少有3次血钾维持在4.0~5.0 mmol/L。治疗观察期间透析前血钾较基线透前水平明显降低(P<0.001)(图3)。

表1 环硅酸锆钠治疗前后临床和实验室指标比较
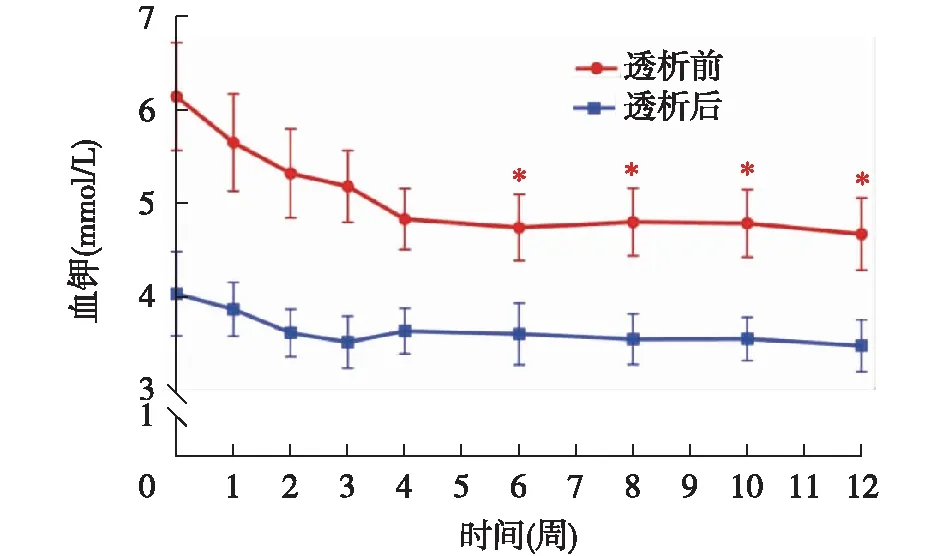
图3 环硅酸锆钠治疗期间透析前后血钾浓度变化(*与基线时相比,P<0.01)
在剂量调整期间,透析前与透析后血钾浓度差、透析前血钾与透析液钾浓度差逐渐下降。治疗观察期间,透析前血钾与透析后血钾浓度差(1.20±0.40 mmol/L)、透析前血钾与透析液钾浓度差(2.25±0.36 mmol/L)均明显低于基线水平(P<0.001)(图4)。在治疗观察期间,无患者透析前血钾<3.5 mmol/L,3例(12%)患者出现透析后血钾<3.5 mmol/L,患者下机后无明显不适。环硅酸锆钠治疗后心率、收缩压、舒张压、透析间期体重增长率、透析充分性及实验室指标均无差异(表1)。

图4 环硅酸锆钠治疗期间透析前后血钾浓度差、透析前血钾和透析液钾浓度差变化(*与基线时相比,P<0.01)
不良反应环硅酸锆钠治疗期间3例(12%)患者出现胃肠道反应,主要表现为上腹不适,均发生在药物剂量增加期间,未药物干预治疗,其中1例增加至非透析日15 g/d时不能耐受,减量致10 g/d维持,治疗观察期该患者透析前血钾未达标。
讨 论
高钾血症是CKD患者常见的并发症之一,也是引起HD患者死亡的主要因素之一[5-6]。高钾血症是一个反复发作的慢性过程,首次高钾血症发作后,患者可能持续处于高血钾状态。法国14个HD中心的527例HD患者数据显示,40%高钾血症会在一个月内复发[7]。丹麦国家患者数据库显示HD患者高钾血症中位复发时间<40d[8]。本研究中29.2%HD患者表现为复发性高钾血症。2016年美国肾脏病基金会的《慢性肾脏病高钾血症管理指南》首次明确了急性与慢性高钾血症的病因差异,指出如果患者存在慢性钾排泄障碍,如CKD导致的高钾血症,由于其病因持续存在,属于慢性高钾血症。将慢性高钾血症或复发性高钾血症定义为1年内高钾血症发作次数>1次[1]。此后国内外指南开始注重CKD患者高钾血症的长期管理[4,9-11]。
然而,慢性高钾血症的长期管理在临床实施过程中面临诸多挑战。识别并纠正高钾血症反复发作的诱因是慢性高钾血症长期管理的基础。本研究中16%的患者应用ACEI/ARB类药物,而肾素-血管紧张素-醛固酮抑制剂(RAASi)是诱发高钾血症的重要药源性因素[12]。尽管减量或停用RAASi可以一定程度上减少高钾血症的发生,但同时也是会增加患者全因死亡风险和不良心血管事件风险[13]。HD患者通过透析清除钾,药物诱导并促进钾的重新分布与排泄也是治疗高钾血症的重要方式。然而,高糖联合胰岛素、降钾树脂等传统降钾方案不适用于HD患者长期治疗或存在疗效、耐受性等问题无法满足临床需求[14]。
环硅酸锆钠作为新型钾离子结合剂,在全肠道内通过置换钠离子而高选择性地捕获钾离子,以减少肠道内钾离子吸收,从而快速有效地降低血钾浓度,其治疗高钾血症的有效性和安全性已得到证实[15-17]。目前DIALIZE研究是唯一一项评估环硅酸锆钠治疗HD患者高钾血症的临床研究[3]。本研究中在环硅酸锆钠治疗调整期,76%高钾患者透析前血钾降至4.0~5.0 mmol/L,而在治疗观察期间,68%患者4次透析前血钾中至少有3次血钾维持在目标范围。虽然本研究以短透析间期透析前血钾作为治疗目标,DIALIZE研究以长透析间期透析前血钾作为治疗目标,两项研究基线血钾水平相当,但是本研究降钾疗效优于DIALIZE研究的41.2%的达标率。这可能是因为本研究以降钾药物为基础,同时配合患者教育和饮食管理的综合降钾治疗,而DIALIZE研究期间患者未特殊限制饮食。本研究也发现轻度高钾血症患者非透析日服用5g环硅酸锆钠,中度和重度高钾血症患者服用10g时,可获得较好降钾疗效,临床需制订个体化治疗方案。
本研究中透析液钾浓度为2.5 mmol/L,环硅酸锆钠治疗期间,透析前后血钾浓度差、透析前血钾与透析液钾浓度梯度均明显降低,其中3例患者出现透析后低血钾。HD患者血钾与全因死亡风险呈U型曲线。透析前血钾4.6~5.3 mmol/L的HD患者可获得最大生存率,而血钾<4.0 mmol/L或≥5.3 mmol/L均增加死亡风险[18]。透析前血钾水平越高,透析前血钾与透析液钾浓度梯度越大,透析前后血钾波动亦越大。透析期间血钾波动大是HD患者心律失常和心源性猝死的危险因素[19]。透析前血钾与透析液钾浓度高梯度也增加全因住院和急诊就诊风险[20]。HD患者透析后发生心律失常往往存在透析后低血钾,而透析后低血钾患者的全因死亡风险增高[21-22]。因此,环硅酸锆钠可减轻透析前后血钾波动,维持血钾平稳,有利于改善高钾患者预后,但需定期监测透析后血钾,及时调整药物剂量或透析液钾浓度,避免透析后低血钾引起的不利影响。
环硅酸锆钠为无机晶体硅酸锆化合物,在水中稳定性高且不膨胀,故便秘、腹痛、腹胀等胃肠道反应较树脂类降钾药物发生率低[23]。本研究中环硅酸锆钠主要药物不良反应表现为上腹不适,且均发生在药物剂量增加期间,可能与环硅酸锆钠一过性增加胃内酸碱度值有关[24]。环硅酸锆钠通过置换钠离子清除钾离子,而5g环硅酸锆钠含400 mg钠,故患者容易出现体液超负荷,程度与药物剂量呈正相关[15]。本研究中患者透析间期体重增长率在环硅酸锆钠治疗后较基线升高,但与基线相比无统计学差异。
本研究为观察性研究,存在一定局限性,未监测患者长透析间期透析前后血钾变化,未观察停药后血钾变化情况,仅短期观察环硅酸锆钠在HD患者的降钾疗效。未来还需前瞻性对照研究进一步明确环硅酸锆钠在治疗HD患者慢性高钾血症的长期疗效和安全性。
小结:本研究通过单中心前瞻性临床观察,证实环硅酸锆钠可有效降低HD患者短透析间期透析前血钾,显著改善MHD患者慢性高钾血症,减轻透析前后血钾波动,为MHD患者慢性高钾血症治疗提供临床参考。胃肠道反应是该药物的主要不良反应,发生在环硅酸锆钠药物剂量增加期间,症状轻,患者耐受良好,因此,环硅酸锆钠治疗剂量应根据血钾动态变化与患者耐受情况进行个体化调整。
