巨噬细胞在急性肾损伤向慢性肾脏病转化中的作用
2022-03-09张雅飞朱杰夫综述宋志霞审校
张雅飞 朱杰夫 综述 宋志霞,3 审校
急性肾损伤(AKI)是指各种因素导致的肾功能在几小时甚至几周内迅速下降为主要临床表现的急危重症。流行病学以及病因学研究均发现AKI后发展至慢性肾脏病(CKD)的风险显著上升,严重时可进展至终末期肾病,给患者及其家庭和社会带来沉重的负担,已成为全球性的公共健康问题。AKI进展至CKD的主要病理特点是不断进展的肾脏纤维化。在缺血再灌注损伤(IRI)、中毒、脓毒症、梗阻或免疫介导等因素刺激下,肾小管上皮细胞(TEC)是主要的受累细胞,严重时甚至死亡,随后启动一系列的病理生理过程,同时伴随着持续炎性细胞及巨噬细胞的浸润和活化[1](图1)。近年来大量的研究显示,AKI会触发巨噬细胞的浸润、活化等一系列炎症反应及随后的修复过程,且发现不同病因引起的肾损伤组织中浸润的巨噬细胞状态不同,发挥的作用也不同[2]。肾脏IRI近年被证实为由固有免疫和适应性免疫均参与的炎症性疾病,巨噬细胞发挥促炎、促纤维化或抗纤维化作用呈现阶段性差异。本文重点综述巨噬细胞在肾IRI不同阶段的作用与机制,以期为寻找防止AKI向CKD发展的关键靶点、制定治疗策略提供新的思路。
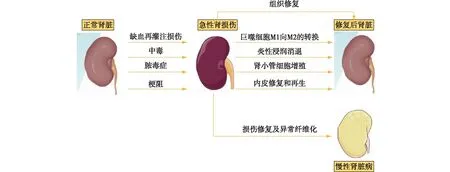
图1 急性肾损伤后的组织损伤及修复
巨噬细胞的异质性与可塑性
正常生理条件下,巨噬细胞可表现许多不同的表型,在组织损伤的情况下,当局部微环境被病原体、细胞损伤、先天和适应性免疫反应、缺氧和组织修复过程等因素破坏时,募集到受损部位的单核细胞可以分化成多种巨噬细胞表型(图2)。最初人们根据巨噬细胞的活化状态分为M1(经典活化型)和M2(替代活化型)。被干扰素γ(IFN-γ)/脂多糖激活,高水平表达一氧化氮合酶(iNOS)和促炎细胞因子如肿瘤坏死因子α(TNF-α)、白细胞介素6(IL-6)、IL-12和核因子κB (NF-κB),发挥促炎、抗菌、杀伤肿瘤等功能的为M1。IL-4/IL-13诱导的M2巨噬细胞,高表达胰岛素样生长因子1,甘露糖受体1、CD206和精氨酸酶1,具有抗炎、促进伤口愈合的作用。然而对于体内复杂的微环境,巨噬细胞的基因表达谱的变化简单用M1/M2区分不能完全反映体内的真实状态。随着技术的发展,对体内巨噬细胞复杂性和多样性的认识不断提高,巨噬细胞分类将更加精细。Anders等[3]认为在体内,可根据疾病损伤修复愈合的不同阶段将按功能分为四种类型,包括促炎型、抗炎型、促纤维化型及纤维溶解型。深入理解疾病不同阶段巨噬细胞募集、活化和浸润的动态变化和损伤特异性,将为寻找治疗靶点、提高疗效提供依据。
作为对肾脏损伤的反应,骨髓会增加外周血中单核细胞的产生和释放。循环中的经典单核细胞被招募到肾脏,在肾脏损伤的早期阶段,分化为促炎的M1巨噬细胞,以应对细胞损伤。而在组织修复阶段,细胞主要为抗炎M2表型。其中M2b和M2c巨噬细胞主要负责免疫抑制、基质重建和伤口愈合,未恢复的损伤通过IL-4和IL-13在受损肾脏中触发M2a巨噬细胞极化,导致转化生长因子β1(TGF-β1)增加和肾脏纤维化。
巨噬细胞在肾脏损伤、修复过程中的作用与机制
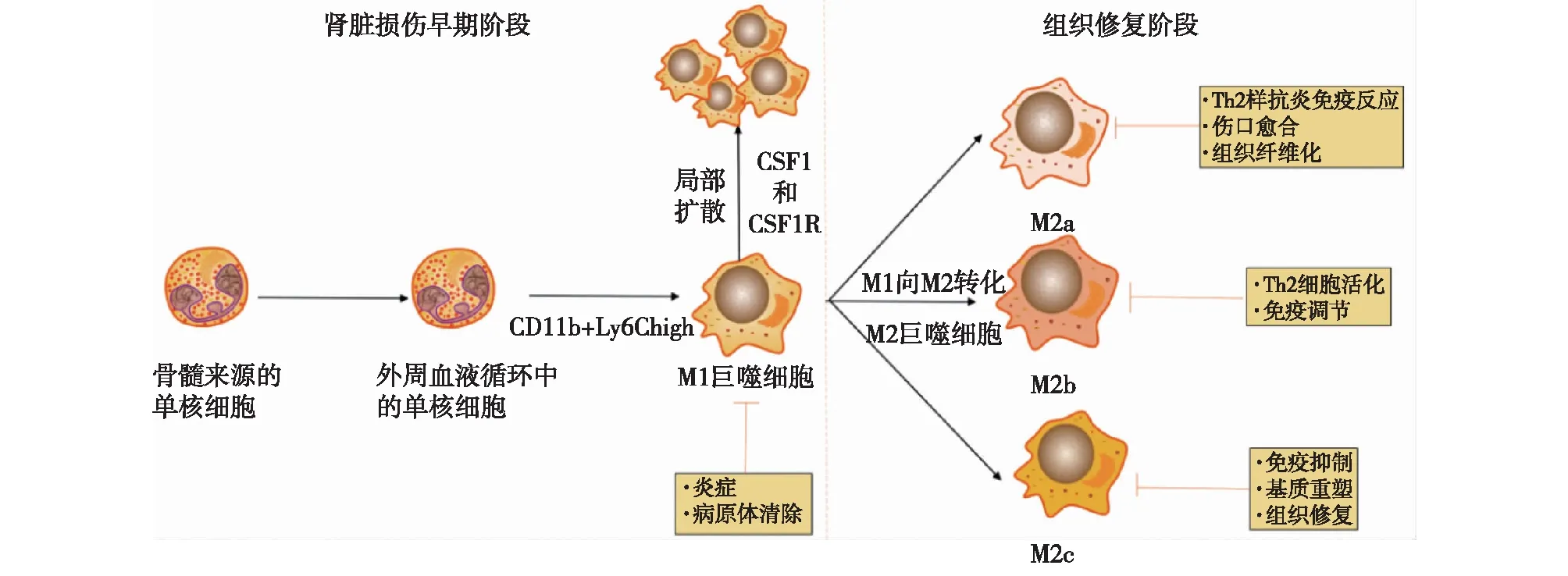
图2 损伤肾脏中骨髓来源的单核细胞和巨噬细胞的表型和功能CSF1:集落刺激因子1;CSF1R:集落刺激因子1受体;Th2:辅助性T细胞
损伤早期巨噬细胞聚集是肾脏炎症损伤的特征性表现,其来源主要由血液中单核细胞募集至肾脏以及肾脏固有巨噬细胞的增殖组成[4]。正常肾脏中的巨噬细胞较少,但在肾损伤后,肾脏内滞留的巨噬细胞数量显著增加[5]。在实验性AKI后24h内,循环中的Ly6Chigh单核细胞通过趋化因子受体2和CX3C趋化因子受体1迁移到肾脏炎症部位[6]。而中性粒细胞聚集产生的活性氧、坏死的TEC释放损伤相关的分子模式、固有树突状细胞激活自然杀伤T细胞产生的IFN-γ等系列反应进一步促进肾脏固有巨噬细胞以及新募集的单核细胞在肾脏浸润转化为巨噬细胞。未分化巨噬细胞表面分子标志物为CD68,研究发现临床上广泛使用抗炎药物糖皮质激素,能够显著减低AKI后CD68阳性巨噬细胞浸润,减轻肾损伤[7]。
在AKI过程中,在炎症环境下未分化的巨噬细胞主要分化为M1型,IFN-γ、TNF-α和脂多糖在体外也可诱导M1型巨噬细胞活化,这一结论在肾脏IRI、抗肾小球基膜肾小球肾炎、顺铂肾毒性、阿霉素肾病、狼疮性肾炎、肾移植损伤等多种动物实验中得到验证[8]。另外,TEC来源的外泌体RNA和microRNA可诱导AKI肾脏中M1巨噬细胞表达和肾脏损伤[9-12],证实损伤的肾实质细胞可影响浸润的巨噬细胞表型分化。随后有研究证实在缺血AKI前敲除巨噬细胞可减轻肾功能下降和肾小管损伤,而将IFN-γ诱导的M1巨噬细胞回输到巨噬细胞缺陷小鼠,保护作用消失[13],从而表明M1巨噬细胞在AKI的早期阶段起致病作用。
修复阶段Saha等[14]研究证实,巨噬细胞由M1向M2的转变,在AKI恢复阶段,对于受损TEC的增殖和再生至关重要,一般在缺血性AKI后第3天增加。Baek等[15]发现,在缺血AKI后期修复过程中Ly6G-F4/80+NOS2+TNF-α+(M1样)巨噬细胞向Ly6G-F4/80+Arginase1+Dectin-1+CD206+(M2样)巨噬细胞的表型转化,M2细胞群广泛参与了从损伤到恢复的过程,从而有助于维持细胞的生存和增殖,促进组织愈合[16]。随着对巨噬细胞功能的认识,有学者进一步将M2型巨噬细胞分为M2a,M2b,M2c三种亚型。IL-4和IL-13诱导的巨噬细胞M2a型缺失显著抑制了IRI后TEC增殖,肾组织的修复过程明显延迟,并伴随M1型标志物增加和M2型标志物的降低[17]。免疫复合物和Toll样受体(TLR)和/IL-1受体(IL-1R)配体的分化诱导M2b巨噬细胞分化,在小鼠狼疮性肾炎模型中,主要以促炎型M2b浸润为主,而血清淀粉样P物质介导巨噬细胞吞噬DNA,促进M2b转化为抗炎性M2a,延缓狼疮肾炎的进展;IL-10、TGF-β和糖皮质激素诱导M2c巨噬细胞分化,具备免疫抑制、诱导调节性T细胞表达的功能[18]。
纤维化阶段在持续或不可逆的肾损伤后,巨噬细胞可能参与肾脏纤维化,其作用机制尚不完全清楚。在IRI后72h,用氯膦酸脂质体长期耗竭巨噬细胞可减少晚期肾脏纤维化,表明巨噬细胞参与损伤后纤维化,巨噬细胞分泌许多分子,包括IL-1、基质金属蛋白酶2、半乳糖凝集素3和血小板衍生生长因子等,促进肾纤维细胞的增殖和活化[18-19]。TGF-β和促纤维化巨噬细胞在肾组织中的持续聚集和激活通过转化为表达α平滑肌肌动蛋白(α-SMA)肌成纤维细胞,从而增加肌成纤维细胞的增殖和活化,破坏正常的肾脏结构并促进肾纤维化,最终形成瘢痕组织[20]。Tang等[18]学者将该过程称为巨噬细胞向成肌纤维细胞转化(macrophage—myofibroblast transition, MMT)。除了TGF-β之外,Rictor/mTORC2信号转导可促进巨噬细胞活化,沉默巨噬细胞Rictor可减少肾脏纤维化和M2巨噬细胞极化,减少促纤维化细胞因子的产生, 减轻单侧输尿管梗阻(UUO)或IRI后肾纤维化[20]。IL-4和IL-13激活JAK3/STAT6 也可以刺激巨噬细胞MMT过程[21],提示MMT 在AKI向CKD转变过程中发挥重要作用。
干预巨噬细胞作为AKI的治疗靶点
靶向单核细胞招募积聚在受损肾脏的巨噬细胞几乎全部来源于骨髓单核细胞,靶向趋化因子(如CCL2,CCL5,CXCL16和CCL21),趋化因子受体(如CCR2,CXCR6,CCR7和CX3CR1),补体受体(如C3aR和C5aR)或脾酪氨酸激酶(SYK)可调节血液单核细胞募集到受损肾脏[18](图3)。CCL2是一种重要的单核细胞趋化因子,基因和药物阻断CCL2或其受体CCR2在肾脏炎症和纤维化模型中具有保护作用[22]。CCR2拮抗剂治疗糖尿病肾病的Ⅱ期试验获得成功,目前已进入Ⅲ期临床试验[23]。CXCL16可促进表达CXCR6的单核细胞和/或巨噬细胞从骨髓中募集,导致Ⅰ型胶原+细胞积聚,增加UUO模型的纤维化程度[24]。因此,靶向CXCL16或其受体CXCR6可防止骨髓源性肌成纤维细胞的积聚。CCL21及其受体CCR7也促进了UUO模型中巨噬细胞和Ⅰ型胶原+成纤维细胞的聚集,抗CCL21抗体治疗有效地抑制了这种骨髓源性成纤维细胞和肾纤维化的浸润,具有治疗潜力[25]。
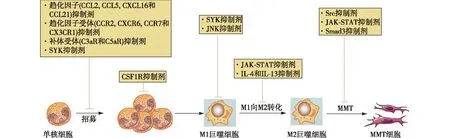
图3 干预单核细胞和巨噬细胞可作为新的治疗靶点CCR:趋化因子受体;MMT:巨噬细胞向成肌纤维细胞转化;IL:白细胞介素;CSFIR:集落刺激因子1受体;SYK:脾酪氨酸激酶;JNK:Jnn N末端激酶;JAK-STAT:Janus激酶-信号转导和转录激活因子
靶向巨噬细胞增殖集落刺激因子1受体激酶抑制剂可以调控肾脏巨噬细胞的增殖[26]。靶向集落刺激因子1受体可减少巨噬细胞的积聚和肾损伤,而不影响血液单核细胞的数量[27]。针对集落刺激因子1受体的小分子激酶抑制剂和中和抗体正在进行临床试验,用于治疗各种类型的肿瘤,目的是抑制肿瘤相关巨噬细胞的积聚[28]。
靶向巨噬细胞相关促炎细胞因子抑制或调节炎症反应可以防止或延缓CKD的进展。调节巨噬细胞表型最常用的方法是调节M1的相关细胞因子,如IL-1、TNF-α及单核细胞/巨噬细胞关键趋化因子MCP-1/CCL2, IL-1R拮抗剂(IL-1Ra)可改善大鼠的抗肾小球基膜抗体相关肾炎。TNF-α基因敲除或沉默通过减少纤维化和肾小球硬化减轻高脂饮食诱导的小鼠肾损伤,提示抗TNF-α治疗可保护肾脏[29]。MCP-1/CCL2是炎症反应过程中单核细胞募集和分化的主要因子,其已成为基础肾脏疾病研究的靶点[30]。
靶向巨噬细胞分化诱导巨噬细胞分化也是减少肾脏炎症反应的潜在途径,包括细胞因子刺激以及基因转染等手段已广泛研究,以减少肾脏疾病的炎症反应。不同细胞因子可用于诱导巨噬细胞表型分化来治疗各类急慢性肾损伤。输注IFN-γ诱导的M1巨噬细胞加重了小鼠IRI损伤,而输注IL-4诱导的M2巨噬细胞起到了肾脏保护作用[13]。在小鼠肾小球肾炎中,通过IL-4/IL-13的体外培养,将骨髓源性巨噬细胞转化为M2表型,再回输小鼠可减少肾损伤、蛋白尿和肾小球炎性细胞浸润[31]。在IRI模型中,输注过表达血红素加氧酶1腺病毒的骨髓源性巨噬细胞减轻肾损伤[32]。
单核细胞可以分化为M1、M2巨噬细胞和肌成纤维细胞,在肾脏损伤的整个过程中,这些分化程序可以作为预防肾脏损伤的靶点。
小结:近年来针对巨噬细胞在AKI向CKD转化的研究突出了肾损伤后巨噬细胞活化和功能状态的复杂性和多样性。当前的治疗策略包括靶向巨噬细胞数量和极化巨噬细胞等环节,并取得了一定的进展。未来利用更尖端技术,包括单细胞RNA测序、基因组学和蛋白质组学以及空间转录分析等,将提高对巨噬细胞表型和功能的理解。在特定的微环境中精准干预巨噬细胞将成为治疗AKI向CKD转化过程中富有潜力的研究领域。
