细胞dNTP库的稳态维持与基因组稳定性
2022-03-08刘聪冯佳妮李玮玮朱伟伟薛云新王岱赵西林
刘聪,冯佳妮,李玮玮,朱伟伟,薛云新,王岱,赵西林
综 述
细胞dNTP库的稳态维持与基因组稳定性
刘聪,冯佳妮,李玮玮,朱伟伟,薛云新,王岱,赵西林
厦门大学公共卫生学院,分子疫苗学和分子诊断学国家重点实验室,厦门 361102
作为DNA合成的重要前体,细胞中4种脱氧核糖核苷三磷酸(dATP、dTTP、dGTP和dCTP)是DNA复制、重组和修复所必需的原材料,而DNA的正确合成及其完整性则是基因组稳定性的重要体现,因此dNTP库状态的稳定对维持基因组的稳定进而保证细胞的稳定至关重要。从dNTP库的质量上讲,一些异质dNTP如氧化的dNTP掺入DNA容易引发碱基替换甚至DNA断裂重排,会极大地损害基因组的稳定性。但与此同时,细胞也进化出了相应的NTP焦磷酸酶将其清除,并且细胞也会通过形成DNA损伤修复网络来校正损伤的DNA及修复DNA缺口。从dNTP库的数量上讲,dNTP的浓度及比例失衡也会造成碱基突变和移码突变,这同样会引发基因组不的稳定性,由此细胞进化出了庞大的酶控网络以对其进行精密调控。本文主要综述细胞内dNTP库组分受损的潜在危害及受损dNTP的清除和dNTP库组分间平衡的调控及失衡的后果,最后介绍了与dNTP库稳态相关的临床疾病,旨在为细胞dNTP库的稳态维持与基因组稳定性的相关性研究提供一定的思路方向,最终为相关疾病的治疗提供部分理论依据。
dNTP池;质量控制;数量调控;基因组稳定性;临床疾病
DNA是生物细胞内遗传信息的携带者,指导生物体完成生命活动。遗传信息从DNA转录“流入”RNA,再通过RNA翻译“流入”蛋白质,最后由蛋白质承担生命活动。DNA上不同脱氧核糖核苷酸排列的方式决定了不同的遗传信息,该信息的精准调控是生物体完成正常生命活动的前提保证。生物体主要依靠以下几种机制实现DNA复制的高保真度:(1)核苷酸遵守严格的碱基互补配对规则;(2) DNA聚合酶5′→3′DNA聚合活性中心选择具有正确几何形状的核苷酸;(3)DNA聚合酶3′→5′外切活性中心校对复制出错的核苷酸;(4)DNA错配修复(mismatch repair,MMR)系统捕捉更正逃避校对的错配核苷酸[1]。此外,细胞内还有许多的调控网络用以维持DNA的正常状态,从而避免损伤的、可能引发诱变的DNA进入下一轮复制。
关于DNA复制的保真度问题,越来越多的研究聚焦于DNA的前体状态,即4种脱氧核糖核苷三磷酸(dATP、dTTP、dGTP和dCTP)的质量和数量是否处于正常状态。细胞内的4种dNTP的浓度并不是保持相等,且总浓度也并非处于恒定的状态。在一般情况下,4种dNTP的浓度比值处于一定的范围,普遍的情形是在真核细胞和原核细胞内dGTP浓度都是最低的,并且总dNTP浓度维持在较低水平[2]。而dNTP库(池)本身容易受到细胞自身及许多环境因子的影响,引起非正常的化学修饰。此外,dNTP库的大小及组成也受胞内代谢网络的调控,代谢网络的扰动可能导致dNTP库大小改变或者某种dNTP的比例发生变化,这些因素都有概率引发DNA复制保真度的降低,从而影响基因组的稳定性。
基因组不稳定性主要涉及点突变和基因重排:点突变包括碱基替换、微插入和微缺失;基因重排则包括DNA序列的缺失、重复、扩增、插入、倒位或易位[3]。点突变主要出现在DNA复制和修复的过程中,基因重排则受到两种因素的控制:(1)抑制因子,包括复制、修复和S期检查点因子;(2)染色体位点,包括脆弱的位点和高度转录的DNA序列[4]。而dNTP库作为DNA合成的前体,其质量和数量的稳态维持对于点突变和基因重排出现的节点都具有重要影响。从群体的角度来看,点突变和基因重排都为生物进化扩充了原材料,对生命适应不断变化的自然环境具有积极作用。但是对于细胞和生命个体来讲,基因组的不稳定性引发的基因功能改变很有可能是具有消极作用甚至是致命的。本文主要以细胞为讨论对象,阐述了其如何通过维持dNTP库的稳态来保证基因组的稳定性,从而使细胞和生命个体能够进行正常的生命活动。
1 dNTP质量调控
1.1 dNTP损伤可能导致DNA复制的保真性下降
在质量上,游离的dNTP库因其不稳定的化学特性容易被氧化、脱氨基化,而那些被修饰或损伤的dNTP被掺入DNA是有毒的或引起诱变的,这需要受到生物体的严格把控。所有好氧生物都离不开氧气,而这些生物体内的有氧代谢也依靠O2参与来产生生命所需的能量以及各种代谢产物,但随之而来的是活性氧(reactive oxygen species,ROS)的产生。ROS主要包括过氧化氢(H2O2)、有机氢过氧化物(ROOH)、超氧阴离子自由基(O2·−)、羟自由基(·OH)等等。ROS有多种来源,包括有氧呼吸中的氧化磷酸化电子传递链,过渡金属离子以及一些外界因素刺激如电离辐射、化学氧化剂等,因此ROS的产生是难以避免的。同时ROS也是一把双刃剑,它既可作为多效信号分子来调节代谢网络,也可能引发氧化应激反应产生生理毒性[5,6]。
DNA尽管是构成生命基础的核心部件(RNA病毒除外),但从化学意义上讲,DNA其实是一种不太稳定的分子,游离的dNTP化学活性更高[7],因此两者都极容易产生氧化损伤,其中一个研究较为透彻的例子是8-氧代-7,8-二氢鸟嘌呤(8-oxo-G)。由于鸟嘌呤(G)的氧化还原电势在几种碱基里相对较低,因此其特别容易被氧化,产生几种不同的氧化产物,数量最多并且最为典型的就是8-oxo-G[8]。8-oxo-G在空间结构上和胸腺嘧啶(T)的顺式构象极为相似,这可能引发错误的A:8-oxo-G配对取代正确的C:8-oxo-G碱基对匹配[9]。更严重的问题是,由于它模仿了沃森克里克经典配对模型,无法在DNA主链中引起错误的不正常扭曲,A:8-oxo-G错配并不能被DNA聚合酶的3′→5′外切校对。相反,正确的C:8-oxo-G碱基对被认为是错配,最终导致C:8-oxo-G配对效率低下,在经历下一轮复制后最终产生C:G→A:T的转化突变[10~13]。ROS攻击核酸碱基会形成多种不同的化学修饰,例如环饱和和环片段化的胸腺嘧啶(T)残基,这类修饰主要引起细胞毒性损伤,对基因组突变诱导的贡献很小。其他一些碱基氧化产物则会引起配对错误并引发诱变,例如2-羟基腺嘌呤的掺入会形成A:T→G:C和A:T→T:A的突变,5-羟基胞嘧啶的掺入会形成C:G→T:A和C:G→G:C的突变,5-甲酰尿嘧啶的掺入会形成T:A→C:G和T:A→A:T的突变,5-羟基尿嘧啶和尿嘧啶二醇掺入会形成C:G→T:A的突变等[14]。而8-oxo-G是引发诱变的主要参与者,据估计8-oxo-G的损伤在正常组织中的稳态水平下约为103个/细胞/天,在癌组织中更高达105个损伤/细胞/天[15]。这些非经典dNTP的产生基本上都会诱发点突变的生成甚至DNA的断裂,这极大地损害了基因组的稳定性。为了防止这些情况的发生,生物体进化出了相应的清除校正机制。
1.2 生物体内清除损伤dNTP的主要机制
为了保证dNTP库的质量,生物体进化出了许多NTP焦磷酸酶,这些酶可以将已修饰的NTP水解为相应的单磷酸酯(图1A)。例如,肌苷三磷酸焦磷酸酶(ITPase)可以将脱氨基嘌呤核苷三磷酸(ITP和dITP)水解为核苷单磷酸[16,17]。这些酶被称为“清洁酶”,主要被划分为几类结构性超家族(表 1),包括Nudix结构水解酶(具有高度保守的23个氨基酸残基序列,称为Nudix盒)、全β dUTP焦磷酸酶(蛋白质的二级结构均由β折叠构成)、ITP焦磷酸酶和全α NTP焦磷酸酶(蛋白质的二级结构均由α螺旋构成)[18-19]。
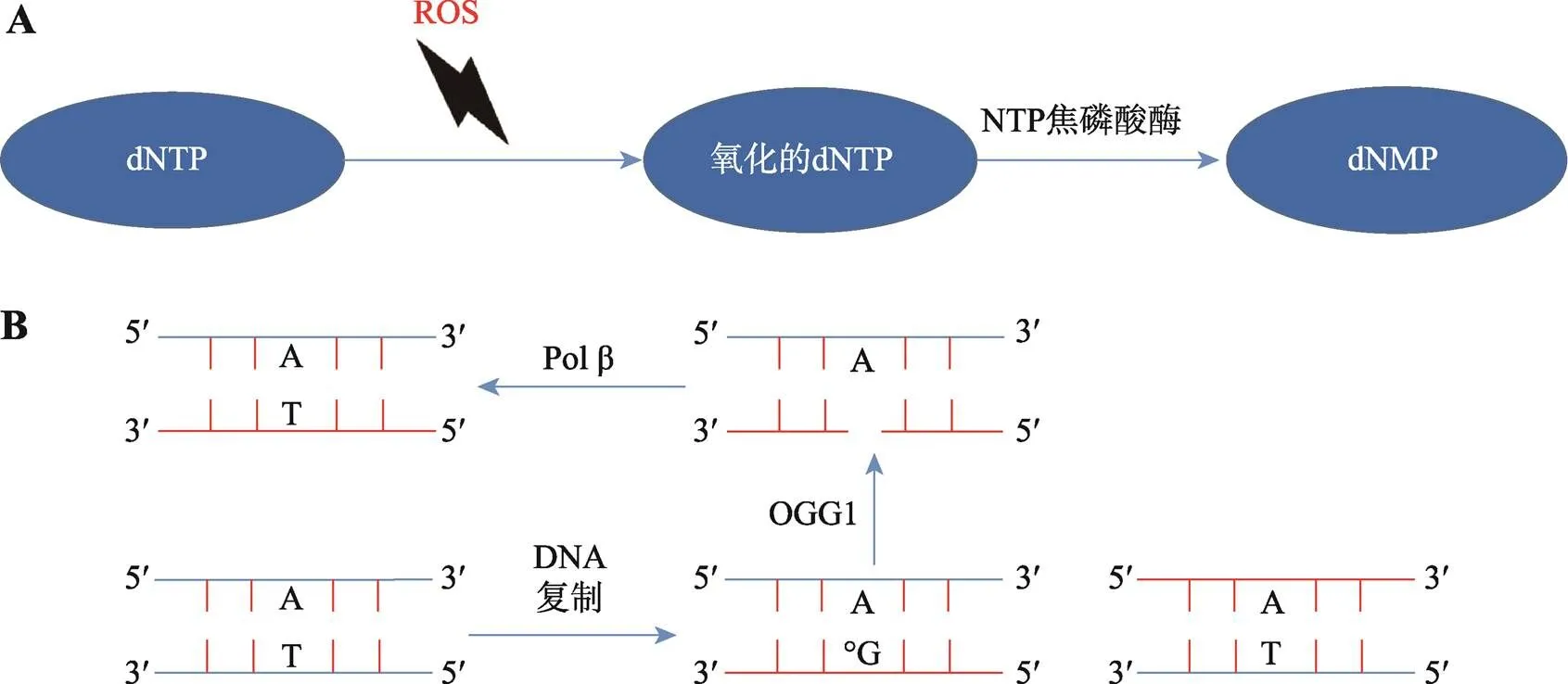
图1 生物体内dNTP库的清洁及双链DNA中受损碱基的清除
A: dNTP被氧化修饰后通过NTP焦磷酸酶水解为相应的单磷酸酯;B: DNA复制过程中被掺入氧化损伤的碱基通过BER切除。
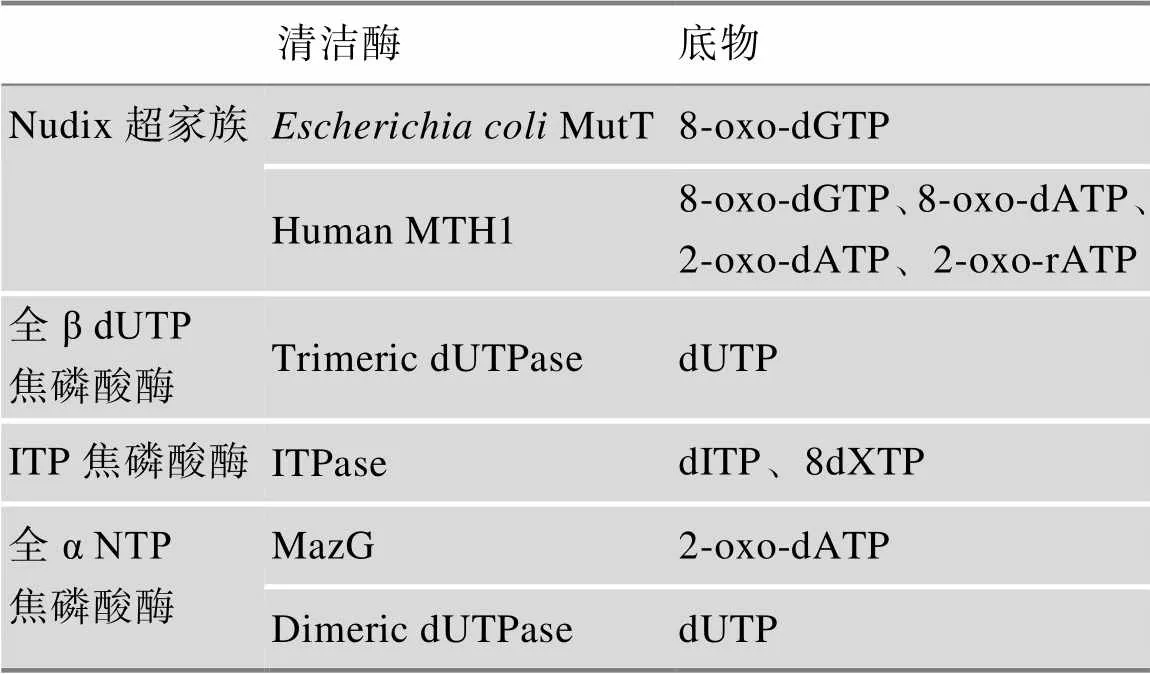
表1 生物体内的dNTP库清洁酶及其底物
1.2.1 Nudix超家族
大肠埃希氏菌MutT是第一种被认为可以用来清洁dNTP库的酶,最初被定义为低特异性水解dGTP和其他典型的NTP焦磷酸酶[20]。然而,随后的研究表明,8-oxo-dGTP相比dGTP具有更高的亲和力[21]。MutT的酶活位点包含几个残基,可帮助区分位于催化位点附近的这两种NTP。人类MTH1 (MutT同源酶)对8-oxo-dGTP、2-oxo-dATP和8-oxo-dATP也具有活性[22]。Nudix超家族的酶水解多种底物,包括二核苷多磷酸盐、加帽的RNA和二核苷酸辅酶。因此,一些Nudix超家族酶不仅可以水解dNTP来对dNTP库进行直接清洁,还可以通过清除与dNTP代谢相关的各种产物来进行间接清洁[23]。
1.2.2 全β dUTP焦磷酸酶
在所有非经典NTP中,最常见的是dUTP,它是细菌胸腺嘧啶核苷酸生物合成的中间体,由dCTP脱氨基产生并被dUTPase水解为dUMP。因此,细菌dUTPase被认为是典型的代谢酶。但是,将dUTP掺入DNA会引发尿嘧啶DNA糖基化酶的攻击,从而导致双链断裂,最终损害DNA的完整性。在细菌和酵母的研究中发现,dUTP数量的增加对细胞生长是有害的,dUTPase的功能对其保持生存能力至关重要[24~26]。同时在人类中发现,dUTPase对DNA复制的准确性是有积极作用的[27],但它具体如何参与细胞代谢尚未被广泛研究。
1.2.3 ITP焦磷酸酶
ITPases是非经典嘌呤核苷三磷酸[(d)ITP和(d)XTP]的水解酶,可以有效将其代谢并防止它们进入DNA和RNA中[28-29]。1964年首次在人的红细胞中被表征[30],后来陆续在其他生物体内也有发现,包括在古生菌中YggV和大肠杆菌中RdgB同源蛋白被表征。在高等生物中,这些非经典核苷三磷酸的掺入可能是诱变的,包括影响mRNA的转录以及进入DNA的双链合成[31],ITPase基因敲除的小鼠具有胚胎致死性这一事实也证明了这种诱变的严重危害[32]。针对脱氨基嘌呤类的清洁酶的冗余同样表明其在维持基因组稳定中的重要作用。然而,这些酶在细胞中的详细生理作用和分支仍需要进一步研究。
1.2.4 全α NTP焦磷酸酶
全α NTP焦磷酸酶超家族包括MazG、MazG样水解酶和二聚体dUTPase[33]。与上述全β dUTPase的功能相同,全α dUTPase可以水解dUTP,但由于蛋白质结构的显著差异,它也可以水解dUDP[34]。通常在某些原核和真核生物中不表达全β dUTPase的时候,全α dUTPase就会开始出现在我们的视野当中,这表明了dUTP水解对生物体的必要性。MazG和MazG样酶在生物体中普遍存在,并被认为只能将经典的NTP选择性水解为它们各自的单磷酸酯[35-36]。但最近的发现改变了这种看法,研究发现分枝杆菌MazG可对氧化的嘧啶5-羟基dCTP的细胞进行清洁[37],而人DCTPP1(XTP3-转活化蛋白A,dCTPase)更倾向于以修饰的dCTP作为底物,包括氟化、甲酰化或5-甲基dCTP[38]。
1.3 生物体内清除双链DNA中受损碱基的主要机制
当dNTP库清洁未完全,受损的dNTP就可能被掺入到DNA中,此外DNA因其化学特性也易被氧化,最终致使DNA双链中含有受损的碱基,同样这些受损的碱基也可能引起诱变和DNA损伤,与此同时生物体也进化出了相应的校正机制。
生物体主要依靠碱基切除修复(base-excision repair,BER)和MMR途径清除DNA双链中的受损碱基。以8-oxo-G为例,在大肠杆菌中,由两种DNA糖基化酶Fpg(也称MutM)和MutY来完成BER,清除校正掺入DNA中的8-oxo-G。Fpg可以切除释放DNA中被氧化损伤的8-oxo-G,而MutY则负责把8-oxo-G错配的A剪切。而Fpg和MutY的缺失都导致了很强的基因组碱基替换表型,其中的大部分都是GC到TA的转化[39]。
在酿酒酵母()中,主要由真核细胞独有的DNA糖基化酶OGG1完成BER以切除被氧化损伤的8-oxo-G,但是却并未发现MutY蛋白的功能同源物。研究表明酿酒酵母是依靠MMR来完成类似的生物学进程,通过复制性DNA聚合酶和DNA聚合酶η去除和8-oxo-G错配的A,此外聚合酶η也能够将C与8-oxo-G正确配对[40]。而由RAD6-RAD18和PCNA泛素化介导的复制后修复(post-replication repair,PRR)也为8-oxo-G诱变的预防做出了贡献。当RAD6-RAD18对PCNA进行单泛素化后,DNA聚合酶η更容易被招募至有氧化损伤的地方,进而把正确的C与8-oxo-G配对[41]。数据表明,OGG1是清除8-oxoG的主要力量,但MMR,PRR以及DNA聚合酶η也都发挥了不容小觑的作用。
哺乳动物细胞中主要依靠两种DNA糖基化酶OGG1和MUTYH完成BER。MUTYH是MutY的同源蛋白,负责与8-oxo-G错配的A的切除释放,OGG1则将C:8-oxo-G配对中受损的G清除(图1B)。与酿酒酵母相似,哺乳动物细胞中DNA聚合酶η和聚合酶λ也可以协同将C与8-oxo-G正确配对。此外其他途径包括核苷酸切除修复,MMR等都协同这两种蛋白构建了精密的氧化碱基清除机制[42]。当然,双链中8-oxo-G的清除机制只是生物体校正受损碱基一种经典的概述,其他例如单链断裂修复(single-strand break repair,SSBR),双链断裂修复(double-strand break repair,DSBR)尿嘧啶掺入造成的DNA断裂都对基因组的稳定起了相当大的作用。
2 dNTP库数量上的调控
2.1 dNTP库的失衡可能导致基因组不稳定
dNTP库的浓度受到多方面的调控,其可能因为生物体本身或外界因素引起失衡,包括总dNTP浓度的升高、降低,以及4种组分间的比例变化,研究表明这种失衡可能导致基因突变,原因可能主要归因于:dNTP库失去平衡后,多余的dNTP在DNA复制过程中会增加该种dNTP掺入子代DNA的概率,导致dNTP与模板的错误结合,进而诱发DNA碱基突变,而且这种突变一般倾向于发生在下一个被结合的dNTP是过盛dNTP的位置,这种现象被称为后核苷酸效应。而在生物体内存在多种dNTP浓度波动的情形,细胞由亲代产生子代需要经历完整的细胞周期,包括细胞间期和细胞分裂期,其中细胞间期又被分为G1,S,G2三个时期,dNTP浓度则跟随三个时期的变迁产生变化,从G1期到S期总体水平升高,S期水平到达峰值,随后在S期到G2期逐渐回落[43]。此外,有研究发现,一些DNA复制因子和修复元件的缺陷也会导致总dNTP浓度的升高[44]。而紫外线、电离辐射以及化学诱变剂等许多外界因素都可能引起DNA损伤,从而导致dNTP库的扩大[45]。在此情况下,DNA聚合酶的校对活性会被一定程度地抑制,从而导致其聚合活性高于校对外切活性,最终引起错误的核苷酸掺入,发生碱基替换[46]。有趣的是,dNTP饥饿也会导致总dNTP浓度的升高。在哺乳动物细胞中,休眠的细胞被激活进入细胞周期,许多复制起始因子的表达消耗了较多的dNTP,而dNTP饥饿则可能导致dNTP的过度补偿。严重的dNTP饥饿可能导致DNA的合成停止,复制叉停滞。中等水平的饥饿带来的影响可能更大,在此情况下,DNA的合成不会完全终止,但是一些难以复制的序列无法合成,最终产生不完整的染色体[47]。低水平的饥饿则可能导致核糖核苷单磷酸(rNMP)的掺入,而rNMP的校对相对不正确的碱基来说是比较困难的,掺入的rNMP容易使之后的DNA合成停滞[48]。最后,4种dNTP组分的比例失衡也可能导致基因突变。比例的变化会引发后核苷酸效应,致使错误的dNTP被DNA聚合酶掺入,进而产生碱基替换。在大肠杆菌中的研究显示,缺失株胞内dCTP水平增加4倍、dGTP水平降低2倍后,会导致G:C→T:A和A:T→T:A的突变效应分别增强27倍和42倍。此外,缺失株胞内dATP水平降低4倍、dCTP水平增加2倍后,导致了A:T→T:A的突变效应增强24倍。“错掺增强模板-引物错位”模型的提出也揭示了dNTP比例失衡可能会产生移码突变[49],在酵母中发现,与野生型菌株相比,菌株的dATP和dGTP水平分别增加了6.6倍和16倍,dCTP降低了12倍,导致该菌株的插入缺失率平均增加了66倍[50]。
2.2 dNTP库的数量调控机制
dNTP库的数量调控存在许多路径。至关重要的路径之一涉及到核糖核苷酸还原酶(RNR),该酶负责催化由核糖核苷酸到脱氧核糖核苷酸的反应,进而控制了总体dNTP的合成,此外该酶还可以控制4种dNTP的相对水平,使产生的dNTP维持一定的比例。RNR是一种极其保守的酶,在原核生物、真核生物中都有存在,其有多种亚型,最经典的是具有大小亚基的异源四聚体亚型,它是一种变构调节酶,在大亚基R1上含有两个变构调节位点。第一个调控位点可以感知ATP/dATP的比例变化,进而调节RNR的整体活性。第二个变构位点是dATP,ATP,dGTP和dTTP的特异性结合位点,当某种dNTP结合的时候,就会转换成催化相应NDP的激活态构象。作为从头合成dNTP的限速酶,生物体dNTP水平的调控很大程度上依赖于RNR的这种变构调节[51]。而RNR也借此在胞内众多生命进程中扮演了一个不可或缺的角色,例如细胞周期的进程与RNR的活性紧密相连,细胞在G0或在G1期RNR的活性被抑制,随着细胞周期到达G1晚期和S早期,活性显著上调,与之相互呼应的是RNR的小亚基仅仅在G1晚期和S早期表达,最终在S末期被降解,结果就是dNTP水平随RNR活性在细胞周期中先上升后下降[52]。此外,RNR通过上调活性来响应DNA损伤也是较为普遍的现象,例如大肠杆菌暴露于紫外线会引发RNR活性上升来提高dNTP水平,进而使大肠杆菌能够进行跨病变合成[53]。同样的,在酵母和果蝇中也有相同的现象[54]。
在大肠杆菌和人类细胞中,RNR催化的由核糖核苷酸到脱氧核糖核苷酸的还原反应是在核苷二磷酸水平发生的(NDP→dNDP)。之后,dNDP通过核苷二磷酸激酶(NDK)转换为dNTP。因此NDK同样在dNTP库的维持方面发挥了巨大的作用,研究发现,在NDK缺失的菌株中存在失衡的dNTP库,并且菌株自发突变频率增加了20~50倍[55]。此外,在SAMHD1缺失细胞中发现dNTP库出现失调,与之相应的是基因组的稳定性下降[56]。SAMHD1蛋白是一种水解酶,负责把dNTP切割成对应的的脱氧核苷和三磷酸。研究表明SAMHD1水解dNTP有助于细胞控制细胞分裂周期中的dNTP浓度,进而影响细胞周期进程。
除了这些与dNTP代谢直接相关或是极为关键的酶,dNTP水平的调控更是嵌入了一个巨大的核酸代谢网络(图2),dNTP的从头合成,嘌呤嘧啶的挽救等途径的扰动都会对dNTP水平产生巨大的影响。包括胸苷激酶(TK)、胸苷合酶(TS)、dUTP焦磷酸水解酶(Dut)等缺失导致dTTP数量的下降;叶酰聚谷氨酸合成酶(Met7)的失活导致高dUTP/dTTP比,促使尿嘧啶掺入基因组DNA;脱氧胞苷脱氨酶(DCD)缺失的细胞表现出失衡的dNTP库,并引发了诱变增加[57]。这些数据表明,dNTP库的代谢与稳态是一个巨大调控网络,一旦与之相关的途径受阻都会引发dNTP库的变化,最终导致基因组的不稳定。
3 维持dNTP库稳态的蛋白与临床疾病
3.1 调控dNTP库质量的蛋白与临床疾病
在各种细菌和酵母中进行的全局诱变研究表明,除了dUTPase外,清洁酶通常是非必需的,即使清洁酶发生缺失细胞仍可存活,并且没有表现出比较明显的生长缺陷。在大肠杆菌中,MutT蛋白功能完全丧失的突变体中除了导致突变率升高外,并没有产生其他明显的表型变化。突变体表现出的突变率也仅比野生型略高。但是,此类突变体在与组成型缺失后表现出了致死的表型。在酵母中的研究则显示,某些Nudix酶突变体传代至20代以后会产生生长缺陷[58]。而这种突变在人类和动物中的后果表现得比微生物更为明显。例如MutT直系同源蛋白MTH1功能丧失后导致了小鼠患癌率的明显上升[59]。
而在人类当中,MTH1的功能可能更为重要。在哺乳动物的大脑中成熟的神经元是不可再生的,必须在个体的整个生命周期中保持其功能的运转。而在成人大脑中神经元具有很强的代谢活性,每天大约有5 kg ATP的周转,仅占体重2%大脑的O2消耗量却占比全身的20%。这种大量ATP的使用必然会伴有大量ROS的产生,如超氧化物、过氧化氢和羟基自由基。ROS则会攻击氧化细胞内的蛋白质、脂质、核酸等生物大分子,因此神经元极易产生氧化损伤[60]。在这些生物大分子中核酸的氧化受损更加危险,核酸中携带的信息可能会因此发生改变,甚至导致细胞程序性死亡,而这种细胞的程序性死亡通常会导致退行性疾病的发生。8-oxoG作为一种主要类型的氧化碱基,已被发现在衰老过程中会在细胞核和线粒体基因组中积累,并且这种积累在患有各种神经退行性疾病的患者中表现得更加显著,例如帕金森病、阿尔茨海默病。
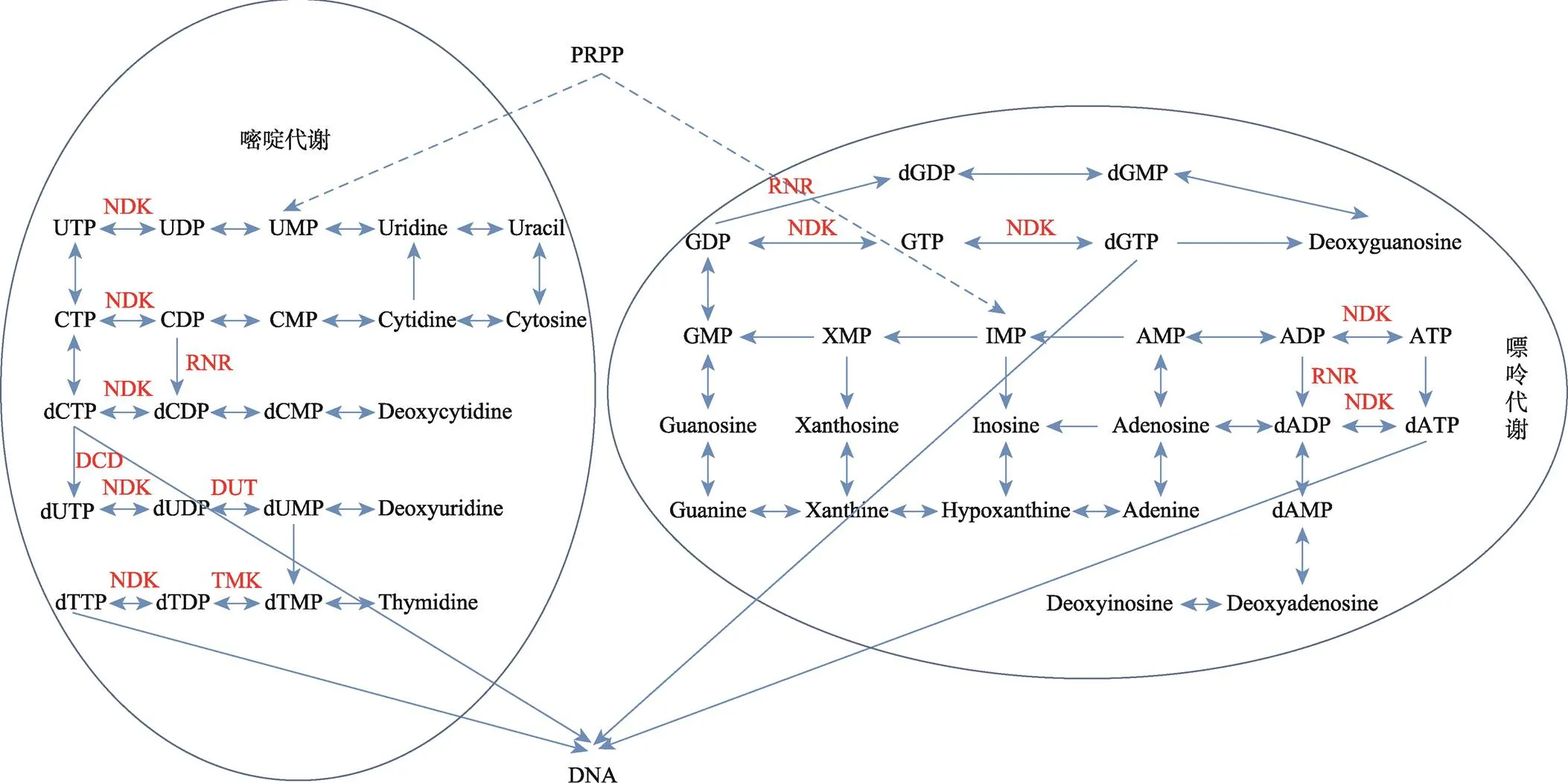
图2 生物体内部分核酸代谢网络
帕金森病(Parkinson’s disease,PD)是最常见的神经退行性疾病之一,PD患者的主要特征是黑质纹状体通路中多巴胺能神经元的丢失。研究表明[61],在PD患者的黑质纹状体多巴胺能神经元中,线粒体DNA或细胞质RNA中8-oxoG的积累相比对照组明显增加,与此同时定位于线粒体中的MTH1蛋白水平,以及OGG1-2a(OGG1在线粒体中的存在形式)相比对照组也明显增加。这可能表明患者幸存的黑质纹状体多巴胺能神经元中MTH1表达增加可以起到对细胞的保护作用。
阿尔茨海默病(Alzheimer’s disease,AD)是一种迟发性、进行性、年龄依赖性的神经退行性疾病,其特征是认知功能受损以及行为和人格改变。已经观察到在AD患者大脑中核内和线粒体DNA中8-oxoG的水平相比对照组显著上升,与此同时在AD患者大脑的眶额回和内嗅皮层中,OGG1-2a的表达相比对照组显著下降[62]。这些结果表明,线粒体DNA氧化损伤修复酶在AD患者脑中可能没有发挥正常的功能,造成了线粒体DNA的氧化损伤。此外,在人死后脑组织的研究表明,AD患中MTH1蛋白在海马体CA3区透明层突触中的表达要显著低于非神经系统病例。这意味着AD患者大脑中海马突触的衰退丧失,进而产生了认知障碍。另外,dUTPase的突变也会导致人类细胞凋亡和巨幼红细胞性贫血;一个全外显子组测序项目揭示了严重的人类(编码ITPase)突变会导致早期婴儿脑病和死亡;ITPase功能缺失会引发嘌呤类似物硫唑嘌呤(用作治疗癌症和炎症性肠病的免疫抑制剂)的不良反应,且其与早发性结核病的易感性也具有关联;研究显示DCTPP1在乳腺癌中显著高表达,并且其与乳腺癌的肿瘤进展和不良预后密切相关。这些证据都表明了调控dNTP库质量蛋白功能的改变可能会诱发临床疾病。
3.2 调控dNTP库数量的蛋白与临床疾病
dNTP水平的调控嵌入了一个庞大的代谢网络,因此在微生物中,即便是相对极为重要的RNR功能丧失除了引起基因突变率的上升,也没有对细胞表型产生明显的影响,只有某些重要的基因才无法进行联合敲除,例如双突变体是不可行的[63]。同样的,这种调控dNTP库数量的基因突变在人类和动物中引发的后果更加严重。例如在小鼠中RNR的R2亚基的过表达导致更高的dNTP水平,进而诱发了突变频率和肺肿瘤的增加[64]。
而在人类中,更多的证据表明了调控dNTP库数量的蛋白的重要性。一个正常的细胞必须维持具有两个不对称时空的dNTP库:一种用于核DNA合成和修复,另一种用于mtDNA复制和修复。dNTP平衡的破坏会增强诱变,导致基因组不稳定,从而引发癌症,并可能产生代谢疾病[65]。在细胞质中dNTP池浓度与细胞周期是呈正相关性,S期开始时dNTP的数量是不足以进行完整DNA复制的。dNTP水平在S期的增加是保证核DNA复制保真性所必需的。mtDNA则在有丝分裂后的细胞中不断复制,并且mtDNA的复制保真性也取决于适宜的dNTP水平。因此,增殖和非增殖细胞都需要调控核苷酸和dNTP合成,以允许核和mtDNA复制和修复,维持细胞的健康。
核苷酸代谢失调与广泛的病理状况,包括癌症和线粒体疾病。几乎所有代谢途径都与dNTP生物合成有关,包括从头合成和补救途径,以及所有涉及的回补反应,这之间形成了高度的交叉调节。众所周知,癌细胞必须提高dNTP生物合成的速率以满足其快速增殖带来的基因组快速复制,因此高度交叉的生长信号通路在癌细胞中被重新编程。在人类癌症中c-Myc是最常见的改变蛋白之一,其受到PI3K-AKT和ERK1/2-MAPK通路的调节[66]。c-Myc是一种高度多效性转录因子,是控制细胞代谢的主要调节因子,分别调控了糖酵解、谷氨酰胺代谢和线粒体的生成。此外,c-Myc还可以诱导肝脏摄取和利用葡萄糖,同时阻断糖异生和酮体生成途径,这表明c-Myc在肥胖和胰岛素抵抗中具有抑制作用。除了调节葡萄糖和谷氨酰胺,嘌呤和嘧啶生物合成的底物,c-Myc还调控了核苷酸代谢酶基因表达。因此,c-Myc的失调会极大地改变癌症中的核苷酸池稳态,且根据实验数据推测c-Myc在线粒体疾病中的作用也与核苷酸代谢有关。此外,在胃癌、卵巢癌、膀胱癌和结直肠癌中也有RRM2过表达的情况发生,RRM2表达的程度与乳腺癌和上皮性卵巢癌的肿瘤分级也具有重要联系,这表明RNR功能的改变为肿瘤的快速细胞分裂提供了巨大的支持[67]。无独有偶,在许多癌症病例中都发现了SAMHD1活性或表达的抑制。因此,SAMHD1功能受损导致dNTP池的上升,进而导致基因组不稳定和细胞周期进展,促进癌细胞增殖[68]。这些数据都表明了嵌入调控dNTP库数量网络蛋白功能的改变可能会诱发临床疾病。
4 结语与展望
检验dNTP库的变化,首先需要定量测定胞内的dNTP库,传统的方法是结合放射性来检测dNTP,操作较为繁琐,且安全隐患偏大,改进的方法是基于荧光的测定法,相较而言,比较简单安全,灵敏度虽也相对较高,但仍无法和传统方法媲美[69]。dNTP的定量分析具有挑战性,dNTP的准确测量也需要进一步发展成熟。此外,在体外测定得到的dNTP浓度是否能够真实反映用于DNA复制或修复的dNTP浓度,也就是说胞内各处的浓度是否是保持一致也仍需进一步探讨。另外,DNA复制叉处的dNTP浓度必然是相对较高的。在原核生物中,DNA聚合酶对dNTP亲和力是比较低的,因此需要dNTP合成酶形成复合结构,转移至DNA复制叉处与DNA复制装置相结合以提供高浓度的dNTP,而在真核生物中,DNA聚合酶对dNTP亲和力相对较高,具有多个复制叉,链的延伸速度比起原核生物较慢,理论上不需要类似原核生物的dNTP提供方式,dNTP自由扩散进入核内即可满足复制需求。尽管如此,不少实验结果表明真核生物中仍可能存在暂时不为人知的dNTP输送方式。这样的观点如果被证实,则必须重新考虑如何测量胞内浓度不一致的dNTP库。此外,dNTP库定量的最大挑战是其他核苷酸的存在,其中三磷酸核糖核苷(rNTP)以比dNTP高得多的浓度存在于细胞裂解物中,并且各种核苷酸的彼此分离和提取也不简单[70]。最后dNTP的化学性质较为活泼而胞内也存在多种的dNTP酶,在提取的过程中dNTP容易被降解或氧化破坏等,这些都是定量dNTP库需要克服的困难。
大量数据证明,dNTP库的状态对生物体基因组的稳定有重要的影响,包括其质量和数量的平衡,但仍有许多问题亟待解决,例如dNTP库的测定是否准确,后核苷酸效应不能解释所有突变体的DNA突变效应,生物体内DNA修复系统应对DNA损伤的精确相互作用,庞大的核酸代谢网络的相互扰动。这些问题的解决对进一步地了解dNTP库对生物体基因组的影响有重要的意义。
[1] Bębenek A, Ziuzia-Graczyk I. Fidelity of DNA replication– a matter of proofreading.2018, 64(5): 985–996.
[2] Pezo V, Hassan C, Louis D, Sargueil B, Herdewijn P, Marlière P. Metabolic recruitment and directed evolution of nucleoside triphosphate uptake in, 2018, 7(6): 1565–1572.
[3] Darmon E, Leach DR. Bacterial genome instability., 2014, 78(1): 1–39.
[4] Tsegay PS, Lai YH, Liu Y. Replication stress and consequential instability of the genome and epigenome.2019, 24(21): 3870.
[5] Sies H, Jones DP. Reactive oxygen species (ROS)as pleiotropic physiological signalling agents., 2020, 21(7): 363–383.
[6] Srinivas US, Tan BWQ, Vellayappan BA, Jeyasekharan AD. ROS and the DNA damage response in cancer., 2019, 25: 101084.
[7] Lindahl T. Instability and decay of the primary structure of DNA., 1993, 362(6422): 709–15.
[8] Gorini F, Scala G, Cooke MS, Majello B, Amente S. Towards a comprehensive view of 8-oxo-7,8-dihydro- 2′-deoxyguanosine: Highlighting the intertwined roles of DNA damage and epigenetics in genomic instability.2021, 97: 103027.
[9] Giorgio M, Dellino GI, Gambino V, Roda N, Pelicci PG. On the epigenetic role of guanosine oxidation., 2020, 29: 101398.
[10] D′Augustin O, Huet S, Campalans A, Radicella JP. Lost in the crowd: how does human 8-oxoguanine DNA glycosylase 1 (OGG1) find 8-oxoguanine in the genome?, 2020, 21(21): 8360.
[11] Maga G, Villani G, Crespan E, Wimmer U, Ferrari E, Bertocci B, Hubscher U. 8-oxo-guanine bypass by human DNA polymerases in the presence of auxiliary proteins., 2007, 447(7144): 606–608.
[12] Krahn JM, Beard WA, Miller H, Grollman AP, Wilson SH. Structure of DNA polymerase beta with the mutagenic DNA lesion 8-oxodeoxyguanine reveals structural insights into its coding potential., 2003, 11(1): 121–127.
[13] Stoddard S, Riggleman A, Carpenter A, Baranova A. The detection of 8-oxo-7,8-dihydro-2ʹ-deoxyguanosine in circulating cell-free DNA: a step towards longitudinal monitoring of health.2020, 1241: 125–138.
[14] Grøsvik K, Tesfahun AN, Muruzábal-Lecumberri I, Haugland GT, Leiros I, Ruoff P, Kvaløy JT, Knævelsrud I, Ånensen H, Alexeeva M, Sato K, Matsuda A, Alseth I, Klungland A, Bjelland S. Thegene is activated to alleviate mutagenesis by an oxidized deoxynucleoside., 2020, 1:263.
[15] Lindahl T, Barnes DE. Repair of endogenous DNA damage., 2000, 65: 127–133.
[16] Sakumi K, Abolhassani N, Behmanesh M, Iyama T, Tsuchimoto D, Nakabeppu Y. ITPA protein, an enzyme that eliminates deaminated purine nucleoside triphosphates in cells., 2010, 703(1): 43–50.
[17] James AM, Seal SE, Bailey AM, Foster GD. Viral inosine triphosphatase: a mysterious enzyme with typical activity, but an atypical function., 2021, 22(3): 382–389.
[18] Kraszewska E, Drabinska J. Nudix proteins affecting microbial pathogenesis., 2020, 166(12): 1110–1114.
[19] Bessman MJ. A cryptic activity in the Nudix hydrolase superfamily.2019, 28(8): 1494–1500.
[20] Bhatnagar SK, Bessman MJ. Studies on the mutator gene,of. Molecular cloning of the gene, purification of the gene product, and identification of a novel nucleoside triphosphatase., 1988, 263(18): 8953–8957.
[21] Maki H, Sekiguchi M. MutT protein specifically hydrolyses a potent mutagenic substrate for DNA synthesis., 1992, 355(6357): 273–275.
[22] Rai P, Sobol RW. Mechanisms of MTH1 inhibition- induced DNA strand breaks: the slippery slope from the oxidized nucleotide pool to genotoxic damage., 2019, 77: 18–26.
[23] Srouji JR, Xu AT, Park A, Kirsch JF, Brenner SE. The evolution of function within the nudix homology clan.2017, 85(5): 775–811.
[24] Pecsi I, Hirmondo R, Brown AC, Lopata A, Parish T, Vertessy BG, Toth J. The dUTPase enzyme is essential in.2012, 7(5): 37461.
[25] Tchigvintsev A, Singer AU, Flick R, Petit P, Brown G, Evdokimova E, Savchenko A, Yakunin AF. Structure and activity of thedUTP pyrophosphatase DUT1, an essential housekeeping enzyme., 2011, 437(2): 243–253.
[26] Benedek A, Temesváry-Kis F, Khatanbaatar T, Leveles I, Surányi EV, Szabó JE, Wunderlich L, Vértessy BG. The role of a key amino acid position in species-specific proteinaceous dUTPase inhibition.2019, 9(6): 221.
[27] Kerepesi C, Szabó JE, Papp-Kádár V, Dobay O, Szabó D, Grolmusz V, Vértessy BG. Life without dUTPase.2016, 7: 1768.
[28] Kumar H, Kehrer J, Singer M, Reinig M, Santos JM, Mair GR, Frischknecht F. Functional genetic evaluation of DNA house-cleaning enzymes in the malaria parasite: dUTPase and Ap4AH are essential in Plasmodium berghei but ITPase and NDH are dispensable.2019, 23(3): 251–261.
[29] Burgis NE. A disease spectrum for ITPA variation: advances in biochemical and clinical research., 2016, 23(1): 73.
[30] Liakopoulou A, Alivisatos SG. Distribution of nucleoside triphosphatases in human erythrocytes., 1964, 89: 158–161.
[31] Yoneshima Y, Abolhassani N, Iyama T, Sakumi K, Shiomi N, Mori M, Shiomi T, Noda T, Tsuchimoto D, Nakabeppu Y. Deoxyinosine triphosphate induces MLH1/PMS2- and p53-dependent cell growth arrest and DNA instability in mammalian cells.2016, 6: 32849.
[32] Behmanesh M, Sakumi K, Abolhassani N, Toyokuni S, Oka S, Ohnishi YN, Tsuchimoto D, Nakabeppu Y. ITPase- deficient mice show growth retardation and die before weaning., 2009, 16(10): 1315–22.
[33] Moroz OV, Harkiolaki M, Galperin MY, Vagin AA, Gonzalez-Pacanowska D, Wilson KS. The crystal structure of a complex ofdUTPase with substrate analogue sheds light on the mechanism and suggests the “basic module” for dimeric d(C/U)TPases.2004, 342(5): 1583–1597.
[34] Rotoli SM, Jones JL, Caradonna SJ. Cysteine residues contribute to the dimerization and enzymatic activity of human nuclear dUTP nucleotidohydrolase (nDut).2018, 27(10): 1797–1809.
[35] Lee S, Kim MH, Kang BS, Kim JS, Kim GH, Kim YG, Kim KJ. Crystal structure ofMazG, the regulator of nutritional stress response.2008, 283(22): 15232–15240.
[36] Moroz OV, Murzin AG, Makarova KS, Koonin EV, Wilson KS, Galperin MY. Dimeric dUTPases, HisE, and MazG belong to a new superfamily of all-alpha NTP pyrophosphohydrolases with potential "house- cleaning" functions., 2005, 347(2): 243–255.
[37] Lyu LD, Tang BK, Fan XY, Ma H, Zhao GP.mazG safeguards genetic stability via housecleaning of 5-OH-dCTP.2013, 9(12): 1003814.
[38] Martínez-Arribas B, Requena CE, Pérez-Moreno G, Ruíz- Pérez LM, Vidal AE, Gonzaález-Pacanowska D. DCTPP1 prevents a mutator phenotype through the modulation of dCTP, dTTP and dUTP pools.2020, 77(8): 1645–1660.
[39] Kapoor I, Emam EAF, Shaw A, Varshney U. Nucleoside diphosphate kinase escalates A-to-C mutations in MutT-deficient strains of.2019, 202(1): 567–586.
[40] Acharya N, Manohar K, Peroumal D, Khandagale P, Patel SK, Sahu SR, Kumari P. Multifaceted activities of DNA polymerase η: beyond translesion DNA synthesis.2019, 65(3): 649–656.
[41] Yao R, Shi LJ, Wu CJ, Qiao WH, Liu LM, Wu J. Lsm12 mediates deubiquitination of DNA polymerase η to helpresist oxidative stress.2018, 85(1): 1988–2006.
[42] Rodriguez GP, Song JB, Crouse GF. In vivo bypass of 8-oxodG., 2013, 9(8): 1003682.
[43] Liu B, Großhans J. The role of dNTP metabolites in control of the embryonic cell cycle.2019, 18(21): 2817–2827.
[44] Mertz TM, Sharma S, Chabes A, Shcherbakova PV. Colon cancer-associated mutator DNA polymerase δ variant causes expansion of dNTP pools increasing its own infidelity.2015, 112(19): E2467–E2476.
[45] Bu PL, Nagar S, Bhagwat M, Kaur P, Shah A, Zeng J, Vancurova I, Vancura A. DNA damage response activates respiration and thereby enlarges dNTP pools to promote cell survival in budding yeast.2019, 294(25): 9771–9786.
[46] Gon S, Napolitano R, Rocha W, Coulon S, Fuchs RP. Increase in dNTP pool size during the DNA damage response plays a key role in spontaneous and induced-mutagenesis in.2011, 108(48): 19311–19316.
[47] Panzarino NJ, Krais JJ, Cong K, Peng M, Mosqueda M, Nayak SU, Bond SM, Calvo JA, Doshi MB, Bere M, Ou JH, Deng B, Zhu LJ, Johnson N, Cantor SB. Replication gaps underlie BRCA deficiency and therapy response., 2021, 81(5): 1388–1397.
[48] Zhou ZX, Williams JS, Lujan SA, Kunkel TA. Ribonucleotide incorporation into DNA during DNA replication and its consequences.2021, 56(1): 109–124.
[49] Miller JH, Funchain P, Clendenin W, Huang T, Nguyen A, Wolff E, Yeung A, Chiang JH, Garibyan L, Slupska MM, Yang HJ.strains () lacking nucleoside diphosphate kinase are powerful mutators for base substitutions and frameshifts in mismatch-repair-deficient strains., 2002, 162(1): 5–13.
[50] Kumar D, Abdulovic AL, Viberg J, Nilsson AK, Kunkel TA, Chabes A. Mechanisms of mutagenesis in vivo due to imbalanced dNTP pools., 2011, 39(4): 1360–1371.
[51] Schmidt TT, Sharma S, Reyes GX, Gries K, Gross M, Zhao B, Yuan JH, Wade R, Chabes A, Hombauer H. A genetic screen pinpoints ribonucleotide reductase residues that sustain dNTP homeostasis and specifies a highly mutagenic type of dNTP imbalance., 2019, 47(1): 237–252.
[52] Shu Z, Li Z, Huang HH, Chen Y, Fan J, Yu L, Wu ZH, Tian L, Qi Q, Peng S, Wei CY, Xie ZQ, Li XB, Feng Q, Sheng H, Li GQ, Wei DP, Shan CL, Chen G. Cell-cycle-dependent phosphorylation of RRM1 ensures efficient DNA replication and regulates cancer vulnerability to ATR inhibition.2020, 39(35): 5721–5733.
[53] Maslowska KH, Makiela-Dzbenska K, Fijalkowska IJ. The SOS system: A complex and tightly regulated response to DNA damage., 2019, 60(4): 368–384.
[54] Akdemir F, Christich A, Sogame N, Chapo J, Abrams JM. p53 directs focused genomic responses in., 2007, 26(36): 5184–5193.
[55] Kapoor I, Varshney U. Diverse roles of nucleoside diphosphate kinase in genome stability and growth fitness., 2020, 66(4): 671–682.
[56] Mauney CH, Hollis T. SAMHD1: recurring roles in cell cycle, viral restriction, cancer, and innate immunity.2018, 51(3): 96–110.
[57] Schmidt TT, Sharma S, Reyes GX, Kolodziejczak A, Wagner T, Luke B, Hofer A, Chabes A, Hombauer H. Inactivation of folylpolyglutamate synthetase Met7 results in genome instability driven by an increased dUTP/dTTP ratio.,2020, 48(1): 264–277.
[58] Bradshaw JS, Kuzminov A. RdgB acts to avoid chromosome fragmentation in.2003, 48(6): 1711–1725.
[59] Tsuzuki T, Egashira A, Igarashi H, Iwakuma T, Nakatsuru Y, Tominaga Y, Kawate H, Nakao K, Nakamura K, Ide F, Kura S, Nakabeppu Y, Katsuki M, Ishikawa T, Sekiguchi M. Spontaneous tumorigenesis in mice defective in thegene encoding 8-oxo-dGTPase., 2001, 98(20): 11456–11461.
[60] Nakabeppu Y, Kajitani K, Sakamoto K, Yamaguchi H, Tsuchimoto D. MTH1, an oxidized purine nucleoside triphosphatase, prevents the cytotoxicity and neurotoxicity of oxidized purine nucleotides., 2006, 5(7): 761–72.
[61] Koziorowski D, Figura M, Milanowski ŁM, Szlufik S, Alster P, Madetko N, Friedman A. Mechanisms of neurodegeneration in various forms of Parkinsonism- similarities and differences., 2021, 10(3): 656.
[62] Buccellato FR, DʼAnca M, Fenoglio C, Scarpini E, Galimberti D. Role of oxidative damage in Alzheimer's disease and neurodegeneration: From pathogenic mechanisms to biomarker discovery., 2021, 10(9): 1353.
[63] Cheng ZF, Zuo Y, Li Z, Rudd KE, Deutscher MP. Thegene required for virulence inflexneri andencodes the exoribonuclease RNase R.1998, 273(23): 14077–14080.
[64] Xu X, Page JL, Surtees JA, Liu HC, Lagedrost S, Lu Y, Bronson R, Alani E, Nikitin AY, Weiss RS. Broad overexpression of ribonucleotide reductase genes in mice specifically induces lung neoplasms.2008, 68(8): 2652–2660.
[65] Shimizu I, Yoshida Y, Suda M, Minamino T. DNA damage response and metabolic disease.2014, 20(6): 967–977.
[66] Buj R, Aird KM. Deoxyribonucleotide triphosphate metabolism in cancer and metabolic disease., 2018, 9: 177.
[67] Greene BL, Kang G, Cui C, Bennati M, Nocera DG, Drennan CL, Stubbe J. Ribonucleotide reductases: structure, chemistry, and metabolism suggest new therapeutic targets.2020, 89: 45–75.
[68] Kohnken R, Kodigepalli KM, Wu L. Regulation of deoxynucleotide metabolism in cancer: novel mechanisms and therapeutic implications.2015, 14: 176.
[69] Subramaniam R, Lamb NA, Hwang Y, Johengen L, Surtees JA. Extracting and measuring dNTP pools in.2019, 1999: 103–127.
[70] Landoni JC, Wang L, Suomalainen A. Whole-cell and mitochondrial dNTP pool quantification from cells and tissues.2021, 2276: 143–151.
Maintenance of dNTP pool homeostasis and genomic stability
Cong Liu, Jiani Feng, Weiwei Li, Weiwei Zhu, Yunxin Xue, Dai Wang, Xilin Zhao
As an important precursor for DNA synthesis, the four deoxyribonucleoside triphosphates (dATP, dTTP, dGTP, and dCTP) are necessary raw materials for DNA replication, recombination, and repair in cells. The correct synthesis and integrity of DNA are important manifestations of the genome stability, so the stability of the dNTP library state is essential to maintain the stability of the genome and the cell. In terms of the quality of the dNTP library, the incorporation of some heterogeneous dNTPs, such as oxidized dNTPs, into DNA can easily cause base substitutions and even DNA breaks and rearrangements, which will greatly damage the stability of the genome. At the same time, the cell has also evolved the corresponding NTP pyrophosphatase to remove it, and to correct the damaged DNA and repair the DNA gap by forming a DNA damage repair network. In terms of the number of dNTP libraries, the imbalance of the dNTP concentration and ratio will also cause base and frameshift mutations, which will also cause genome instability. As a result, cells have evolved a huge enzyme-controlled network to carry them out under precise control. This article mainly reviews the potential harm of damage to dNTP library components in cells, the clearance of damaged dNTPs, the regulation on the balance between dNTP library components, and finally discusses clinical diseases related to dNTP library homeostasis. It provides insights on the research of the correlation between the stability of the cellular dNTP library and the genome, and finally provides some theoretical basis for the treatment of related diseases.
dNTP pool; qualitative control; quantitative regulation; genome stability; clinical disease
2021-10-16;
2021-12-14;
2021-12-28
国家自然科学基金项目(编号:81971905)和福建省自然科学基金项目(编号:FJHJF-L-2019-4,JT180009)资助 [Supported by the National Natural Science Foundation of China (No. 81971905) and the Natural Science Foundation of Fujian Province (Nos. FJHJF-L- 2019-4, JT180009)]
刘聪,硕士研究生,专业方向:转化医学。E-mail: 1193850497@qq.com
赵西林,教授,博士生导师,研究方向:抗感染药物及其作用机理。E-mail: zhaox5@xmu.edu.cn
10.16288/j.yczz.21-211
(责任编委: 张天宇)
