细胞外囊泡协同递送维替泊芬/TRAIL诱导口腔鳞癌细胞凋亡及增殖抑制实验研究
2022-03-05王文晶李昆珊刘铁军仇永乐
王文晶,李昆珊,刘铁军,刘 昕,仇永乐
肿瘤坏死因子相关凋亡诱导配体(TNF-related apoptosis-inducing ligand,TRAIL)是肿瘤坏死因子超家族成员之一[1],能通过抑制肿瘤增殖和促进肿瘤凋亡在多种癌症治疗过程中发挥作用,曾被认为是极具前景的选择[2]。然而,恶性肿瘤对TRAIL诱导细胞凋亡的耐药性阻碍了其应用拓展。Yes激酶相关蛋白(yes-associated protein,YAP)的活化及过表达与多种肿瘤细胞耐药性相关。如黑色素瘤细胞对丝氨酸/苏氨酸蛋白激酶抑制剂的耐药性源自激动蛋白对YAP/转录联合激活因子通路的重塑活化,卵巢癌细胞对紫杉醇的耐药性涉及到YAP的过表达。近期基因组分析显示YAP在口腔鳞状细胞癌(oral squamous cell carcinoma, OSCC)中过表达[3]。Hiemer et al[4]证明YAP的核积聚可促进口腔鳞癌细胞的增殖和迁移。Kim et al[5]研究表明,YAP能有效的抑制MCF10A 细胞中TRAIL表达。故推测通过YAP抑制剂维替泊芬(verteporfin, VPF)有望提高OSCC细胞对TRAIL的敏感性。该研究为改善口腔鳞癌细胞对TRAIL作用的耐药性,制备协同递送TRAIL/VPF的细胞外囊泡(TNF-related apoptosis-inducing ligand/verteporfin co-loading extracellular vesicles, MSCT-EVs/VPF)并对其体外抗癌活性及相关机制进行评价。
1 材料与方法
1.1 材料VPF购自美国MedChemExpress公司;SCC25细胞系来自美国ATCC供应商,在含有10% FBS的RPMI-1640培养基中培养。成人间充质干细胞状态良好,购自美国ATCC供应商。用慢病毒转染表达人TRAIL的MSCs建立MSCT细胞模型[6],在含有17% FBS的RPMI-1640培养基中培养和保存。FBS、RPMI-1640、胰酶、DMSO均购自美国Sigma公司。
1.2 细胞外囊泡(extracellular vesicles, EVs)分离MSCs和MSCT细胞(第三代)在37 ℃和5% CO2条件下,在含有17% FBS的RPMI-1640细胞培养基中至(70~80)%融合,收集培养基。后培养基改为10% FBS的RPMI-1640细胞培养基,每48 h更换1次。MSCT细胞(第三代) 在37 ℃和5% CO2条件下,在含有10% FBS的RPMI-1640培养基加入0.3 mg/ml VPF,48 h后收集培养基。将收集的培养基在1 337 r/min下离心10 min,然后6 453 r/min 4 ℃再次离心,去除细胞和碎片。此后,使用0.22 μm过滤器( 德国membrana公司)对培养基真空过滤。用100 ku(德国Sartorius公司)浓缩5次,最后在24 419 r/min、4 ℃下超速离心2 h。用0.22 μm膜过滤器过滤收集EVs产物,并用磷酸盐缓冲盐水(PBS)洗涤2次。最终产品储存在-80 ℃的PBS中。
1.3 EVs表征及质谱条件取离心后用10 μl PBS再悬浮EVs样品,然后加入铜网中沉淀2 min。使用JEM-1400透射电子显微镜(日本JEOL公司)进行观察,使用Nano Measurer 1.2.5软件计算粒径分布范围。
为定量EVs中的VPF,样品用0.6 mol/L高氯酸(1 ∶1,v/v)脱蛋白,含有抗氧化剂二硫化钠(5 mg/ml),离心,通过0.2 μm尼龙过滤器(美国Phenomenex公司,Phenomenex NY 4 mm)过滤。使用VPF标准,采用高效液相色谱法(Agilent 1260),以乙腈和水为流动相,流速为1 ml/min,波长为230 nm。
1.4 体外释放实验将MSCT-EVs/VPF溶液(2 ml)放入透析袋(MWCO ∶8 000~14 000)。将透析袋的两端夹紧,将含有0.5%(w/v)吐温-80的40 ml磷酸钠缓冲溶液放入烧杯中作为透析液。将烧杯置于恒温摇床中,将转速设置为100 r/min,温度为37 ℃。预定时间间隔从透析液中采集样品,后补充相同含量的缓冲液。以14 000 r/min离心10 min,用高效液相色谱法测定透析液中各时间点VPF的含量。
1.5 细胞毒性和凋亡分析将对数期的SCC25细胞以3×103~5×103个/孔的密度接种于96孔板,37 ℃孵育24 h,细胞贴壁。用不同浓度游离VPF、MSCT-EVs、MSCT-EVs:VPF(游离MSCT-EVs+游离 VPF)、MSCT-EVs/VPF处理细胞48 h,然后加入20 μl MTT溶液(5 mg/ml)孵育4 h。然后,抽取培养基并添加150 μl二甲基亚砜。轻摇10 min溶解甲瓒,用微板阅读器(美国OPTIMAX公司)测量每个孔在570 nm处的OD值。
将SCC25细胞接种于6孔板中,细胞数为5×105个/孔,37℃培养24 h,细胞融合至70%。将PBS(空白组照)、VPF(2 μg/ml)、MSCT-EVs(20 μg/ml)、MSCT-EVS ∶VPF(20 μg/ml)和MSCT-EVs/VPF(20 μg/ml)分别加入到6孔板中,培养24 h进行细胞凋亡分析。用胰蛋白酶消化细胞,轻轻搅拌,离心,收集细胞。用AF647、annexin V和2 μg/ml的DAPI染色, 流式细胞仪检测细胞死亡。
1.6 Western blot实验VPF(2 μg/ml)、MSCT-EVs ∶VPF(20 μg/ml)、MSCT-EVs/VPF(20 μg/ml)处理SCC25细胞后细胞,用BCA法检测蛋白质含量,SDS-PAGE电泳分离。电泳后,去除凝胶,将蛋白质转移到PVDF膜上,用5%脱脂奶粉密封1 h, 4 ℃下与一抗孵育过夜。PEST洗涤后,加入相应二抗(1 ∶5 000),室温孵育2 h,PBST清洗后观察ECL的形成。
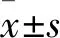
2 结果
2.1 MSC-EVs的分离与表征MSCT-EVs/VPF以颗粒大小进行表征,MSCT-EVs/VPF平均粒径约为100 nm,粒径分布范围较窄,见图1A、B。CD63和CD9是MSC-EVs的典型标志物,见图1C。CD63、CD9和TRAIL在MSCT-EVs中均有表达,见图1C、D。MSCs中仅有CD81表达,见图1C。
2.2 载药与体外释药包封率为(93.7±1.53)%,载药量为(15.43±0.44)%。透析法检测MSCT-EVs/VPF的药物含量。MSCT-EVs/VPF在10 h内释放57.8%的VPF,45 h释放约82.5%,见图2B。在释放试验的前15 h,MSCT-EVs/VPF表现出快速释放特性,随后药物释放速率减慢,30 h后药物释放进入平台期。
2.3 细胞毒性
2.3.1细胞毒性和半数抑制浓度(IC50) 在药物作用试验前,先测定MSCT-EVs是否能抑制SCC25细胞的生长。结果表明,MSCT-EVs和VPF可以剂量依赖性地抑制SCC25细胞的生长,见图3A、B。图3C显示VPF和MSCT-EVs的比例与其对癌细胞的协同杀伤作用密切相关。不同比例的游离VPF和MSCT-EVs的IC50值差异较大。MSCT-EVs和VPF的质量比(wt%)在10 ∶1~5 ∶1的比例范围内具有最佳协同效应。MSCT-EVs/VPF和MSCT-EVs ∶VPF均可抑制SCC25细胞增殖(图3D)。在相同的药物比例下,MSCT-EVs/VPF的IC50显著低于MSCT-EVs ∶VPF(P=0.003,F=10.67),显示出更高效的抑制作用。因此,结果提示MSCT-EVs/VPF组可能在10 ∶1~5 ∶1(wt%)范围内表现出最佳的协同效应。但由于MSCT-EVs载药量限制,尚不能确定最佳协同比例。
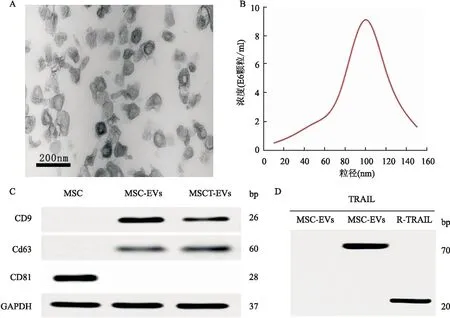
图1 MSC-EVs的表征及标志物分析

图2 VPF标准曲线及释放曲线A:根据HPLC结果得出的VPF回归曲线;B:VPF的释放曲线
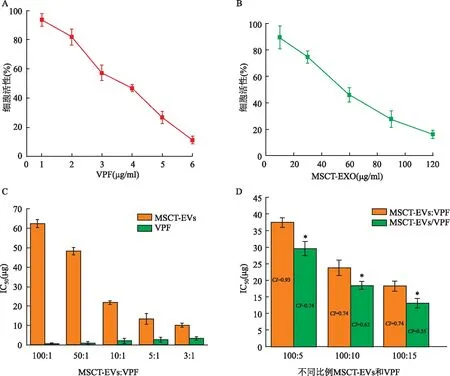
图3 VPF的细胞毒性及半数抑制浓度
2.3.2MSCT-EVs/VPF诱导细胞凋亡 VPF、MSCT-EVs、MSCT-EVs:VPF和MSCT-EVs/VPF均可以诱导SCC25细胞凋亡,见图4。联合用药组,高于单独用药组。载VPF的MSCT-EVs对癌细胞的杀伤作用强于游离MSCT-EVs:VPF组,见图4、5。用Annexinv/DAPI检测MSCT-EVs/VPF对SCC25细胞的杀伤作用。结果表明,MSCT-EVs/VPF对SCC25细胞的诱导凋亡作用高于游离MSCT-EVs:VPF,见图5。提示MSCT-EVs/VPF能有效诱导肿瘤细胞凋亡,并能减少游离药物的用量。
2.3.3MSCT-EVs/VPF对SCC25细胞中凋亡相关蛋白和YAP表达的影响 MSCT-EVs/VPF能够上调SCC25细胞中Caspase-3、Bax的表达,同时下调Bcl-2的表达量。VPF在该浓度下未显示对凋亡蛋白明显的调控作用,但可以提高MSCT-EVs对Caspase-3(P=6.93×10-5,F=290.78)、Bax(P=1.95×10-6,F=1 750.31)、Bcl-2(P=0.000 7,F=90.17)调控作用。相对于MSCT-EVs:VPF组,MSCT-EVs/VPF对Caspase-3(P=3.12×10-5,F=435.49)、Bax(P=1.8×10-5,F=574.33)、Bcl-2(P=0.041,F=9.67)的调控作用更强。

图4 各组对SCC25细胞的凋亡诱导作用

图5 Annexin V/DAPI检测SCC25细胞凋亡图
图6 MSCT-EVs/VPF对SCC25细胞中凋亡相关蛋白和YAP、mTOR、p-mTOR表达的影响
随后实验检测了MSCT-EVs/VPF对YAP,mTOR信号通路的调控作用。MSCT-EVs对YAP、p-YAP、mTOR、p-mTOR无显著影响,当联合VPF用药时, VPF对YAP(P=3.43×10-5,F=414.67)、p-YAP(P=7.07×10-7,F=2 910.74)、mTOR(P=0.000 3,F=139.77)、p-mTOR(P=3.2×10-6,F=1 366.66)信号通路的调控作用被增强。相对于MSCT-EVs+VPF组,MSCT-EVs/VPF组对YAP(P=0.002 56,F=45.57)、p-YAP(P=1.26×10-5,F=686.54)、mTOR(P=0.002,F=51.24)、p-mTOR(P=3.2×10-6,F=1 366.06)信号的抑制作用更高。见图6。
3 讨论
TRAIL因其对肿瘤细胞的特异性杀伤作用,被广泛用于癌症治疗相关研究[7]。然而,由于肿瘤的多药耐药性,TRAIL单药应用无法达到预期治疗效果。长期以来,无论是稳定性增强的重组TRAIL蛋白还是特异性更高的TRAIL抗体,抗癌效果均有限。因此,探究药物协同递送途径来增强其效用,对于TRAIL的临床应用具有重要意义[8-9]。YAP信号是多种实体肿瘤靶向、化疗和免疫治疗反应的关键调节因子。YAP的过度表达与OSCC促癌基因的表达水平呈正相关,能促进肿瘤细胞的增殖和肿瘤的侵袭能力。此外,YAP还能促进OSCC细胞对化疗药物的耐药性[10]。维替泊芬(VPF)是一种用于治疗眼部异常血管的光敏药物,可直接抑制YAP-TEAD结合并减少YAP过度表达[11]。Fisher et al[12]研究表明VPF能通过抑制YAP来提高恶性肿瘤细胞对RAFi、TKI或化疗药物的敏感性。然而,维替泊芬仅在高微摩尔浓度下阻断YAP-TEAD结合,因此在临床上应用受限[13]。该研究通过超速离心法和0.22 μm过滤制备载VPF的TRAIL转染纳米囊泡,提高OSCC细胞对TRAIL的敏感性。
MSCs首先转染TRAIL(MSCTs),然后用VPF孵育,得到载药纳米囊泡。TEM结果显示,EVs纳米粒子颗粒圆整,粒径分布较窄。高速离心法去除粒径大于220 nm的微泡,再经蔗糖密度梯度超速离心进一步纯化。载药囊泡具有较高的载药量和良好的释药曲线。体外实验表明,载药系统具有良好的抗肿瘤活性,VPF能增强MSCT-EVs对SCC25的抑制作用,EVs协同递送的VPF/TRAIL能更加高效的抑制肿瘤细胞生长。这可能是由于MSCT-EVs/VPF组中MSCT-EVs和VPF能以固定比例进入细胞,作用稳定,间充质干细胞衍生EVs的细胞归巢作用增加了VPF/TRAIL细胞摄取。这一结果与以往研究一致,如在介孔硅中装载吉西他滨和紫杉醇[14],以及载负顺铂和二甲双胍的纳米立方体[15],相较于游离药物组,纳米载药组显示出更强的药效。相较于MSCT-EVs:VPF, 100 ∶5~100 ∶15范围内囊泡内的MSCT-EVs和VPF的联合应用具有良好的协同作用(P<0.05)。由于载药量的限制,不能直接计算MSCT-EVs/VPF的最佳配比。由于MSCT-EVs和游离VPF在10 ∶1~5 ∶1(wt%)的比例范围内显示出最佳抑制作用,因此推测MSCT-EVs/VPF组的最佳比例也位于10 ∶1~5 ∶1(wt%)范围内。
该研究检测了MSCT-EVs/VPF对SCC25细胞中凋亡相关蛋白和YAP表达的影响。VPF不能直接调控SCC25细胞中凋亡蛋白的表达,但可以提高MSCT-EVs对Caspase 3、Bax、Bcl2调控作用(P<0.05). MSCT-EVs可增强VPF对SCC25细胞内YAP、mTOR蛋白的抑制作用。相较于MSCT-EVs+VPF组,MSCT-EVs/VPF对Caspase 3、Bax、Bcl2的调控作用更强(P<0.05),与凋亡、细胞活性实验结果相符。MSCT-EVs对YAP、p-YAP、mTOR、p-mTOR不具有调控作用,然而却能够加强VPF对YAP、p-YAP、mTOR、p-mTOR的调控作用,这种作用被EVs的协同递送增强。此前的研究表明YAP能够抑制TRAIL的表达,VPF可通过抑制YAP的表达增强TRAIL作用[5],与该研究结果相符。
综上所述,该研究从MSCT中分离出VPF相关EVs,证明MSCT-EVs/VPF对口腔鳞癌细胞具有显著的抑制作用,这种抑制作用源于对凋亡蛋白和YAP调控。制备的载药EVs能降低VPF的使用剂量,增强TRAIL对OCSS细胞的敏感性。新型载药EVs协同递送TRAIL/VPF对OCSS细胞展现出高效抑制作用, 为多药耐药肿瘤的治疗提供新思路。
