精细化检测原代皮质神经元细胞氧糖剥夺再复氧后自噬流的变化
2022-03-05韩延峰胡玉奇陈富雷
张 磊,戴 朝,韩延峰,李 阳,胡玉奇,陈富雷,赵 冬
自噬关乎于人类健康并且涉及到多种疾病的多种层面[1-2]。它被认为是一种动态结构性的溶酶体过程[3-4],这些连续动态变化的过程被称为自噬流[5],其中任一环节出现障碍,自噬将无法完成应有的生物学功能进而引发和罹患多种疾病。
目前自噬流研究领域的热点是从自噬角度去解释和治疗一些疾病[6],为此建立高精细灵敏的检测自噬流方法必不可少。最近有报道[3, 7]用LC3 ELISA定量自噬流和用电子透射显微镜(TEM)观察线粒体自噬流,但它们只能测量自噬是否增加或减少而不能测量随时间变化的动力学;且每种方法对自噬流的不同阶段检测均存有差异。该研究在原代皮质神经元细胞氧糖剥夺再复氧(oxygen-glucose deprivation-reoxygenation, OGD/R)模型上,加或者不加BafA1干预后采用多种方法反复检测自噬流变化,掌握各种方法的优缺点后能在自噬发生的不同时期选择最合适的方法去研究自噬流。
1 材料与方法
1.1 大鼠皮质神经元的原代培养原代皮质神经元来源于24 h内出生的健康SD乳鼠,购自新疆动物中心。将分离好的皮质神经元接种在提前包被好的多聚赖氨酸(0.1 mg/ml)(上海生工生物工程有限公司)的六孔板中,细胞种植密度为2×106个/孔,用含有Neurobasal、2% B27、Glutamax、10% FBS(美国Gibco公司) 和青链霉素(美国Hyclone公司)的完全培养基, 置于37 ℃,5% CO2的细胞培养箱中培养,培养至第7天选用皮质神经元特异性烯醇化酶(neuron-specific enolase, NSE)(美国Abcam公司 )结合免疫荧光法检测皮质神经元纯度,定量阳性细胞比例证实纯度>90%可用于实验。
1.2 免疫荧光将培养至第7天成熟的生长状态良好的皮质神经元,用4%多聚甲醛固定30 min,后用0.1% Triton-x100透化皮质神经元20 min,用PBS清洗,5%脱脂牛奶封闭缓冲液30 min后弃去封闭液, 神经元鉴定实验中加入一抗NSE(1 ∶100),p62免疫染色实验中加入一抗p62(美国Abcam公司)(1 ∶200),4 ℃孵育过夜,第2天用PBS清洗,后与FITC偶联的二抗(北京中杉金桥有限公司)孵育2 h,细胞核用PI(美国Sigma公司)染色,再用荧光显微镜(日本奥林巴斯公司)进行观察。
1.3 OGD/R与药物治疗皮质神经元共同剥夺O2和葡萄糖1 h,模拟在体外的损伤模型[8],去除原来的培养基后在六孔板内加入无糖培养基DMEM(武汉普诺赛生命科技有限公司),将盛有细胞的六孔板置于缺氧小室(美国比卢普斯罗森堡公司)中,在95% N2和5% CO2的饱和气体中,氧浓度维持在1%以内,温度控制在37 ℃,OGD损伤后,更换为最初的完全培养基,放入37 ℃,5% CO2的细胞培养箱中常规培养24 h。其中OGD/R组不做处理;BafA1组在OGD/R组的基础上将BafA1(100 nmol/L)(美国Selleck公司)注入六孔板内处理细胞4 h,所有分组在相同条件下共同再灌注24 h。
1.4 RFP-GFP串联荧光标记LC3基因转染细胞应用LC3双荧光腺病毒转染原代皮质神经元细胞 (上海吉凯公司),细胞在24孔板内以2.5×105个/孔的密度培养7 d,将此类腺病毒按照课题组计算好的标准加入各分组试验感染细胞后处理,感染皮质神经元细胞24 h后用荧光显微镜(日本奥林巴斯公司)观察,人工计数黄色和红色LC3点,每组随机抽取至少有50个细胞进行定量。
1.5 TEM观察自噬超微结构变化培养7 d生长状态良好的成熟皮质神经元进行OGD/R实验处理24 h后,加入0.25%的胰酶进行细胞消化4℃离心机1 000 r/min离心5 min,弃去上清液后加入500 μl 2.5%戊二醛固定液4℃固定后采用JEM 1200EX(日本JEOL公司)电子显微镜观察自噬体、溶酶体、自噬溶酶体的超微结构。
1.6 Western blot将OGD/R组的细胞培养液吸出,细胞裂解产物用含有蛋白酶抑制剂的RIPA在冰上裂解细胞30 min,收集标本,在4℃以下12 000 r/min离心15 min,5%脱脂牛奶在室温下进行封闭1h,用8%~10%的SDS-PAGE实施分离蛋白,随即转移到PVDF膜上,之后与抗LC3(美国Abcam公司) (1 ∶1 000),抗p62(美国Abcam公司)(1 ∶1 000)的抗体,4℃孵育过夜,用增强型化学发光法(electrochemiluminescence,ECL)观察免疫印迹,对蛋白条带进行密度分析。在SQSTM1/p62结合LC3蛋白翻转实验中,用两组间可溶性p62的比值,不可溶性p62的比值(常规细胞经裂解离心后在离心沉淀中加入高浓度的尿素,从而获得了不可溶性p62)同时结合LC3Ⅱ/Ⅰ的比值评价自噬流,并将其归一化为β-actin。 Western blot结果用ImageJ软件进行定量。
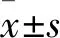
2 结果
2.1 皮质神经元的鉴定成功培养7 d后的皮质神经元细胞进行免疫荧光鉴定,神经元的轴突和胞质经NSE染色后发绿色荧光,细胞核经PI染色后发红色荧光,两种免疫荧光的共存表明皮质神经元占所培养细胞总数的95%以上(图1)。
2.2 皮质神经元在OGD/R模型成功建立后自噬流的活化RFP-GFP-LC3B串联荧光标记LC3基因转染神经元细胞后荧光显微镜下观察红色/绿色共定位的点状聚集,当RFP和GFP图像叠加时,荧光下黄点(RFP和GFP共存)代表自噬小体,红色荧光点表示自噬溶酶体,红色和黄色的比值用来测量自噬流。在OGD/R组中红点的总体数量明显多于黄点的总体数量且红点和黄点的比值明显偏高,而在BafA1组显示无论红点还是黄点的总数量均出现明显减少且红点几乎难以被检测到(图2A),综上所述,在荧光显微镜下观察到的红色/绿色共定位点状聚集时OGD/R组红点和黄点的比值明显高于BafA1组(t=20.37,P<0.001)(图2B)。
2.3 TEM观测神经元OGD/R后自噬超微结构变化在TEM下观察到OGD/R组与BafA1组自噬小体和溶酶体的超微结构状态。OGD/R组自噬小体(双层膜结构清晰)、溶酶体(染色质深较聚集)、自噬溶酶体增多(图3A、B)。在BafA1组中观察到很少的自噬小体(膜已破坏结构不清)和降解的溶酶体,几乎未见到自噬溶酶体(图3C、D)。TEM下观察OGD/R组时自噬超微结构清晰典型,而在BafA1处理组中观察到的结构模糊缺乏典型特征。
2.4 SQSTM1/p62结合LC3B蛋白翻转实验共同评定自噬流变化课题组同时观察了可溶性p62蛋白、不可溶性p62蛋白和LC3Ⅰ/Ⅱ的转化综合判断自噬流的变化(图4)。在OGD/R组与BafA1组的实验中,OGD/R组的可溶性p62明显低于BafA1组(0.58±0.02)(t=24.66,P<0.05),而不可溶性p62蛋白两组之间比较几乎无明显变化;其次,清晰地观察到OGD/R组的LC3Ⅰ向LC3Ⅱ转化明显增加(0.87±0.02)(t=9.055,P<0.05)(图4C、D),最终结果显示OGD/R组细胞内的自噬流明显活跃于BafA1处理组。
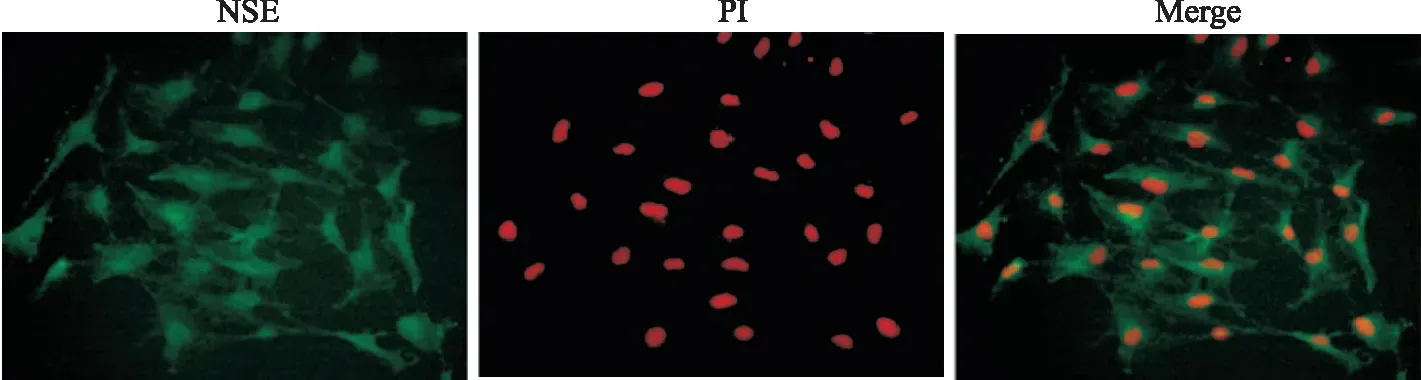
图1 NSE和PI双重免疫荧光染色的代表性显微图片 400
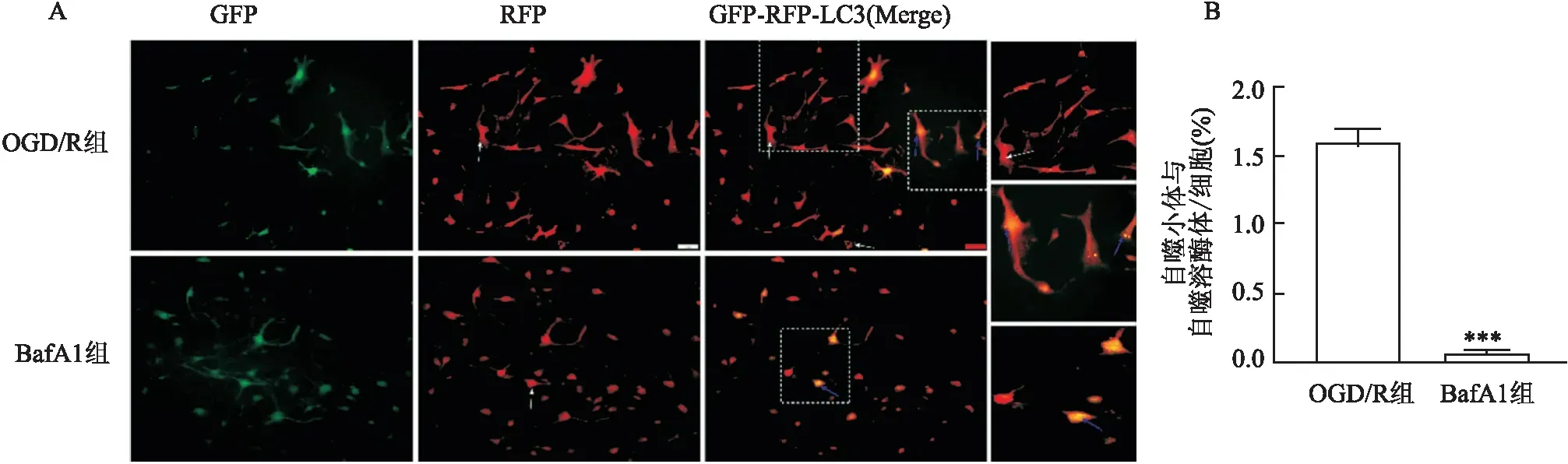
图2 RFP-GFP-LC3串联荧光检测自噬流(×200)A:转染皮质神经元细胞后的活细胞图像;B:不同组的LC3的数量;与OGD/R组比较:***P<0.001
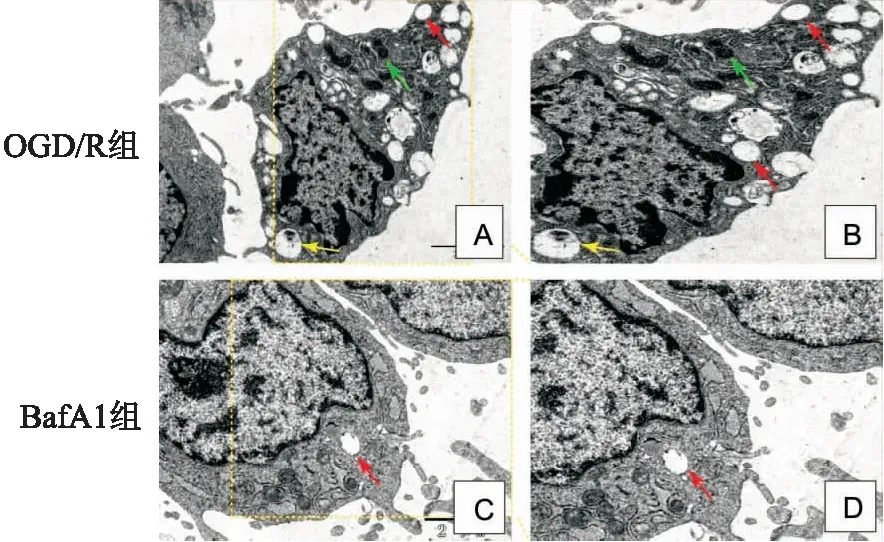
图3 TEM下观察自噬超微结构的变化 ×5 000
2.5 免疫荧光细胞化学染色p62的分布观测自噬流p62蛋白经免疫荧光染色后分布在细胞质,显微镜下观察到神经元细胞内p62不同形态的含量变化及在细胞内的定位,与OGD/R组相比,弥散型p62和聚集型p62的分布与含量在BafA1组中尤为显著(图5)。
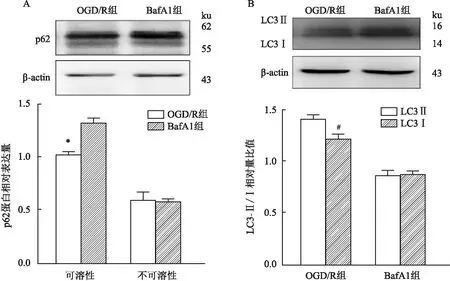
图4 SQSTM1 / p62 结合LC3B-Ⅰ向LC3B-Ⅱ转化实验分析细胞自噬流
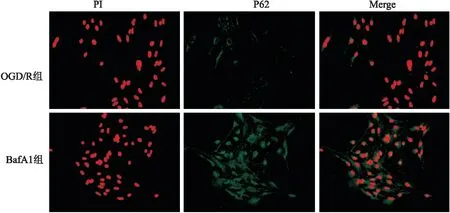
图5 免疫荧光染色分析神经元细胞中p62蛋白的变化判断自噬流 ×400
3 讨论
目前虽有多种方法用于检测自噬流,但是在自噬的不同阶段如何准确应用相应方法尚不明确,每种方法的优缺点也不详细。因此,精准检测自噬流已成为一种紧迫的需求和挑战。课题组用动态检测(RFP-GFP串联荧光基因转染)和静态检测(TEM、p62结合LC3蛋白翻转、p62免疫荧光)方法观察神经元在OGD/R后的自噬流,在加或不加BafA1的情况下,自噬流显现了两种截然不同的趋势,OGD/R后自噬流激活,加入BafA1后自噬流中断,且不同的方法检测了自噬过程的不同阶段。
RFP-GFP-LC3B串联荧光转染细胞是研究自噬流不可或缺的利器,也是观察RFP-GFP-LC3B融合蛋白的最佳仪器[9]。本实验用此技术后发现在OGD/R组中红点的数量明显多于黄点,提示自噬流激活,有学者用此方法得到了类似的效果[10- 11]。而加用自噬晚期抑制剂BafA1后黄点数量明显增多,说明自噬流中断。此实验最大的优势就是仅通过荧光强度的改变就可以观测自噬流的状态[5]。但这种方法仅能检测到自噬的某一阶段,要想充分评价自噬流的变化需要用动态的方法去检测,比如在活细胞工作站下观测。
TEM是检测自噬流最经典的方法[7]。实验显示OGD/R组,自噬小体、溶酶体、自噬溶酶体结构清晰且数量较多,而加入 BafA1后未见到完整的自噬小体,也未发现自噬溶酶体结构。TEM在纳米分辨率下可视自噬体、溶酶体、自噬溶酶体等超微结构,以及它们所处细胞成份的确切位置,甚至还提供了自噬完整过程的快照及超微结构的变化[12]。但是要想观察连续动态的图像需要和荧光传感器和免疫方法耦合。
完整的自噬流是将p62与LC3B相结合同时进行检测,这是目前判断自噬流最为准确的方法[5, 13]。通常LC3Ⅰ向LC3Ⅱ转化,或LC3Ⅱ含量增多代表自噬流激活,LC3Ⅱ含量减少意味着自噬流的终止。p62被称为选择性自噬受体,它可与溶酶体融合形成自噬溶酶体而最终被清除。自噬流激活时p62水平降低,自噬流中断时p62水平升高[11]。另外,若可溶性p62蛋白减少不可溶性p62蛋白无明显变化,且LC3Ⅰ向LC3Ⅱ转化意味着自噬流激活;若可溶性p62蛋白减少不可溶性p62蛋白明显增加,无论LC3Ⅰ是否向LC3Ⅱ转化都证明自噬流中断[14]。实验显示OGD/R组的可溶性p62明显低于BafA1组,而不可溶性p62蛋白之间无差异;OGD/R组的LC3Ⅰ向LC3Ⅱ转化,说明OGD/R后神经元细胞内的自噬流激活,加入BafA1后自噬流停滞。将p62结合LC3B同步检测自噬流观察的不仅有前期自噬小体形成过程还涉及到自噬流后期自噬溶酶体的降解,所以说是判断自噬流最为准确的方法[15]。
然而,自噬流也会出现波动。当自噬流发生波动时,可溶性与不可溶性p62会滞后,为此通过p62免疫染色联合Western blot可更为合适的去判断自噬流[15]。实验中加或不加BafA1观察到弥散型p62和聚集型p62的分布有明显差异,正好与Western blot的结果相匹配,此方法反映了自噬流的最后环节——自噬溶酶体的降解。
总之,为了检测神经元OGD/R后自噬流的变化,课题组采用多种方法综合评价,不同方法监测了自噬流的不同阶段,可以利用每种方法各自的优点去互补,根据自噬发生的不同时期选择最合适的方法去研究自噬流。
