孕期缺氧对子代肺动脉血管功能的影响及其机制
2022-03-05吉冰玉高芹芹
赵 梦,李 欢,吉冰玉,徐 婷,高芹芹
许多成人疾病的发生,其病因往往可以追溯至儿童、婴幼儿甚至胎儿期。近期大量研究[1-2]表明:孕期多种不良因素(母体、遗传或环境)均不同程度影响宫内胎儿发育,这为成年后患心血管等疾病埋下“病根”。在胎儿发育晚期,肺循环经历了一系列的结构和功能变化,胎盘的气体交换转变为肺的气体交换,因此肺循环特别容易受到缺氧的影响。孕期宫内缺氧是胎儿发育过程中最为常见的不良因素[3-4]。已有大量研究[5-9]表明,孕期缺氧可影响子代冠状动脉、脑动脉、肾动脉等血管的功能。而孕期缺氧对子代肺动脉的影响及其机制知之甚少。该研究主要围绕孕期缺氧对成年雄性子代大鼠肺动脉血管功能的影响及机制进行探讨。
1 材料与方法
1.1 实验动物Sprague-Dawley(SD)大鼠清洁级,雌性大鼠体质量240~260 g,雄性大鼠体质量280~300 g,由苏州大学医学部实验动物中心提供,生产许可证号:XCYK 2002-2008,使用许可证号:SYXK 2002-0037。
1.2 主要试剂硝普钠(sodium nitroprusside, SNP)、乙酰胆碱(acetyl choline, ACH)、苯肾上腺素(phenylephrine, PE)、2-氨基乙基联苯基硼酸酯(2-aminoethyl diphenylborinate, 2APB)、硝苯地平(nifedipine, NIFE)和5-羟色胺(5-hydroxytryptamine, 5-HT)购于美国Sigma公司。
1.3 主要仪器Chart 7 Powerlab购自澳大利亚AD Instruments公司;Myograph System购自美国Radnoti LLC公司;荧光PCR仪、NanoDrop购自上海赛默飞世尔科技有限公司;ML-IICB数字智能测氧仪购自北京航天鹏诚仪器仪表有限公司。
1.4 常用缓冲液HEPES缓冲液:氯化钠16.58 g、氯化钾0.7 g、HEPES 4.76 g、EDTA 0.38 g、葡萄糖1.98 g、磷酸二氢钾0.32 g、七水硫酸镁0.84 g、二水氯化钙0.82 g,单蒸水定容到2 000 ml,用氢氧化钠调节pH值至7.35~7.45。
1.5 实验方法
1.5.1动物模型制备 将SD雌性和雄性大鼠饲养在同一房间里,室内温度设为22℃,每天各12 h光照和黑暗,并提供标准饲料和水。取3月龄雄性和雌性大鼠1 ∶1进行交配。交配一晚后检查雌性大鼠是否有阴道栓。如果有阴道栓,说明雌性大鼠成功受孕,记为妊娠的第1天。将受孕成功的雌性大鼠随机分为两组。其中一组在正常条件下饲养(21% O2),直至分娩,作为对照组;另一组在妊娠第10天置于缺氧箱中饲养(10.5% O2和89.5% N2),至妊娠第21天,作为缺氧组。缺氧箱每天打开1次用于替换垫料、食物和水,用钠石灰来吸收呼吸作用产生的水和二氧化碳。缺氧组和对照组孕鼠生下胎鼠,待子代断奶后,继续将雄性后代养至4月龄进行动物实验。
1.5.2血管实验 用4%水合氯醛将雄性子代大鼠麻醉后固定于托盘上,快速取出肺脏,立即浸泡在HEPES缓冲液中;在显微镜下轻柔地分离出肺动脉,将肺动脉剪成3 mm左右的血管环,置于冰上备用;在血管浴槽中加入5 ml 37℃ HEPES缓冲液,在显微镜下,用两根钢丝将肺动脉血管环固定于血管浴槽中的螺丝上;将血管浴槽与Powerlab转换器连接,向血管浴槽中持续通入适量的氧气;在电脑上打开Chart 7软件,将血管的张力调整至生理状态,并让血管环稳定30 min。以60 mmol/L氯化钾200 μl刺激血管,当血管收缩强度达到最大时,用37℃ HEPES缓冲液冲洗3遍,待血管稳定后再重复刺激2次。当收缩反应达到最大值后,记录并计算血管的平均收缩强度。用37℃ HEPES缓冲液冲洗3遍,待血管张力稳定至基线后,以50 μl 10-4mol/L的5-HT诱导血管收缩达到平台后,立即加入累积浓度梯度的ACH(10-9~10-4mol/L)和SNP(10-9~10-4mol/L);或用累积浓度梯度PE(10-9~10-4mol/L)刺激肺动脉血管环;或孵育L-型钙离子通道(L-type calcium channels,LTCCs)阻断剂NIFE或三磷酸肌醇(Inositol-1,4,5-trisphosphate, IP3)受体阻滞剂2APB后,观察离体肺动脉血管环对累积浓度梯度PE的收缩反应。
1.5.3RT-PCR检测肺组织中mRNA水平 使用TRIzol试剂提取肺动脉RNA,并使用NanoDrop分光光度计定量。用Takara逆转录试剂盒对RNA进行逆转得到cDNA。以GAPDH为内参,使用SYBR Green Supermix Taq试剂盒,RT-PCR检测成年子代雄性大鼠肺动脉肾上腺素能α1A受体(ADRA1A)、肾上腺素能α1D受体(ADRA1D)、肾上腺素能α2B受体(ADRA2B)、肾上腺素能α2C受体(ADRA2C)、肾上腺素能β1受体(ADRB1)、肾上腺素能β2受体(ADRB2)、肾上腺素能β3受体(ADRB3)、Cav1.2、T型钙离子通道(Cav3.2)的mRNA水平。以GADPH为内参,基因表达的相对定量采用2-△△Ct法计算得出。
1.5.4Western blot检测 取30 mg肺动脉血管组织研磨成粉末,将粉末转移到1.5 ml EP管中,加入RIPA裂解液,置于冰上,反复静置斡旋数十次;待管内无明显沉淀,置95 ℃水浴锅中加热15 min。配制浓缩胶和分离胶,取上清液进行SDS PAGE凝胶电泳。以β-actin作为内参,检测灰度值,对Cav1.2蛋白的表达水平进行定量分析。
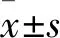
2 结果
2.1 ACH和SNP介导的肺动脉舒张反应缺氧组成年子代雄性大鼠的肺动脉血管环对ACH介导的舒张效应与对照组比较,差异无统计学意义(F=0.220 8)(图1A);缺氧组肺动脉血管环对SNP介导的舒张效应与对照组比较,差异无统计学意义(F=0.502 5)(图1B)。

图1 ACH和SNP介导两组子代肺动脉的舒张反应A:累积浓度ACH诱导的舒张反应;B:累积浓度SNP介导的舒张反应
2.2 PE介导的肺动脉收缩反应肺动脉对苯肾上腺素均有剂量依赖性收缩反应,缺氧组PE引起的肺动脉收缩强度低于对照组(F=4.077,P<0.001)(图2A),对PE介导的最大收缩反应低于对照组(P<0.001)(图2B);两组肺动脉最大收缩强度分别达到KCL引起的收缩强度的(14.28±2.572)%和(6.320±0.712)%(t=4.212)(表1)。

图2 PE介导两组子代肺动脉的收缩反应
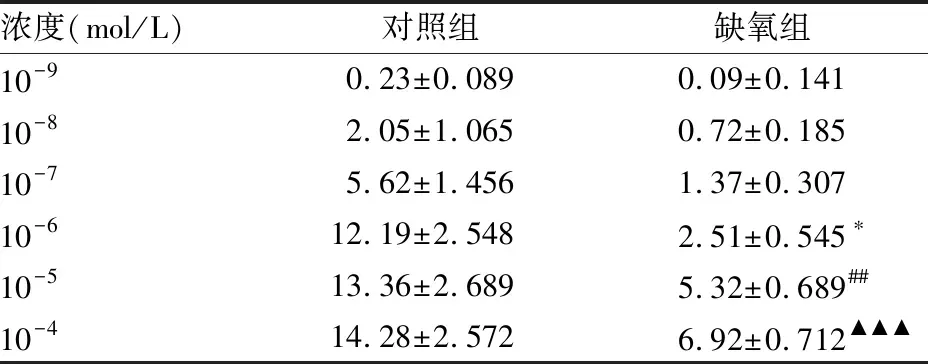
表1 肺动脉对不同累积浓度PE反应的比较
2.3 PE介导的肺动脉收缩反应与LTCCs有关用NIFE阻断LTCCs后,肺动脉对PE引起的收缩反应均减弱,且敷药后两组之间的收缩强度没有差异(图3A);孵育NIFE后,缺氧组PE引起的肺动脉最大收缩效应与对照组之间差异没有统计学意义(图3B);两组肺动脉最大收缩强度分别达到KCL引起的收缩强度的(2.77±0.608)%和(1.96±0.234)%(表2)。用2APB阻断IP3受体后,PE引起的肺动脉的收缩反应均减弱,且敷药后两组比较,缺氧组仍低于对照组(F=2.342,P<0.05)(图3C);孵育2APB后,缺氧组PE引起的肺动脉最大收缩效应仍低于对照组(P<0.05)(图3D);两组肺动脉最大收缩强度分别达到KCL引起的收缩强度的(8.96±0.980)%和(3.23±0.362)%(表2)。
2.4 肺动脉中PE受体、Cav1.2和Cav3.2的mRNA水平与对照组相比,缺氧组肺动脉血管PE的A型受体[ADRA1A(t=0.873 8)、ADRA1D(t=0.402 7)、ADRA2B(t=1.165)和ADRA2C(t=0.609 4)]和B型受体[ADRB1(t=0.268 2)、ADRB2(t=0.4053)和ADRB3(t=0.656 9)]的mRNA水平没有变化(图4);缺氧组肺动脉血管Cav1.2的mRNA表达水平低于对照组(P<0.001,t=4.859),而Cav3.2的mRNA表达在两组之间没有差异(t=0.1624)(图4)。
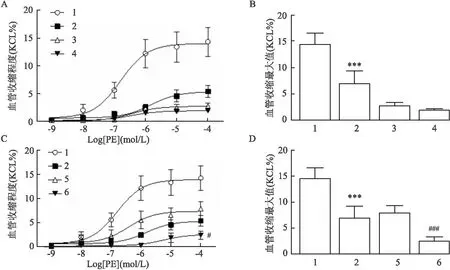
图3 PE介导两组子代肺动脉血管收缩与LTCC和2APB的关系
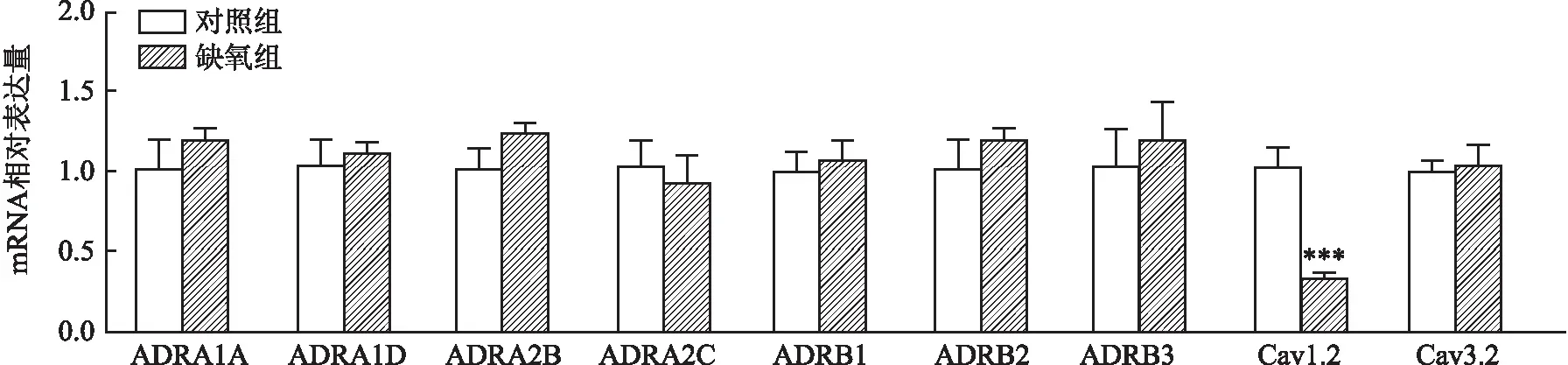
图4 肺动脉血管PE和LTCCs相关受体mRNA的表达情况与对照组比较:***P<0.001
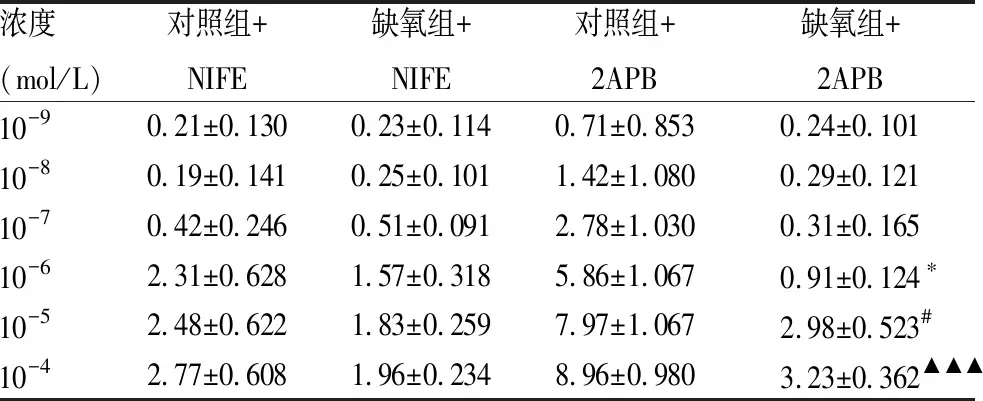
表2 肺动脉对孵育NIFE或2APB后不同累积浓度PE反应的比较
2.5 肺动脉血管中Cav1.2的蛋白水平与对照组比较,缺氧组肺动脉血管中Cav1.2的蛋白水平降低(P<0.01,t=5.313)(图5)。
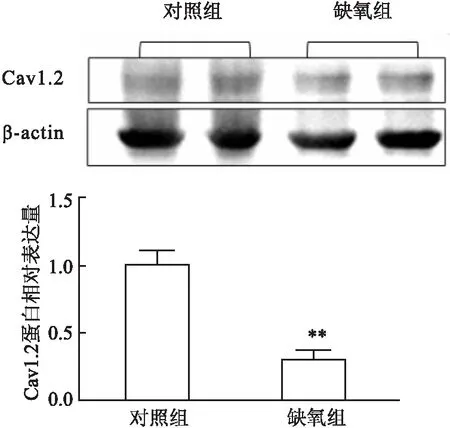
图5 肺动脉血管Cav1.2的蛋白表达情况与对照组比较:**P<0.01
3 讨论
本研究表明孕期缺氧可导致成年雄性子代大鼠肺动脉血管对苯肾上腺素引起的收缩反应减弱,且此收缩反应减弱主要与Cav1.2表达下调有关,而与胞内钙释放通路和苯肾上腺素受体的表达无关。孕期缺氧并不影响成年雄性子代大鼠肺动脉血管的舒张功能。
肾上腺素能受体广泛分布于外周血管参与血管张力的调节。本研究显示孕期缺氧成年子代肺动脉对苯肾上腺素介导的收缩减弱与其受体无关,可能由平滑肌细胞内的其他收缩机制引起的。血管平滑肌细胞胞内Ca2+浓度,在血管收缩中起着关键作用[10]。在阻力血管中,胞内Ca2+浓度升高主要有内质网Ca2+释放和外Ca2+内流介导完成。IP3Rs是一种广泛表达于内质网膜上的Ca2+释放通道,本研究显示通过抑制血管环IP3Rs后,缺氧子代肺血管环对苯肾上腺素的收缩反应仍明显减弱,这说明孕期缺氧导致子代肺血管收缩功能减弱与内质网IP3Rs介导内Ca2+释放无关。细胞外Ca2+进入细胞内主要通过电压门控Ca2+通道,其中LTCCs家族中Cav1.2通道对调节平滑肌细胞Ca2+浓度至关重要[10]。本研究表明通过抑制血管环LTCCs后,缺氧子代肺血管环对苯肾上腺素的收缩反应与对照组间无明显差异,这说明孕期缺氧导致子代肺血管收缩功能减弱与细胞膜LTCCs介导外Ca2+内流有关。
肺动脉平滑肌细胞内钙稳态的破坏被认为是肺动脉高压发病的一个重要触发因素[11-12]。在以往的研究[12]中缺氧可导致子代肺动脉血管LTCCs表达上调。本研究显示孕期缺氧下调子代大鼠肺动脉中Cav1.2的表达。肺循环作为一个高流量和低压力的系统,旨在优化气体交换过程,因此这一差异可能是机体的保护效应:Cav1.2下调极有可能是对缺氧诱导的高收缩的代偿性保护,从而提高肺循环血流量。
本研究表明孕期缺氧降低成年雄性子代大鼠肺动脉血管的收缩能力。这与以往提出的急性缺氧引起肺动脉高压、肺动脉收缩增强截然不同[12]。此外,以往的研究[5-8]发现,孕期缺氧可导致成年子代肠系膜、肾动脉及大脑中动脉的收缩功能增加,而本研究显示孕期缺氧导致子代肺血管收缩降低,这说明孕期缺氧对子代血管功能的影响因血管类型的不同而不同。本研究创新性的从离子通道水平揭示孕期缺氧导致子代肺血管功能障碍的机制;研究结果提示应加强孕期发生缺氧胎儿出生后的随访,也为产前孕期缺氧子代心血管疾病的临床治疗提供实验支持。
