尿石素B对胶质母细胞瘤U251细胞生物学行为的影响
2022-03-05刘翠兰代娟娟
刘翠兰,赵 娣,代娟娟,王 丹,李 晨,刘 松
胶质母细胞瘤(glioblastoma,GBM)是中枢神经系统最普遍、最具破坏性的原发性恶性肿瘤,其特点是生长速度快、侵袭性强[1]。手术联合化疗、放疗是治疗的主要手段,但GBM患者的生存率仍然较低[2]。天然化合物因其成本低、生物利用度高、毒性小、具有抗氧化、抗炎和抗肿瘤活性而受到越来越多的关注。尿石素B(urolithin B,UB)是鞣花丹宁和鞣花酸的肠道微生物代谢产物之一[3]。近年来,人们对尿石素的生物功能进行了体外和体内的研究,包括抗炎活性、抗肿瘤增殖、抗氧化活性、对脂质代谢的有益作用和延长寿命[4]。但是UB对GBM活性的影响尚无报道。本研究在体外实验中探究了UB对GBM细胞增殖、迁移、侵袭、凋亡及细胞周期的影响,及其对下游信号通路蛋白的影响,该研究为探究GBM的治疗药物提供新的实验基础。
1 材料与方法
1.1 材料UB购自美国Sigma公司;RIPA裂解液购自上海碧云天生物技术有限公司;BCA蛋白定量试剂盒购自南京诺唯赞生物科技股份有限公司;兔抗Phospho-p38、兔抗p38、兔抗Phospho-JNK、兔抗JNK、兔抗Phospho-AKT、兔抗AKT、兔抗ERK、兔抗Phospho-ERK、鼠抗β-actin抗体均购自美国Cell Signaling Technology公司;驴抗鼠二抗和羊抗兔二抗均购于美国Li-COR公司;CCK-8试剂盒购自美国MCE公司;Transwell小室购自美国Corning公司;FITC Annexin V 凋亡检测试剂盒和PI/RNase染色液均购自美国BD公司。主要仪器:双红外激光成像系统(美国Li-COR公司);SpectraMax M5酶标仪(美国Molecular Devices公司);IX53光学显微镜(日本Olympus公司);流式细胞仪(美国BD公司)。
1.2 细胞培养人胶质母细胞瘤U251细胞系购自中国科学院细胞库。U251细胞用含10%胎牛血清的DMEM培养基,置于37℃、5% CO2培养箱中培养。UB用DMSO溶解配置成0.2 mol/L的母液。
1.3 Western blot细胞用RIPA裂解液裂解,用BCA蛋白定量试剂盒进行蛋白浓度定量。蛋白复合物用12% SDS-PAGE进行电泳,湿转法转至PVDF膜,用pH 7.4的TBST缓冲液(0.02 mol/L Tris-HCl, 0.15 mol/L NaCl, 0.1% Tween-20)溶解的5%脱脂奶粉室温封闭1 h。分别加入一抗Anti-p-p38 (1 ∶1 000), Anti-p38 (1 ∶1 000),Anti-p-JNK (1 ∶1 000), Anti-JNK(1 ∶1 000),Anti-β-actin (1 ∶2 000),Anti-p-AKT(1 ∶1 000),Anti-AKT(1 ∶1 000),Anti-ERK(1 ∶1 000)及Anti-p-ERK(1 ∶1 000),4℃孵育过夜。TBST洗涤4次,每次10 min,加入二抗室温摇床孵育1 h。然后TBST洗膜4次,经双红外激光成像系统成像并识别灰度进行分析。
1.4 CCK-8法检测细胞增殖能力取对数期细胞,0.25%胰酶-EDTA消化后细胞计数,接种96孔细胞培养板,每孔接种3 000个细胞。实验分为对照组和不同浓度的UB处理组(20、40、80、120、160、200 μmol/L),培养24 h后,分别加入溶媒和不同浓度的UB,继续分别培养24、48 h,根据CCK-8试剂盒说明书,每孔加入10 μl CCK-8溶液,置于培养箱继续培养1~4 h后,用SpectraMax M5酶标仪检测450 nm吸光度值。
1.5 克隆形成实验检测细胞增殖能力取对数期细胞,接种12孔板,每孔接种500个细胞,分为对照组和不同浓度的UB处理组(40、80、160 μmol/L),培养24 h后,分别加入溶媒和不同浓度的UB处理,药物处理48 h后换液,加入不含药物的含10% FBS的DMEM培养基继续培养12 d。去除培养基,PBS洗涤2遍,甲醇固定20 min,PBS洗涤3遍,0.1%结晶紫染色20 min,PBS洗涤后观察拍照。
1.6 划痕愈合实验检测细胞迁移能力取对数期细胞接种6孔板,每孔接种1×106个细胞,24 h后,用200 μl移液器吸头做“井”字划痕,PBS洗涤3次,加入无血清培养基及不同浓度的UB(0、40、80、160 μmol/L)继续培养,0、24 h和48 h时显微镜下观察并拍照。用ImageJ软件计算划痕距离,划痕愈合百分比=(0 h划痕宽度-培养后划痕宽度)/0 h划痕宽度×100%。
1.7 Transwell侵袭实验检测细胞迁移能力Matrigel基质胶用PBS按照1 ∶8的比例稀释,取80 μl基质胶稀释液加入Transwell上室中,37℃培养箱放置2 h。取对数期细胞,用无血清DMEM培养基将细胞浓度调整至1×105个/ml,取150 μl细胞悬液加入Transwell上室,同时加入不同浓度UB(0、40、80、160 μmol/L)。下室加入含20% FBS的DMEM培养基。培养24 h后,取出小室甲醇固定20 min,PBS洗涤后,加入0.1%结晶紫染色20 min,PBS洗涤后,显微镜下观察拍照。取随机3个视野进行统计。
1.8 流式细胞术检测细胞凋亡和细胞周期细胞凋亡检测,取对数期细胞接种于6孔板,细胞用不同浓度UB(0、40、80、160 μmol/L)处理24 h,用不含EDTA的胰酶消化并收集细胞,冰预冷的PBS洗涤3遍,500 μl 1×binding buffer重悬细胞,加入5 μl FITC染色15 min,在上机检测前5min加入PI染色。细胞充分重悬后,上机检测并分析细胞凋亡数据。
细胞周期检测,取对数期细胞接种于6孔板,细胞用不同浓度的UB(0、40、80、160 μmol/L)处理24 h,消化并收集细胞,PBS洗涤3遍,加入冰预冷的70%的乙醇4℃固定过夜,PBS洗涤3遍,然后用PI/RNase染色液避光染色15 min。细胞充分重悬后,上机检测并用Modfit软件分析数据。
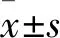
2 结果
2.1 UB对U251细胞增殖能力及克隆形成的影响与对照组相比,UB对U251细胞的增殖活性有明显影响,且呈浓度依赖性。进一步分析显示,在24 h时,20、40、80、120、160、200 μmol/L的UB处理组U251细胞的吸光度相对值与对照组细胞相比均降低,差异有统计学意义(F=429.10;P<0.01)。在48 h时,20、40、80、120、160、200 μmol/L的UB处理组U251细胞的吸光度相对值与对照组细胞比较均降低,差异有统计学意义(F=431.20;P<0.01)。见图1A。
与对照组相比,UB对U251细胞的克隆形成活性有明显影响,且呈浓度依赖性。进一步分析显示,40、80、160 μmol/L的UB处理组U251细胞的克隆形成率与对照组细胞相比均降低,差异有统计学意义(F=131.10,P<0.01)(图1B、C)。
2.2 UB对U251细胞迁移和侵袭能力的影响与对照组相比,UB对U251细胞的迁移能力有明显影响,且呈浓度依赖性。进一步分析显示,在24 h时,40、80、160 μmol/L的UB处理组U251细胞的划痕愈合率与对照组细胞相比降低,差异有统计学意义(F=22.51,P<0.05或P<0.01);48 h时,40、80、160 μmol/L的UB处理组U251细胞的划痕愈合率与对照组细胞比较均降低,差异有统计学意义(F=39.36,P<0.01)(图2A、B)。

图1 CCK-8法和细胞克隆形成实验检测UB对U251细胞增殖能力的影响

图2 划痕愈合实验和Transwell小室法检测UB对U251细胞迁移和侵袭能力的影响
与对照组相比,UB对U251细胞的侵袭能力有明显影响,且呈浓度依赖性。进一步分析显示,40、80、160 μmol/L的UB处理组U251细胞发生侵袭的相对细胞数量与对照组相比降低,差异有统计学意义(F=31.59,P<0.01)(图2C、D)。
2.3 UB对U251细胞凋亡和细胞周期的影响与对照组相比,UB对U251细胞的凋亡有明显影响,且呈浓度依赖性。进一步分析显示,40、80、160 μmol/L的UB处理组U251细胞凋亡相对值与对照组细胞相比升高,差异有统计学意义(F=51.05,P<0.01)(图3A、C)。与对照组相比,40、80、160 μmol/L的UB处理组U251细胞的周期有明显影响。进一步分析显示,与对照组细胞相比,高浓度UB处理组U251细胞处于G0/G1期细胞的比值降低(F=6.18,P<0.01),G2/M期细胞的比值升高(F=11.39,P<0.01),差异有统计学意义(图3B、D),而对处于S期细胞的比值没有影响(F=0.58,P>0.05),差异无统计学意义。
2.4 UB对U251细胞下游信号通路的调节作用如图4所示,与对照组相比,80、160 μmol/L的UB处理组能增加ERK蛋白的磷酸化水平,差异有统计学意义(P<0.05或P<0.01),40 μmol/L的UB处理组ERK蛋白磷酸化水平的改变没有显著变化;80、160 μmol/L的UB处理组AKT蛋白的磷酸化水平与对照组相比降低,差异有统计学意义(P<0.05或P<0.01),40 μmol/L的UB处理组与对照组相比,AKT蛋白的磷酸化水平没有显著变化;UB对p38和JNK磷酸化水平的影响没有统计学意义。

图3 不同浓度的UB对细胞凋亡及细胞周期的影响

图4 UB对下游信号通路蛋白的影响与0 μmol/L对照组比较:*P<0.05,**P<0.01
3 讨论
鉴于GBM的病死率非常高,因此,研制延长GBM患者生存时间、提高其生活质量的治疗策略和药物,特别是能够穿透血脑屏障治疗GBM细胞的药物势在必行。天然化合物/草药在历史上被认为是一种重要的治疗药物的来源。在现代医学中,大约40%的新合成药物是天然产物或来自天然化合物。据估计,大多数抗微生物和抗癌药物来自天然产物,天然产物已成为治疗重大疾病的新型药物或重要先导化合物的主要源泉[5]。
文献报道天然产物中鞣花丹宁和鞣花酸的肠道微生物代谢产物包括尿石素A(UA)、尿石素B(UB)、尿石素C(UC)和尿石素D(UD)[6]。UB可以抑制肝癌细胞[7]、黑色素瘤细胞[8]、前列腺癌[9]等肿瘤细胞的生长。本研究评价了UB对GBM细胞生长繁殖的抑制活性及其机制,并发现UB可以诱导GBM细胞凋亡和影响细胞周期的变化,表明UB具有较好肿瘤抑制效果。ERK、AKT蛋白在肿瘤的发生发展中发挥重要作用[9],本研究显示UB可以促进ERK的磷酸化水平,并抑制AKT的磷酸化,与文献[10]报道尿石素C可以促进葡萄糖诱导的ERK激活,UB抑制AKT、信号通路结果一致[11]。虽然有文献[12]报道UB具有抑制重组人单胺氧化酶A酶的活性,但是其发挥肿瘤抑制效果的下游作用分子或基因尚不清楚,还需要进一步深入研究。血脑屏障的通透性是化疗药物在GBM治疗中的重要限制因素,因为血脑屏障是给药GBM的物理和生理屏障。因此,传统的治疗方法是通过血脑屏障来治疗中枢神经系统。研究[13]报道UB可以通过血脑屏障,外周给予UB具有神经保护的功能[14]。UB穿透血脑屏障的能力使其成为治疗GBM极具潜力的药物。
综上所述,本研究系统研究了UB对GBM细胞增殖、迁移及侵袭的抑制活性,及其诱导细胞凋亡和细胞周期阻滞的作用。同时研究了UB对下游信号通路ERK和AKT的调节作用。因此,本研究为探究GBM的致病机制和靶向治疗提供新的理论依据。
