伯格替尼通过抑制EGFR磷酸化增强结直肠癌细胞的辐射敏感性
2022-03-05胡关朔赵国平
胡关朔,赵国平
结直肠癌是第三大最常见的癌症[1],在世界范围内,每年有超过180万结直肠癌新增病例,88万例与结直肠癌有关的死亡报告[2]。临床上,手术切除被认为是结直肠癌的主要治疗手段,放疗被认为是手术前后有效的治疗方式[3]。因此,迫切需要适当的策略来提高结直肠癌的辐射敏感性。表皮生长因子受体(epidermal growth factor receptor,EGFR)与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关,EGFR磷酸化激活下游通路,促进肿瘤细胞存活,辐射之后磷酸化表皮生长因子受体(p-EGFR)表达显著升高,p-EGFR通过促进DNA损伤修复,从而促进细胞存活[4-7]。抑制EGFR磷酸化可能是提高肿瘤细胞辐射敏感性的有效手段。该文以辐射作为处理肿瘤细胞的治疗手段,伯格替尼作为EGFR磷酸化抑制剂,以结直肠癌LOVO细胞作为研究对象,旨在通过使用伯格替尼抑制EGFR磷酸化,增强结直肠癌细胞辐射敏感性,从而为结直肠癌治疗提供可能的治疗方案。
1 材料与方法
1.1 细胞培养与辐射处理人结肠癌细胞系LOVO购自中国科学院细胞库,在DMEM/F12 (美国HyClone公司)培养。所有细胞系均以10%胎牛血清(以色列Biological公司)和1%青霉素/链霉素(上海碧云天公司)在37℃、5% CO2的环境中培养。
以伽马射线辐射器(Biobeam GM X irradiator, 德国Leipzig公司)作为辐射源,使用高能伽马射线照射细胞,剂量率为3.27 Gy/min,由计算机自动控制。设备每年由厂家进行维护和校准,保证辐射剂量的精度。
1.2 细胞活力测试CCK-8试剂盒测定细胞活力。在96孔板中接种细胞悬液,5 000个/孔细胞,伯格替尼(1 000 nmol/L)处理细胞。药物治疗48 h后,每孔加入10 μl CCK-8溶液,在细胞培养箱孵育4 h后用酶标仪测定450 nm处的吸光度(optical density, OD)值。
1.3 化学品及试剂EGFR、p-EGFR(美国CST公司), cleaved caspase-9、cleaved caspase-7、cleaved caspase-3、γ-H2AX、ACTIN(中国proteintech公司), CCK-8(合肥biosharp公司),伯格替尼(上海MCE公司),膜蛋白提取试剂盒(上海碧云天公司)。
1.4 免疫荧光将细胞接种于玻片上,用PBST洗涤细胞3次(每次10 min),再于室温下用100%甲醇固定20 min。在室温下用 0.5% Triton X-100渗透细胞30 min,1% BSA在PBST(0.1%,TritonX-100)中在室温封闭1 h,滴加相应兔来源的单克隆抗体(p-EGFR,1 ∶1 000)于4 ℃孵育过夜。PBST洗涤3次,滴加相应的荧光二抗室温避光孵育30 min。PBST洗涤3次,细胞核用DAPI孵育3 min。PBST洗涤3次,玻片面朝下置于在玻片上,滴加含有抗荧光淬灭剂的封片剂封片,荧光显微镜检测荧光。
1.5 Western blot实验分别收集EGFR敲低、单独辐射处理、单独伯格替尼处理的LOVO细胞,以及辐射和伯格替尼联合处理的LOVO细胞。用预冷的PBS洗涤2次,往细胞中加入适量RIPA裂解液(含有罗氏蛋白酶抑制剂),冰上充分裂解,提取蛋白并进行定量。SDS-PAGE凝胶电泳,转膜,转移到5%脱脂奶粉TBST封闭液于室温封闭1 h。孵育相应来源的单克隆抗体[鼠抗ACTIN(1 ∶1 000),γ-H2AX(1 ∶1 000),兔抗:EGFR(1 ∶1 000),p-EGFR(1 ∶1 000),cleaved caspase-9(1 ∶1 000),cleaved caspase-7(1 ∶1 000)和cleaved caspase-3(1 ∶1 000)], 4 ℃孵育过夜,TBST洗涤3次,相应二抗室温孵育1 h,荧光检测。
1.6 流式细胞分析用预冷的PBS洗涤细胞2次,将细胞重新悬浮在1×缓冲液中,细胞密度为1×105个/ml。将104个细胞转移到5 ml的培养管中。添加5 μl FITC Annexin V和5 μl PI。轻轻涡旋细胞,并在室温避光孵育15 min。在每管中添加400 μl缓冲液,1 h内流式细胞仪分析。
1.7 DR-GFP质粒质粒由军事科学院王治东实验室赠送。细胞通过两种主要途径修复DSBs:非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous recombination,HR)。NHEJ和HR的发生往往与过早衰老和肿瘤发生有关,因此用定量的方法来测量每个DSB修复途径是很重要的。课题组利用已经开发的荧光报告结构DR-GFP,测量NHEJ和HR。该结构是基于一个工程GFP基因,包含一个罕见的切割I-SceI内切酶诱导DSBs的识别位点。起始结构为GFP阴性,因为GFP基因被额外的外显子或突变灭活。 成功修复I-SceI诱导的NHEJ或HR断裂,恢复功能性GFP基因。通过流式细胞分析术细胞测量计算的GFP阳性细胞的数量,进而提供了NHEJ或HR效率的定量测量。
1.8 构建EGFR敲低的LOVO稳转细胞系使用三质粒系统构建慢病毒颗粒(pLKO.1,psPAX2和pMD2.G),psPAX2和pMD2.G是辅助包装质粒。目标序列为 5′-CCCGTCGCTATCAAGGAATTA-3′,构建的稳转细胞系使用含嘌呤霉素(1.5%)的完全培养基培养。
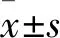
2 结果
2.1 辐射诱导EGFR磷酸化水平升高通过Western blot方法检测EGFR和p-EGFR的表达水平。使用4 Gy的辐射剂量,在不同的时间点对EGFR和p-EGFR的表达水平进行检测,结果显示辐射处理细胞24 h后p-EGFR的含量到达最高值(图1A),差异有统计学意义(F=26.335,P<0.01),用不同剂量(0~8 Gy)辐射处理LOVO细胞,24 h后对LOVO细胞的EGFR和p-EGFR的表达水平进行检测。随着辐射剂量的升高,EGFR的磷酸化水平升高(图1B),差异有统计学意义(F=32.115,P<0.01)。
2.2 辐射诱导细胞膜上EGFR磷酸化水平升高不同剂量(0~8Gy)辐射处理LOVO细胞,24 h后提取LOVO细胞的膜蛋白并对EGFR磷酸化水平进行检测,Western blot结果显示,随着辐射剂量的增加,细胞膜上EGFR的磷酸化水平增高(图2A),差异有统计学意义(F=43.332,P<0.01)。通过免疫荧光检测磷酸化EGFR的定位,4 Gy辐射处理,24 h后对LOVO细胞进行荧光检测,结果与Western blot结果一致,辐射处理之后细胞膜上EGFR磷酸化水平增高(图2B)。综上结果,EGFR是通过自身磷酸化响应辐射。
2.3 伯格替尼呈剂量依赖性抑制EGFR磷酸化水平采用不同浓度的伯格替尼(0、10、100、500、1 000、3 000 nmol/L)处理细胞48 h后检测细胞活力,结果显示随着伯格替尼浓度的升高,LOVO细胞活力被抑制(图3A),差异有统计学意义(F=112.365,P<0.01)。Western blot分析结果显示,EGFR的磷酸化水平随着药物浓度的增加而降低(图3B),差异有统计学意义(F=132.336,P<0.01)。

图1 辐照诱导EGFR磷酸化水平升高
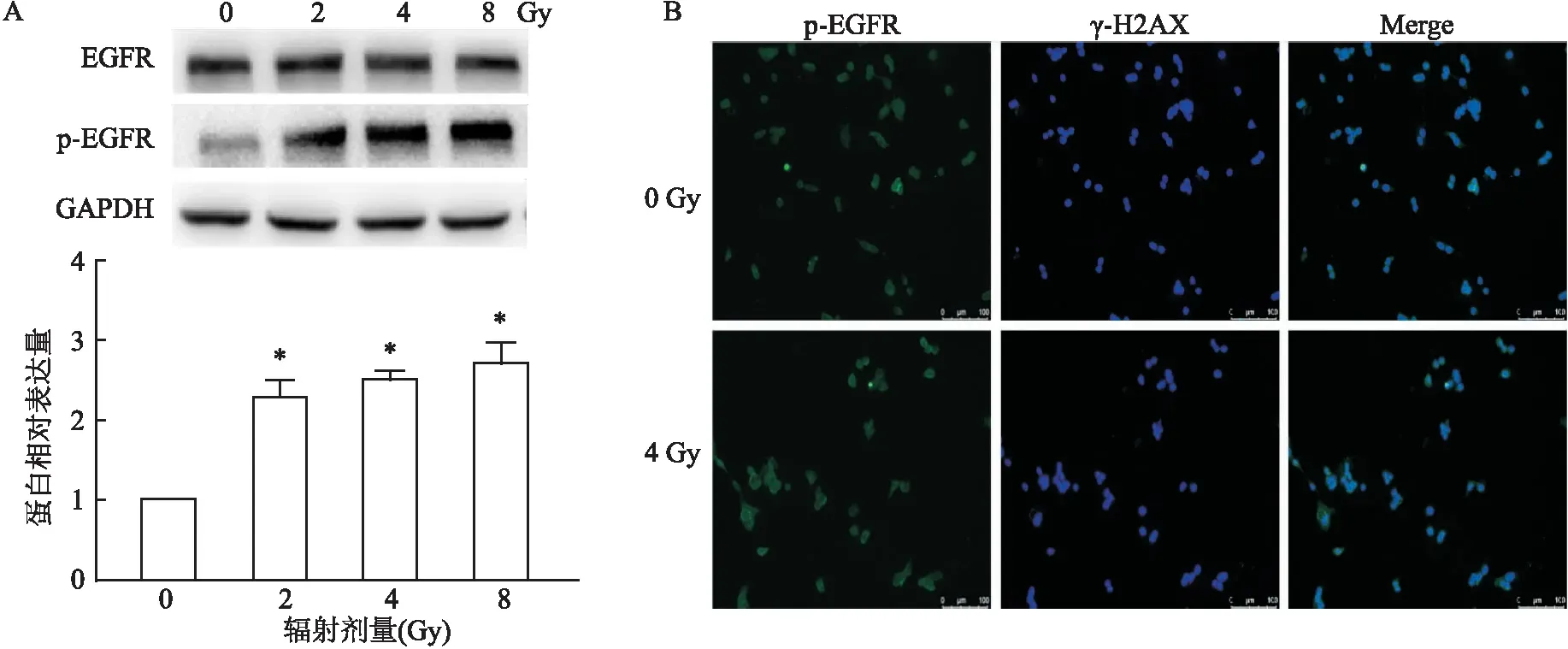
图2 辐照诱导细胞膜上EGFR磷酸化水平升高

图3 伯格替尼呈剂量依赖性抑制EGFR磷酸化水平
2.4 伯格替尼处理结直肠癌细胞LOVO可以抑制非同源末端连接课题组构建了EGFR敲低的LOVO细胞系,Western blot检测敲低效果,在EGFR敲低的细胞系中,EGFR和p-EGFR的表达显著降低(图4A),差异有统计学意义(F=21.331,P<0.01)。EGFR通过参与非同源末端连接促进DNA损伤修复,使用DR-GFP系统进行检验,该系统的原理如图所示(图4B)I-Sce切割AD区域产生非同源末端,如果细胞内存在非同源末端连接,则断裂区域可被修复,报告基因GFP表达,发出绿光。使用DR-GFP质粒系统检测细胞非同源末端连接水平,结果显示在敲低EGFR的LOVO细胞中非同源末端连接被抑制,伯格替尼处理之后,非同源末端连接被抑制(图4C),差异有统计学意义(F=36.851,P<0.01)。
2.5 伯格替尼处理可以增强结直肠癌LOVO细胞的辐射敏感性浓度为1 000 nmol/L的伯格替尼处理细胞24 h之后进行4 Gy辐射处理,辐射之后24 h进行Western blot检测,结果显示γ-H2AX、cleaved caspase-3、cleaved caspase-7和 cleaved caspase-9表达升高(图5A),差异有统计学意义(P<0.01)。Annexinv FITC/PI 双标记法检测结果显示细胞总凋亡率分别为(6.7±2.3)%、(29.1±3.1)%、(8.2±2.2)%、(33.3±2.5)% (图5B),差异有统计学意义(F=21.674,P<0.01)。

图4 伯格替尼处理结直肠癌细胞LOVO可以抑制非同源末端连接
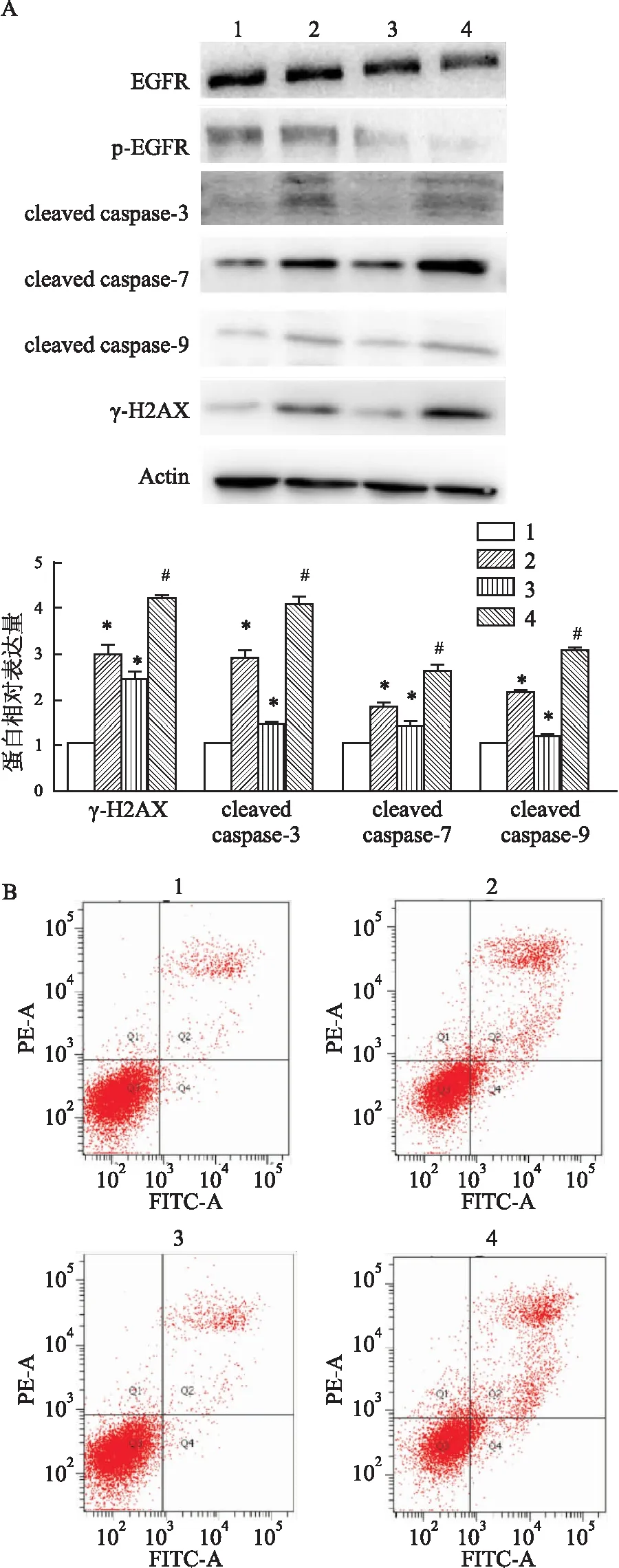
图5 伯格替尼处理可以增强结直肠癌LOVO的辐射敏感性
3 讨论
结直肠癌是威胁人类健康的一种重大疾病,放疗是治疗结直肠癌的一种有效手段,但细胞内损伤修复机制的激活会使结直肠癌细胞对放疗产生抵抗[8]。EGFR信号通路的激活是产生辐射抵抗的关键因素,EGFR对调节细胞生长、增殖和分化起着重要作用,并且与肿瘤细胞的增殖、血管生成、肿瘤侵袭、转移及细胞凋亡的抑制有关[9]。因此探究EGFR信号通路在损伤修复中的作用对结直肠的放疗至关重要。
EGFR活化后可以激活ERK和AKT通路促进细胞存活,并且以磷酸化形式转位入核参与DNA损伤修复,通过促进DNA损伤修复减少细胞凋亡[10],这可能是癌细胞产生辐射抗性的主要原因。本研究显示,辐射之后结直肠癌细胞中EGFR的磷酸化水平升高,本实验使用DR-GFP质粒验证EGFR主要通过参与非同源末端连接修复导致辐射抵抗,与之前的报道[11]一致。因此抑制EGFR的磷酸化可能是提高结直肠癌细胞辐射敏感性的有效手段。
伯格替尼是一种酪氨酸激酶抑制剂(TKI),于2016年5月被食品和药物管理局(FDA)批准上市,可以有效抑制AKT阳性,三突变的EGFR癌细胞,并在非小细胞肺癌中得到证实[12]。本实验在结直肠癌细胞验证了伯格替尼对EGFR磷酸化的抑制作用,伯格替尼呈剂量依赖性的抑制EGFR磷酸化。使用伯格替尼处理细胞后,结直肠癌细胞非同源末端重组修复途径被显著抑制。
细胞凋亡是辐射诱导细胞死亡的主要方式[13],cleaved caspase-9通过激活下游效应蛋白caspase-3和caspase-7产生cleaved caspase-3, cleaved caspase-7进而促进细胞凋亡[14]。本研究显示伯格替尼联合辐射处理从而触发细胞凋亡通路,最终诱导线粒体依赖的内在凋亡,线粒体依赖的内源性凋亡相关蛋白cleaved caspase-3, cleaved caspase-7, and cleaved caspase-9表达显著升高,从而增强结直肠癌细胞的放射增敏作用。
综上所述,伯格替尼通过抑制EGFR的磷酸化导致细胞的非同源末端链接修复被抑制,加剧辐射引起的DNA损伤,导致细胞凋亡增加。本实验首次将伯格替尼与癌症放射治疗相结合,这些数据可能为临床上结直肠癌治疗提供支持。
