基于混合吸附剂磁性固相萃取/高效液相色谱-串联质谱法测定水中磺胺和喹诺酮类抗生素残留
2022-03-04魏丹,张菊,国明
魏 丹,张 菊,国 明
(1.河北经贸大学 生物科学与工程学院,河北 石家庄 050061;2.浙江省化工研究院有限公司分析测试中心,浙江 杭州 310023)
抗生素作为一种基础用药,在各种常见的细菌性疾病治疗中发挥了重要作用[1],已广泛应用于临床、畜牧和水产等领域[2]。但由于长期不合理使用并不断排放进入环境,大多数抗生素会沉积或迁移到水体、沉积物和土壤等环境介质形成污染,影响环境中微生物的生态平衡。目前,抗生素在我国河流、地下水、湖泊和海洋等天然水体中均有不同程度的检出[3]。该类药物进入环境后难分解,可通过饮用水、食物链等方式进入人体,对人体健康造成潜在的风险。因此,建立准确、灵敏、可靠的检测该类抗生素残留含量的分析方法十分必要。
水体中抗生素残留常用的检测方法主要有毛细管电泳法(CE)[4]、高效液相色谱法(HPLC)[5]、高效液相色谱-质谱法(HPLC-MS)[6]等。其中HPLC-MS 法具有灵敏高效、快速准确和专属性强等优势,被广泛应用于抗生素残留分析[7]。由于水体中抗生素的浓度极低,且存在大量干扰物,在仪器检测前通常需对待测物进行分离和富集。目前用于环境水体中抗生素的样品前处理技术主要有固相萃取(SPE)[7]、磁性固相萃取(MSPE)[8]、QuEChERS[9]等。QuEChERS适用于多种抗生素的检测,操作简便,分析快速,但其选择性吸附效果和净化效果比SPE 差。MSPE 是以磁性材料为吸附剂的一种新型SPE,与传统SPE相比,MSPE具有前处理步骤简单、有机溶剂消耗少、目标物回收率较高、样品不易损失等优点,已被用于抗生素的检测中[10-11]。目前关于抗生素药物MSPE 萃取的研究报道通常采用一种磁性材料,与目标物相互作用的活性位点较为单一,很难满足多种类目标物同时测定的检测要求[12-15]。采用混合吸附剂进行萃取可有效提高对不同种类待测物的萃取能力[16],但基于混合吸附剂的样品前处理方法在抗生素检测中的应用鲜有报道。
为满足水中多种类抗生素的同时测定需求,提高对不同目标物的萃取能力,本研究通过制备磁性大孔有机共聚物材料(Fe3O4@SiO2@PLS)和磁性金属有机骨架材料(Fe3O4@ZIF-8),将两种材料共同作为磁性吸附剂,通过优化磁性萃取剂用量、吸附时间、样品pH 值、洗脱剂种类和洗脱时间等实验条件,建立了检测实际水样中常见的4种磺胺类和8种喹诺酮类抗生素的MSPE/高效液相色谱-串联质谱(HPLC-MS/MS)方法。
1 实验部分
1.1 仪器、试剂与材料
Agilent 1290 infinity 高效液相色谱-6460 Triple Quad 质谱仪(带自动进样器,美国Agilent 公司);ZORBAX Eclipse Plus C18(100 mm × 3.0 mm,1.8 μm,美国Agilent 公司);Milli-Q 超纯水器(美国Millipore 公司);0.22 μm 微孔滤膜(上海安谱科学仪器有限公司);KQ-100DE 超声波清洗器(昆山市超声仪器有限公司);S-4700型场发射扫描电子显微镜(SEM,日本Hitachi公司);傅里叶变换红外光谱分析仪(FT-IR,德国Bruker公司)。
标准物质:磺胺吡啶、马波沙星、磺胺二甲基嘧啶、氟罗沙星、氧氟沙星、恩诺沙星、环丙沙星、奥比沙星、磺胺异唑、磺胺多辛、喹酸、萘啶酸(纯度均≥95%,北京迪马科技有限公司);甲醇、乙腈(色谱纯,美国Sigma-Aldrich 公司);其他试剂均为分析纯;乙二醇、二氯甲烷、甲酸、乙酸、氨水等(分析纯,杭州双林化工试剂厂);三氯化铁(FeCl3·6H2O)、2-甲基咪唑、硝酸锌(Zn(NO3)2)、正硅酸乙酯(TEOS)、二乙烯基苯(DVB)、N-乙烯基吡咯烷酮(NVP)、偶氮二异丁腈(AIBN)、甲基丙烯酸3-(三甲氧基硅基)丙酯(MPS)(Sigma Aldrich 试剂公司);实验用水为超纯水(电阻率≥18.2 MΩ·cm),由Millipore 超纯水发生器制备。
1.2 溶液配制
准确称取标准物质各0.100 0 g 于100 mL 容量瓶中,用甲醇溶解并定容,得到1 g/L 的标准储备溶液,于4 ℃冰箱内避光保存。使用时,用水稀释至所需浓度,现用现配。
1.3 磁性净化材料的制备
首先,采用溶剂热法制备Fe3O4纳米颗粒[17],用于后续制备Fe3O4@SiO2@PLS和Fe3O4@ZIF-8。
1.3.1 Fe3O4@SiO2@PLS 的制备参照文献[18]方法,使用硅烷化试剂TEOS 在Fe3O4表面形成硅层得到Fe3O4@SiO2,然后加入MPS,通过溶胶-凝胶法与Fe3O4@SiO2表面形成双键基团,得到Fe3O4@SiO2@MPS。
称取3 g Fe3O4@SiO2@MPS 置于1 000 mL 三口烧瓶中,加入500 mL 乙腈,超声10 min,依次加入6.3 mL DVB、7.5 mL NVP 和0.18 g AIBN,超声5 min 分散均匀,将烧瓶转移至蒸馏装置中,收集乙腈,于75 ℃预聚合反应20 min,115 ℃聚合反应1 h。反应完成后静置冷却至室温,加入蒸馏收集到的乙腈(约150~200 mL),超声分散后,在外加磁场作用下收集沉淀物,依次用乙腈和乙醇清洗3次,于室温(25 ℃)干燥,即得核壳结构的Fe3O4@SiO2@PLS。
1.3.2 Fe3O4@ZIF-8 的制备通过低温水热法制备Fe3O4@ZIF-8[19]。具体步骤为:称取0.5 g Fe3O4纳米粒子置于烧杯中,加入50 mL 甲醇,搅拌至分散均匀,加入50 mL 2-甲基咪唑甲醇(0.609 mmol·L-1),搅拌至混合均匀。加入50 mL Zn(NO3)2·6H2O 甲醇溶液(0.084 mmol·L-1),转移至反应釜中,70 ℃下水热反应2 h。反应完毕后冷却至室温,使用磁铁分离收集沉淀物,用水和乙醇交替冲洗3次至近中性,所得黑色粉末于60 ℃真空条件下干燥6 h。
1.4 混合吸附剂MSPE萃取
采集的水样经0.22 μm 滤膜过滤去除悬浮颗粒物,加入HAc 和NH3·H2O 调至pH 7.0。称取磁性材料Fe3O4@SiO2@PLS(35 mg)和Fe3O4@ZIF-8(15 mg)置于50 mL 烧杯中,依次用甲醇、去离子水清洗和活化,然后加入10 mL水样或混合标准溶液(5 μg/L),超声10 min加速对目标物的吸附;用磁铁将磁性吸附剂分离收集在烧杯底部,弃去上清液。加入10 mL 5%(体积分数)氨水甲醇溶液超声5 min,分3次重复进行洗脱,合并洗脱溶液在N2下吹至近干,然后溶于1 mL 水中,经0.22 μm 滤膜过滤后,待HPLC-MS/MS分析。萃取流程如图1所示。

图1 混合模式MSPE示意图Fig.1 Schematic illustration for mixed mode magnetic solid phase extraction
1.5 仪器条件
液相色谱条件:ZORBAX Eclipse Plus C18色谱柱(100 mm × 3.0 mm,1.8 μm);柱温:35 ℃,流速:0.3 mL·min-1;进样体积:2 μL;流动相为甲醇(A)和0.1%(体积分数)甲酸水溶液(B)。梯度洗脱程序:0~1 min,10% A;1~7 min,10%~40% A;7~10 min,40%~60% A;10~11 min,60%~90%A;11~12 min,90%~10%A,分析时间15 min。
质谱条件:离子源为电喷雾离子化源(ESI),采用正离子检测模式;多反应监测(MRM)模式进行定量分析。干燥气(N2)温度为300 ℃,干燥气流速为5 L·min-1;雾化气(N2)压力为310 kPa;鞘气(N2)温度为250 ℃,鞘气流速为10 L·min-1;毛细管电压为4 500 V,喷嘴电压为0 V。质谱采集参数见表1。
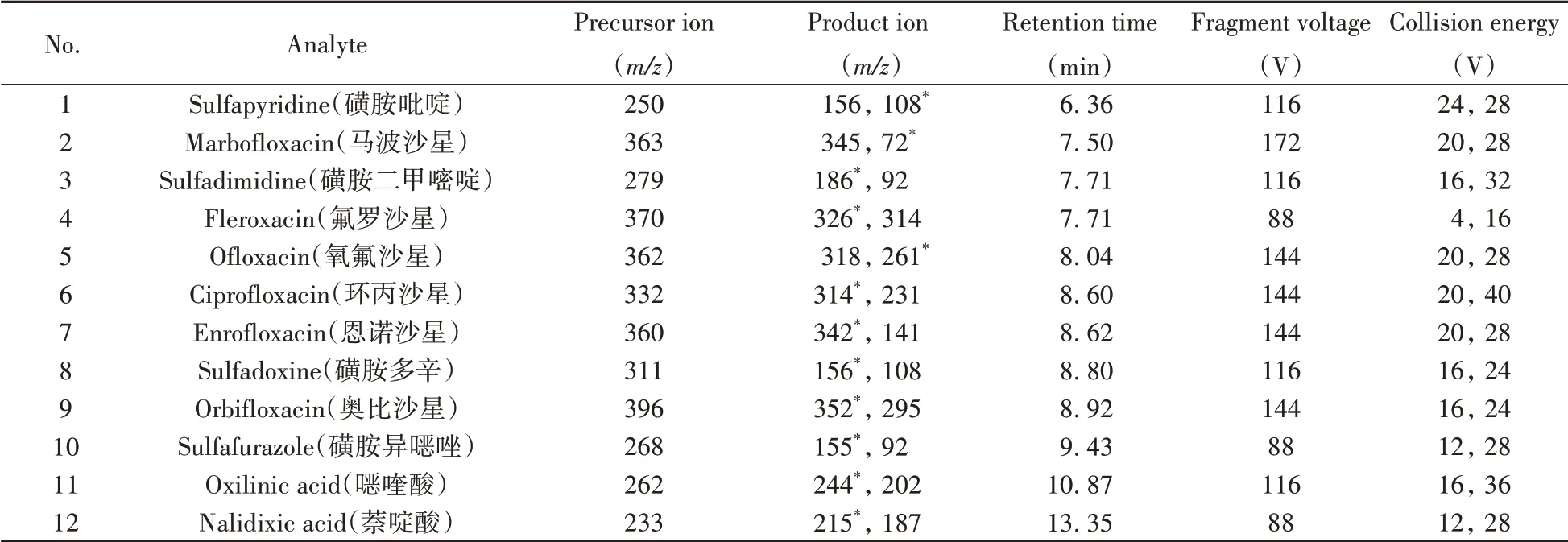
表1 12种抗生素的质谱参数Table 1 MS parameters for the 12 antibiotics residues
2 结果与讨论
2.1 磁性净化材料的表征
Fe3O4、Fe3O4@SiO2@PLS和Fe3O4@ZIF-8的扫描电镜图见图2。采用溶剂热法制备的Fe3O4磁性纳米颗粒呈规则的球形,表面相对光滑,颗粒形状大小较为均匀,具有较大的比表面积(图2A)。由双层复合核壳结构Fe3O4@SiO2@PLS 的扫描电镜(图2B)可见,复合物呈较规则的球形,尺寸约为500~600 nm,且未见Fe3O4纳米颗粒,表明核壳结构Fe3O4@SiO2@PLS 磁性纳米材料制备成功。由图2C 可以看出Fe3O4成功附着于正六边形ZIF-8 晶体表面,尺寸约为200 nm,表明Fe3O4@ZIF-8 磁性纳米材料制备成功。

图2 Fe3O4(A)、Fe3O4@SiO2@PLS(B)和Fe3O4@ZIF-8(C)的扫描电镜图Fig.2 SEM images of Fe3O4(A),Fe3O4@SiO2@PLS(B)and Fe3O4@ZIF-8(C)
采用傅里叶变换红外光谱(FT-IR)对Fe3O4@SiO2@PLS 和Fe3O4@ZIF-8 进行表征,如图3A 所示,580 cm-1的特征吸收峰对应Fe3O4的Fe—O—Fe 伸缩振动[20],1 068.0 cm-1的峰对应Si—O—Si 基团的面内伸缩振动[21],1 634.4、3 436.5 cm-1的峰分别对应Si—OH 的弯曲振动和伸缩振动[22]。图3A 中同时包括Fe3O4和PLS 材料的特征吸收峰,进一步表明PLS 成功包覆于磁性粒子Fe3O4表面。如图3B 所示,422.8 cm-1的峰对应Zn—N 的伸缩振动,说明Zn2+与2-甲基咪唑结合,588.9 cm-1的特征吸收峰对应磁核的Fe—O—Fe 伸缩振动,1 384.1 cm-1的特征吸收峰对应ZIF-8 中咪唑环的伸缩振动,1 569.8 cm-1的吸收峰是由于ZIF-8 结构中咪唑分子C===== N 的伸缩振动引起[23],3 434.0 cm-1的吸收峰是由于Fe3O4的—OH 伸缩振动引起[24],图3B 中同时包括Fe3O4和ZIF-8 材料的特征吸收峰,进一步表明ZIF-8 成功负载在Fe3O4的表面。
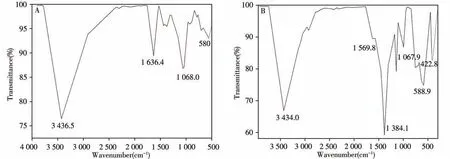
图3 Fe3O4@SiO2@PLS(A)和Fe3O4@ZIF-8(B)的红外光谱图Fig.3 FT-IR spectra of Fe3O4@SiO2@PLS(A)and Fe3O4@ZIF-8(B)
Fe3O4、Fe3O4@SiO2@PLS和Fe3O4@ZIF-8的X-射线衍射图如图4 所示,30.12°、35.47°、43.11°、53.49°、57.06°和62.62°处 的 特 征 峰 对 应 于Fe3O4的(222)、(331)、(400)、(422)、(511)和(440)晶面[25],12.7°、14.7°、16.4°、18.0°、22.1°、24.5°、26.7°、29.6°和30.6°处的特征峰对应于ZIF-8的(112)、(113)、(022)、(222)、(114)、(223)、(134)、(044)和(244)晶面[26]。上述Fe3O4和ZIF-8 特征峰在Fe3O4@ZIF-8 的XRD 图中出现,由于无定型结构PLS 无尖峰,Fe3O4@SiO2@PLS 中的峰与Fe3O4特征峰相对应,以上结果说明Fe3O4@ZIF-8和Fe3O4@SiO2@PLS成功制备。

图4 Fe3O4、Fe3O4@SiO2@PLS和Fe3O4@ZIF−8的X-射线衍射图Fig.4 XRD images of Fe3O4,Fe3O4@SiO2@PLS and Fe3O4@ZIF−8
2.2 混合吸附剂MSPE条件的优化
吸附条件和洗脱条件是影响MSPE 的关键因素。考察了吸附条件和洗脱条件对12 种抗生素萃取效率的影响,每组试验平行测定3次。
2.2.1 吸附条件的选择2种磁性材料的组合使用增加了官能团活性位点,增强了其与目标物之间的相互作用,如范德华力(Fe3O4@ZIF-8)、孔径选择性(Fe3O4@ZIF-8和Fe3O4@SiO2@PLS)、π-π共轭相互作用(Fe3O4@ZIF-8和Fe3O4@SiO2@PLS)和亲水亲脂作用(Fe3O4@SiO2@PLS)。因此,2种磁性吸附剂的用量决定了萃取效率。固定磁性吸附剂的总用量为50 mg,考察了Fe3O4@SiO2@PLS和Fe3O4@ZIF-8不同用量组合(50+0 mg、15+35 mg、25+25 mg、35+15 mg和0+50 mg)对水样中12种抗生素萃取回收率的影响。结果显示,单独使用Fe3O4@SiO2@PLS(50 mg)时,马波沙星、氟罗沙星、氧氟沙星、环丙沙星、奥比沙星和磺胺异唑的回收率仅为30.5%~60.3%,单独使用Fe3O4@ZIF-8(50 mg)时,8种喹诺酮类药物的回收率仅为28.2%~41.6%。组合使用2种磁性吸附剂的回收率优于单一磁性吸附剂,当Fe3O4@SiO2@PLS和Fe3O4@ZIF-8的组合用量为35+15 mg时,回收率大于75%的目标物个数最多,12种目标物的回收率为75.1%~103%。因此,选择最佳组合用量为35 mg Fe3O4@SiO2@PLS和15 mg Fe3O4@ZIF-8。
合适的吸附方式和充足的吸附时间可保证目标物与磁性吸附剂充分的相互作用,达到吸附平衡,有效提升萃取效率。考察了涡旋振荡和超声萃取2 种方式对目标物回收率的影响。结果表明,磁性吸附剂用量为35 mg Fe3O4@SiO2@PLS 和15 mg Fe3O4@ZIF-8,吸附时间为10 min 时,采用涡旋振荡和超声萃取对12 种目标物的回收率分别为70.3%~90.4%和72.9%~96.9%,实验最终选择超声萃取方式。进一步考察了不同超声吸附时间(1、2、5、10、15 min)对目标物回收率的影响(如图5A),当吸附时间为1~10 min 时,12 种目标物的萃取回收率随吸附时间的增加而增大,超声吸附10 min 达到最优吸附效果,继续增加吸附时间,萃取回收率基本保持不变。因此,选择超声吸附时间为10 min。
由于磺胺类和喹诺酮类药物多为两性化合物,磺胺类具有芳氨基和磺酰胺基,喹诺酮类含有氨基和羧基,样品溶液pH 值会影响两性目标物的存在状态以及磁性吸附剂的官能团活性,使得目标物与2种磁性材料之间形成氢键作用、静电作用等进而影响萃取回收率。考察了样品溶液pH 值对目标物回收率的影响(如图5B),当样品溶液pH 值为4~7 时,12种目标物的萃取回收率随pH 值的增加而增大,继续增加pH值至9,萃取回收率反而下降。因此,最终选择样品溶液pH值为7。

图5 超声吸附时间(A)和样品溶液pH值(B)对12种抗生素萃取效率的影响Fig.5 Effect of ultrasonic adsorption time(A)and the pH of sample solution(B)on the extraction efficiencies of 12 antibiotics
2.2.2 洗脱条件的选择洗脱剂是影响MSPE萃取效率的重要因素之一。由于大多数磺胺类和喹诺酮类药物为极性化合物,易溶于甲醇和乙腈等极性溶剂,文献多选择甲醇和乙腈作为洗脱剂[22-26]。由于甲醇的沸点低于乙腈,更易挥发浓缩,因此实验选择甲醇作洗脱剂,进一步对比了体积均为10 mL 的甲醇、2%甲酸甲醇溶液、5%氨水甲醇溶液对12 种目标物的洗脱效果。如图6A 所示,以2%甲酸甲醇溶液作为洗脱剂时目标物的回收率<10.8%,使用5%氨水甲醇溶液时的回收率优于2%甲酸甲醇。由于碱性条件下大多数目标物和磁性材料表面呈负电模式,形成静电斥力有利于洗脱,当洗脱剂为5%氨水甲醇溶液时,12种目标物的回收率为74.9%~118%,洗脱效果最优。因此,最终选择10 mL 5%氨水甲醇溶液作为洗脱剂。同时考察了不同超声洗脱时间(2~10 min)对目标物萃取回收率的影响。如图6B所示,当洗脱时间为2~5 min时,12种目标物的萃取回收率随洗脱时间的增加而增大,当洗脱时间为5 min时,12种目标物的萃取回收率达到最大值,继续增加洗脱时间,萃取回收率基本保持稳定,因此超声洗脱时间选择5 min。
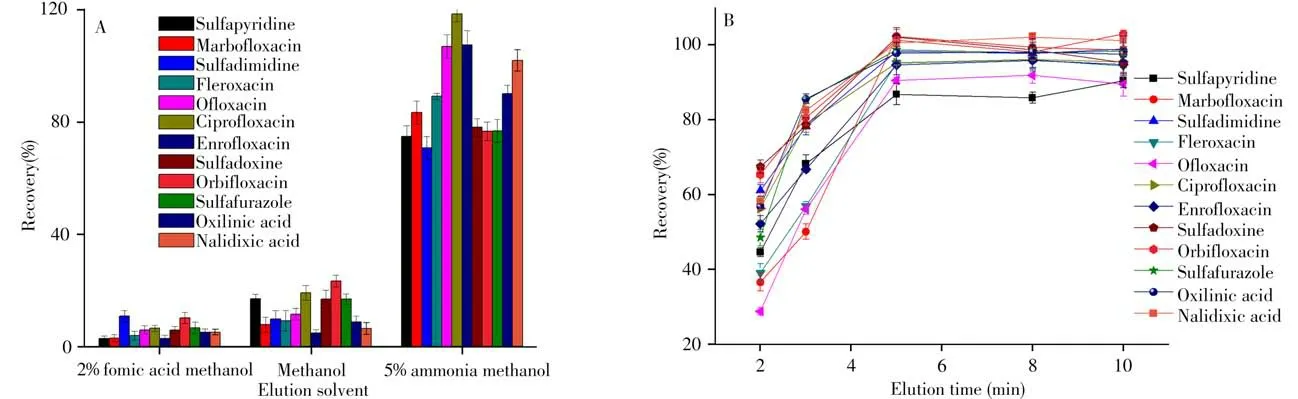
图6 洗脱剂种类(A)与洗脱时间(B)对12种抗生素萃取效率的影响Fig.6 Effect of the type of elution solvent(A)and the elution time(B)on the extraction efficiencies of 12 antibiotics
2.3 方法验证
配制系列质量浓度(0.5、1、2、5、10 μg/L)的12 种抗生素混合标准溶液,在最优条件下进行MSPE/HPLC-MS/MS 分析,采用外标法进行定量。以12 种目标物的质量浓度为横坐标(x,μg/L),以对应的色谱峰面积为纵坐标(y),进行线性回归分析得到线性方程。结果表明,12 种抗生素在0.5~10 μg/L 范围内呈良好的线性关系,相关系数(r2)为0.996 1~0.999 8。分别以3 倍和10 倍信噪比(S/N)确定检出限(LOD)和定量下限(LOQ),得到12 种抗生素的LOD 和LOQ 分别为0.01~0.14 μg/L 和0.04~0.45 μg/L(见表2)。以1 μg/L空白加标样品进行3次重复测定,以所得相对标准偏差(RSD)为日内精密度,以连续测定3 d所得的RSD为日间精密度。如表2所示,12种抗生素的日内RSD为0.90%~5.2%,日间RSD为3.9%~10%,表明方法具有良好的精密度。

表2 方法的线性关系、检出限、定量下限及相对标准偏差Table 2 Linear relations,LODs,LOQs and RSDs of the developed method
2.4 实际样品测定
采集杭州市3 类(饮用水、西溪湿地水和西湖水)9 个点位的水样采用本方法进行测定,结果表明,所采集的3 种水样均未检出12 种抗生素。对空白样品进行3 个水平(1、5、8 μg/L)的加标回收实验,每个水平测定3 次,平均加标回收率和RSD 见表3。加标回收率为75.0%~107%,RSD 为0.50%~5.5%,说明所建立方法具有良好的精密度和准确度,适用于实际环境水样中12种抗生素的检测。
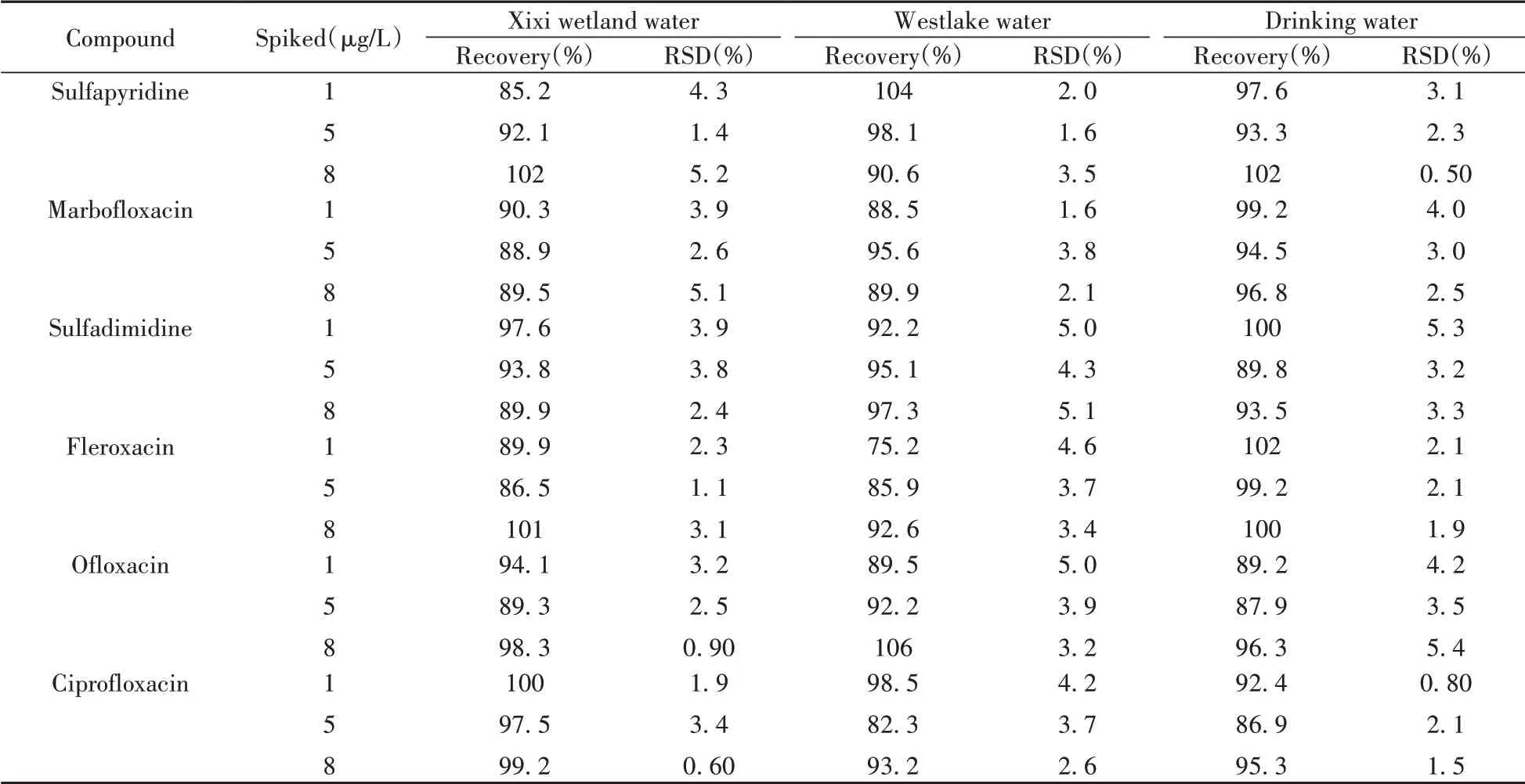
表3 实际样品中12种抗生素的加标回收率Table 3 Recoveries of 12 antibiotics residues in real samples

(续表3)
3 结 论
本研究制备了具有良好性能的Fe3O4@SiO2@PLS 和Fe3O4@ZIF-8 磁性材料,2 种磁性材料共同作为吸附剂时,兼具大孔有机共聚物和金属有机骨架的吸附优势。对影响MSPE 萃取效率的主要因素进行了优化,建立了混合模式MSPE/HPLC-MS/MS测定水中12种抗生素残留的分析方法。与其他应用于抗生素的MSPE 方法相比,具有简便快速、有机溶剂用量少和样品不易损失等优点。本文的磁性吸附剂制备方法简便,分析方法适用性高,通过调节2 种磁性吸附剂的组合用量,实现了水中8 种喹诺酮和4种磺胺类抗生素的检测。
