地塞米松促胎肺成熟对妊娠期糖尿病患者血糖及妊娠结局的影响研究
2022-03-02施益金顾锦华陈万杰
朱 昭,施益金,顾锦华,陈万杰*
(1 南通大学医疗卫生服务中心,南通 226019;2 南通大学附属妇幼保健院,江苏省南通市儿童医院药学部)
全球孕期妇女妊娠期糖尿病(gestational diabetes mellitus,GDM)的患病率约7.5%。GDM 孕妇血糖控制不良可增加自然流产和先天性畸形的发生;孕期高血糖可显著增加巨大儿的风险,促进胎儿多尿而导致羊水过多;GDM 还与妊娠期高血压的风险增加相关[1]。孕期合并GDM 出生的新生儿可出现低血糖、低血钙、高胆红素血症及呼吸窘迫等并发症[2]。GDM母亲的新生儿发生呼吸窘迫综合征(respiratory distress syndrome,RDS) 的主要原因是孕妇更易发生早产,以及母体高血糖延缓了新生儿肺表面活性物质的生成[3];GDM 孕妇即使足月分娩,其胎儿仍有胎肺发育不全的风险[4]。研究[5]表明,地塞米松经胎盘酶11β-羟类固醇脱氢酶2 代谢较少,能有效进入胎儿体内发挥促胎肺成熟作用,降低早产儿RDS、坏死性小肠结肠炎等疾病的发生。然而,地塞米松可诱导一过性的血糖升高,对于GDM 患者影响可能更为严重,从而降低其促胎肺成熟的效果;单个疗程的糖皮质激素治疗还可增加新生儿感染、低血糖等不良结局的风险[5]。因此美国母胎医学会等不推荐有糖尿病的女性在晚期早产(34+0~36+6周)前给予糖皮质激素改善胎儿结局[6]。目前,国内主要使用地塞米松[7],然而,对地塞米松给药期间血糖升高、持续的时间,升高幅度等变化规律鲜有报道;胰岛素治疗如何调整亦缺乏指南性指导意见。因此,本研究通过分析早产合并GDM 的孕妇使用地塞米松期间血糖的变化规律和胰岛素的用量变化,以及地塞米松对患者和新生儿的影响,从而为临床在GDM 患者使用地塞米松期间更合理的监测和管理血糖,减少母胎不良妊娠风险提供参考。
1 对象与方法
1.1 研究对象 收集2020 年1—12 月在南通大学附属妇幼保健院因先兆早产收治入院的GDM 孕妇共99 例,GDM 的诊断依据《中国2 型糖尿病防治指南(2017)》[8];先兆早产的诊断标准依据《早产的临床诊断与治疗指南(2014)》[9]。其中产前未注射地塞米松孕妇57 例(对照组),注射地塞米松42 例(观察组)。排除标准:孕前已有糖尿病;正在使用降糖药(胰岛素除外)或影响血糖的药物(噻嗪类利尿药、β 受体阻滞剂、安眠药等);有严重脏器系统疾病;有严重影响胎儿发育的其他合并症,如子痫前期、胎儿畸形的孕妇。剔除临床数据录入不完整的病例,如血糖值、胰岛素剂量等。
1.2 研究方法 观察组均予肌注地塞米松5 mg,1 次/12 h,共4 次,首次注射时间为8:00。收集所有孕妇的孕周、年龄、孕次、体质量、身高、住院时长;地塞米松给药时间和剂量;胰岛素给药时间和剂量。记录两组血糖:餐前血糖检测时间为6:00、11:00、17:00;餐后血糖检测时间为8:00、13:00、19:00,夜间血糖检测时间为20:00。观察组从地塞米松首次注射当日开始连续记录3 d;对照组从入院当日开始连续记录3 d。妊娠结局随访指标:剖宫产率、早产率,新生儿低血糖、巨大儿、高胆红素血症、新生儿窒息发生率,出生Apgar 评分。新生儿低血糖的诊断标准为血糖≤2.2 mmol/L;新生儿窒息诊断标准为Apgar 评分<8 分;新生儿高胆红素血症诊断依据病案记录为准。本研究经南通大学附属妇幼保健院伦理委员会审批(伦理号:Y2020086)。
1.3 统计学方法 采用SPSS 25.0 软件处理数据,计量资料符合正态性和方差齐性,组间比较采用t 检验,以表示;计数资料组间比较采用χ2检验及Fisher 精确检验,用频数和百分比(%)表示,P<0.05 为差异有统计学意义。
2 结果
2.1 一般情况 两组的孕妇年龄、体质量指数、孕周、孕次、住院时长比较差异均无统计学意义(均P>0.05),见表1。
表1 两组孕妇一般情况比较()
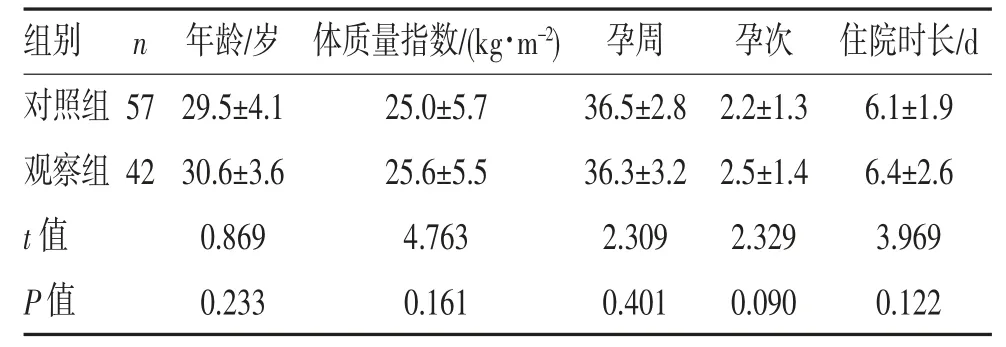
表1 两组孕妇一般情况比较()
2.2 两组孕妇血糖情况
2.2.1 餐前血糖变化 地塞米松注射前,空腹血糖(D1 早)差异无统计学意义(P>0.05),从地塞米松给药后第1 天午餐前至第3 天早餐前,观察组餐前血糖明显高于对照组(P<0.05);至第3 天午餐前,两组血糖差异无统计学意义(P>0.05),见表2。结果提示在使用地塞米松约3 h 后,孕妇餐前血糖水平出现明显升高,且对餐前血糖的影响持续至最后一次给药后约15 h。
表2 两组孕妇餐前血糖浓度比较(,mmol/L)

表2 两组孕妇餐前血糖浓度比较(,mmol/L)
2.2.2 餐后及夜间血糖变化 首次注射时,两组孕妇餐后血糖水平(D1 早)差异无统计学意义(P>0.05),给药后第1 天午餐后至第2 天晚餐后和夜间,观察组的血糖明显高于对照组(P<0.05);至第3 天早餐及午餐后,两组血糖差异无统计学意义(P>0.05),见表3。提示在使用地塞米松约5 h 后,孕妇餐后血糖水平出现明显升高,且对餐后血糖的影响持续至最后一次给药后约12 h。
表3 两组孕妇餐后血糖浓度比较(,mmol/L)
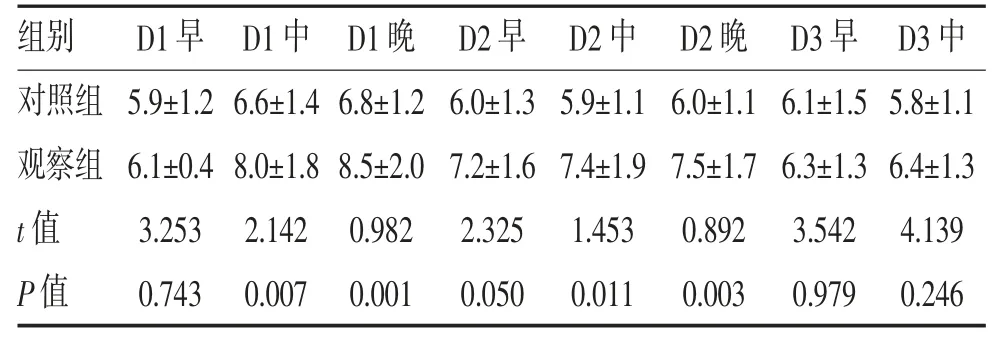
表3 两组孕妇餐后血糖浓度比较(,mmol/L)
2.3 两组孕妇妊娠结局比较 结果显示,对照组新生儿Apgar 评分高于观察组(P<0.05)。两组剖宫产、早产、新生儿低血糖、高胆红素血症、巨大儿、窒息等发生率差异均无统计学意义(均P>0.05),见表4。
表4 两组孕妇妊娠结局比较(%,)
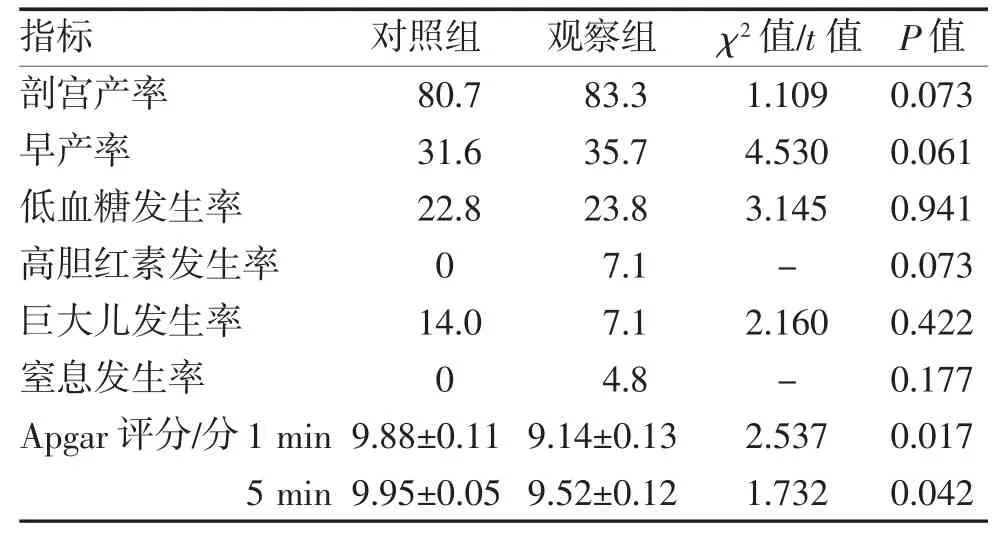
表4 两组孕妇妊娠结局比较(%,)
2.4 胰岛素注射剂量变化 记录观察组中抽取需胰岛素治疗的GDM 孕妇10 例使用地塞米松前后胰岛素的用量。观察组地塞米松给药前胰岛素用量为(24.00±2.14) U,肌注地塞米松期间(D1~D2)分别为(28.63±1.36)、(26.40±2.02) U,停药后第1 天(D3)为(25.94±0.98) U,提示D1~D3 为控制血糖所需胰岛素的用量较注射前均有所提高,但胰岛素所需增加的用量幅度逐渐降低。
3 讨论
3.1 地塞米松使用后血糖的变化规律
3.1.1 血糖变化幅度 地塞米松升高血糖的可能机制:通过促进肝糖原异生,增加糖原贮存,抑制外周组织对葡萄糖的利用[10]。此外,抑制胰岛素与其受体结合,损害外周组织受体对葡萄糖的转运作用;其损害作用具有剂量和时间依赖性,长期大剂量使用可损害胰岛素相关功能,引起血糖升高[11]。地塞米松促胎肺成熟治疗疗程仅2 d,但仍会对孕妇血糖产生一定影响。本研究显示,地塞米松治疗期间GDM 孕妇空腹血糖较注射前平均升高约2.3 mmol/L,餐后血糖平均升高约1.6 mmol/L。国内研究[12]发现,地塞米松肌注后的孕妇空腹血糖峰值较注射前升高1.55 mmol/L,餐后血糖峰值升高2.46 mmol/L。GDM 孕妇常伴有糖耐量受损,至妊娠中晚期胰岛素抵抗明显增加;产前注射地塞米松可加剧胰岛素抵抗,导致胰岛β 细胞分泌胰岛素量不足而使血糖明显升高。对于糖耐量正常的孕妇,因胰岛β 细胞功能正常,能在一定范围内增加胰岛素分泌量,从而代偿地塞米松的拮抗作用[13]。因此,相对于正常孕妇,合并GDM 的孕妇使用地塞米松期间血糖升高的幅度更大,控制难度加大,临床管理应提高警惕,防止酮症酸中毒等并发症的发生。
3.1.2 血糖升高的时间 地塞米松的蛋白结合率较低,药效较强,且作用持久。其血浆半衰期约190 min,组织半衰期为3 d,肌注1 h 后达到血药峰值[14]。国内学者[15]的对照试验发现,注射地塞米松后2 h 不会对孕妇的血糖产生明显影响,注射3 h 后血糖开始明显升高。本研究发现,地塞米松注射3 h 后空腹血糖出现明显升高,提示地塞米松升高血糖的效应滞后于血药的达峰时间。对于合并GDM 的患者,应在地塞米松给药后及时监测血糖变化,减少意外发生。
3.1.3 地塞米松治疗后血糖恢复的时间 本研究发现,地塞米松升高血糖的影响可持续到给药后的第3天。餐前血糖的影响至末次给药后15 h 才恢复正常,餐后血糖的影响则持续至结束用药后12 h。闫芳等[12]研究显示,地塞米松肌注后60 h,体内血糖基本恢复至给药前水平,由此推测其对血糖的影响持续约3 d,这与地塞米松的组织半衰期基本一致。研究[16]显示,肌内注射地塞米松在治疗第2 天空腹血糖仍高于治疗前,而羊膜腔注射组的空腹血糖则基本恢复,认为羊膜腔注射给药的剂量小,给药次数少,可减少糖皮质激素对血糖影响的幅度和持续时间。然而,这种给药方式为侵入性操作,可能会增加医源性早产和感染的风险。对于产前血糖控制欠佳的GDM 孕妇,必要时采取羊膜腔注射可能更利于血糖控制。
3.2 地塞米松对妊娠结局的影响 GDM 母亲血糖控制不良,母胎均保持高胰岛素状态,胎儿断脐后会因高胰岛素水平而使低血糖的发生率明显升高[17]。血糖的升高也会导致新生儿体内红细胞数量增加,从而使红细胞被破坏后的胆红素含量增加,引起高胆红素血症。胎儿体内高含量的胰岛素通过分解糖类将其转化为脂肪和蛋白质,使得新生儿的体质量增加,从而增加发生巨大儿的风险。由此可见,母亲的血糖水平极大程度影响着胎儿的出生健康。由于地塞米松对孕妇血糖有升高作用,可能增加GDM 母亲的新生儿发生相关并发症的风险。然而,本研究中观察组早产、低血糖、高胆红素血症、巨大儿发生率均未见增加,仅对出生Apgar 评分有轻微影响。国内相关研究[15-16]也显示,地塞米松促胎肺成熟治疗未明显增加新生儿相关并发症,推测其原因可能与地塞米松疗程相对有限有关。Cochrane 系统评价[5]显示,产前糖皮质激素的使用未增加胎膜早破、绒毛膜羊膜炎、高血压和死亡发生的风险。产前使用地塞米松可影响下丘脑-垂体-肾上腺皮质轴通路,诱发子代胰岛素抵抗和代谢紊乱,可能导致心脑血管疾病的发生;但目前的研究未发现糖皮质激素促胎肺成熟治疗是子代心血管疾病的危险因素。有研究[18]显示糖皮质激素治疗对子代大脑发育和认知功能产生有益作用。GDM 虽然不是产前糖皮质激素治疗的禁忌证,但用药前应充分评估母胎情况,权衡利弊,以减少药物治疗对母胎的有害影响。
3.3 地塞米松治疗期间的血糖管理
3.3.1 血糖监测 地塞米松等糖皮质激素升高血糖的作用已得到充分证明,对于这种临床挑战,目前没有简单统一的解决方案。由于其升高血糖的程度和持续时间在个体间差异很大,因此必须进行个体化血糖监测和管理。对于使用地塞米松的孕妇应采取更积极的糖尿病筛查,在给药前对血糖水平进行充分评估。用药期间血糖监测的频率和要求往往因糖尿病的类型产生变化,对血糖监测需求由高到低分别为1 型糖尿病、2 型糖尿病、胰岛素治疗中的GDM和无需药物治疗的GDM。对于GDM 使用地塞米松期间的血糖监测方法与GDM 的常规管理一致,建议对三餐前后和夜间的七段血糖进行监测[19]。对于特定患者,可考虑进行尿酮体和连续血糖监测。
3.3.2 胰岛素的使用 积极的胰岛素剂量调整有助于控制地塞米松治疗后的血糖波动,避免对母亲和胎儿产生有害影响。NICE 相关指南[20]建议,接受糖皮质激素促胎肺成熟治疗的糖尿病孕妇应额外补充胰岛素。印度国家糖尿病管理指南[21]建议,应用糖皮质激素的孕妇可增加20%的胰岛素用量。M.A.RAMÍREZ-TORRES 等[22]研究发现,之前已经接受胰岛素治疗的GDM 孕妇在注射糖皮质激素期间胰岛素的每日用量需增加39%~112%。日本一项研究[23]使用胰岛素连续滴定以控制血糖,结果显示,首次注射倍他米松后,胰岛素用量逐渐升高,并在10 h 后达到峰值;第2 次给药后胰岛素的需求量与第1 次大致相同,但幅度略低于第1 次,于给药后9 h 达到峰值。本研究显示,地塞米松治疗第1 天胰岛素用量增加了4%~73%,第2 天增加了23%~58%,第3 天停止用药,胰岛素用量增加了16%~65%。由此可见,地塞米松治疗期间需要额外补充的胰岛素用量呈逐渐减少的趋势,考虑个体差异的影响,需根据血糖监测情况及时调整胰岛素剂量,防止血糖剧烈波动影响母胎健康。
