囊胚形态与整倍体率及单整倍体囊胚移植妊娠结局的关系
2022-02-26师赞孙婷刘茜桐师娟子柏海燕
师赞,孙婷,刘茜桐,师娟子,柏海燕
(西北妇女儿童医院生殖中心,西安 710003)
如何选择发育潜能更高的单胚胎移植是辅助生殖技术(ART)中最主要的挑战之一[1]。形态学评分是目前应用最广泛的胚胎质量评估方法,但由于存在观察者的主观误差,导致该方法并不十分准确全面[2]。即使使用形态学达标的单囊胚移植,妊娠率也仅有42.6%~65.4%[3-4]。非整倍体现象普遍存在于体外受精胚胎中,这是导致妊娠失败的主要遗传因素,临床表现为胚胎植入失败或流产,降低了辅助生殖效率,增加了医疗资源浪费及患者经济压力[5]。胚胎植入前非整倍体检测技术(PGT-A)是在卵胞浆内单精子注射(ICSI)的基础上,对经形态学选择的囊胚进行滋养外胚层细胞活检,筛选出整倍体囊胚进行移植,有效缩短了至活产时间,提高了ART效率[6]。本研究通过探讨胚胎形态学分级与染色体倍性之间的关系,及胚胎形态学分级在预测单整倍体囊胚移植后妊娠结局中的价值,以期为移植时的胚胎选择提供依据。
资料与方法
一、研究对象与分组
回顾性分析2016年9月至2019年4月于西北妇女儿童医院生殖中心完成囊胚期滋养外胚层细胞活检的PGT-A周期的临床资料,活产数据随访至2021年3月。活检囊胚采用Gardner囊胚分级法,对于扩张度3期以上且内细胞团及滋养层细胞评分均≥C级的囊胚进行滋养外胚层细胞活检。根据囊胚活检时Gardner形态学评分分为2组,优质囊胚组:扩张度3期以上且内细胞团及滋养外胚层细胞评分均≥B级,共纳入囊胚394枚;非优质囊胚组:达活检标准的非优质囊胚,共纳入囊胚1 191枚。本研究经西北妇女儿童医院生殖医学伦理委员会批准(审批编号:2021002)。
纳入标准:入组夫妇均符合PGT-A指征[7]:(1)夫妻一方染色体异常(平衡易位或罗氏异位、Y染色体微缺失等);(2)不明原因反复妊娠丢失(RPL);(3)不明原因反复种植失败(RIF);(4)既往曾有染色体非整倍体胚胎流产或染色体非整倍体胎儿出生;(5)女方高龄(≥38岁)。
排除标准:(1)因细胞量不足或扩增失败导致无法检测或检测失败的胚胎;(2)夫妻一方患有单基因病;(3)女方卵巢储备功能明显下降;(4)女方合并严重基础疾病无法耐受妊娠等。
二、研究方法
1.体外受精、胚胎培养:所有患者均采用常规卵巢刺激方案,成熟卵母细胞行ICSI授精,ICSI后16~18 h评估受精结果。出现2个原核(2PN)的受精卵为正常受精胚胎,对D3可用胚胎继续序贯培养至囊胚期。囊胚评分采用Gardner囊胚分级法[8]:扩张度3期以上、内细胞团或滋养层细胞评分均≥C级的囊胚为可活检囊胚。
2.胚胎活检及PGT-A检测:(1)囊胚进行滋养外胚层细胞活检。在3点处远离内细胞团处激光打孔,使用活检针从透明带开口处负压抽吸5~10个细胞送检,将活检后的囊胚进行玻璃化冷冻保存;(2)采集滋养层细胞后,应用全基因组扩增技术(whole genome amplification,WGA),通过对扩增产物进行高通量测序,可得到碱基序列读段(reads),通过与人类基因组参考序列对比,从而判断染色体正常、重复与缺失。对4 Mb及以上拷贝数变异囊胚判定为非整倍体胚胎。根据检测结果,整倍体囊胚判定为可用胚胎,择期进行单囊胚解冻移植。非整倍体及高比例嵌合囊胚判定为不可用胚胎。
3.解冻移植及随访:人工周期准备内膜,待内膜厚度超过8 mm后,给予黄体酮转化内膜,当黄体酮补充至第6天时复苏冷冻胚胎进行移植。移植低比例嵌合胚胎须跟患者沟通,充分知情同意并告知可能存在的风险,患者夫妻书面同意后方可进行。移植后继续黄体支持,第12天检测血人绒毛膜促性腺激素(β-HCG)判断是否妊娠,移植后28~35 d行超声检查明确临床妊娠情况。所有妊娠病例均随访至子代出生。
4.结局指标:(1)主要研究指标:整倍体率=整倍体囊胚数/活检囊胚数×100%;临床妊娠率=临床妊娠周期数/总移植周期数×100%;活产率=活产周期数/总移植周期数×100%。(2)次要研究指标:非整倍体囊胚率=非整倍体囊胚数/活检囊胚数×100%;质控不合格率=质控不合格囊胚数/活检囊胚数×100%;嵌合体囊胚率=嵌合体囊胚数/活检囊胚数×100%;HCG阳性率=HCG阳性周期数/总移植周期数×100%;自然流产率=流产周期数/总移植周期数×100%。
三、统计学分析

结 果
一、患者基线资料及活检囊胚情况
PGT-A共完成380个周期,共活检囊胚1 585枚,其中优质囊胚394枚(优质囊胚组),非优质囊胚1 191枚(非优质囊胚组),两组PGT-A具体指征见表1。两组间女方年龄、女方体质量指数(BMI)、获卵数、Gn天数、基础FSH(bFSH)均无统计学差异(P>0.05)(表2)。
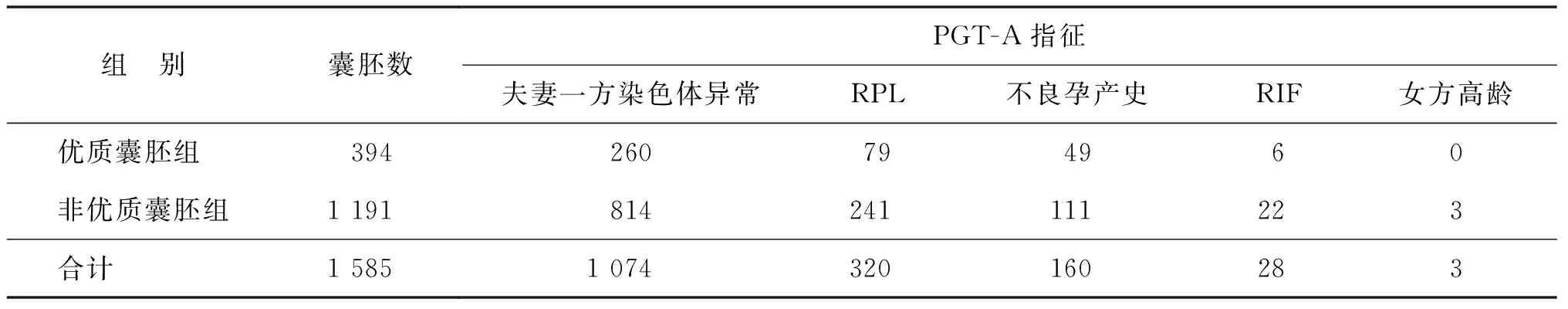
表1 PGT-A指征及活检囊胚数(n)
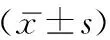
表2 两组患者基线资料比较
二、囊胚形态学评分与PGT-A检测结果的关系
PGT-A检测结果分为整倍体、非整倍体、嵌合体(30%≤染色体数目异常细胞占活检细胞比例≤80%)及质控不合格(N/A)。优质囊胚组的整倍体率显著高于非优质囊胚组,非整倍体率、嵌合体率、质控不合格率显著低于非优质囊胚组(P<0.05)(表3)。

表3 两组间囊胚活检及PGT-A结果分析(%)
三、囊胚形态学评分与单整倍体囊胚移植妊娠结局的关系
经PGT-A检测出的整倍体囊胚共622枚,择期进行单整倍体囊胚移植共329个周期,其中优质囊胚组移植119个周期,非优质囊胚组移植210个周期,活产情况随访至2021年3月。比较两组间的妊娠结局,优质囊胚组的HCG阳性率、临床妊娠率及活产率略高于非优质囊胚组,流产率略低于非优质囊胚组,但两组间差异尚无统计学意义(P>0.05)(表4)。
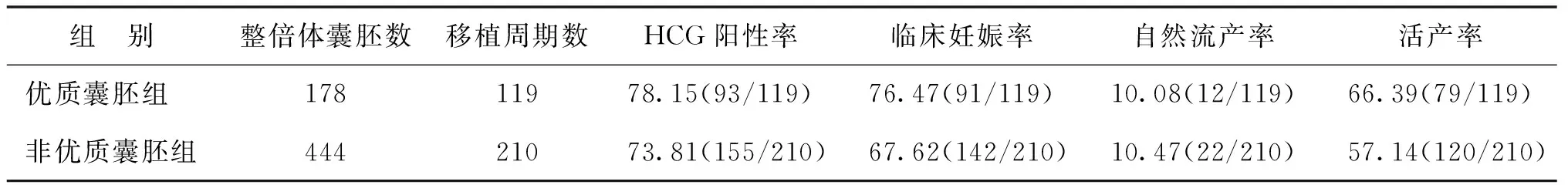
表4 两组整倍体囊胚移植的妊娠结局比较(%)
讨 论
体外受精-胚胎移植(IVF-ET)是治疗不孕症的有效方法,成功妊娠是IVF的主要目标。胚胎倍性是预测种植和妊娠能否成功的重要因素,因此筛选出具有发育潜能的整倍体胚胎进行移植尤为重要[9]。目前大部分辅助生殖中心尝试通过更有效的形态学评分方法挑选出更优质的胚胎来提高妊娠率,包括制定严格的胚胎评分流程[8,10]、借助动态实时成像系统(time-lapse imaging)等[11],但妊娠率仍不尽满意,徘徊在40%~60%之间,其主要原因在于无论是静态或动态形态学评估方法都无法确定胚胎的整倍体性[11-12]。染色体异常对胚胎常具有致死性效应,PGT-A采用基于高通量二代测序方法,可进一步提高囊胚整倍体性评估的灵敏度和分辨率,从而改善妊娠结局[6]。但PGT-A有严格的临床应用指征[7],且因技术要求高,国家仅批准少数生殖中心开展,故大部分生殖中心的多数IVF周期只能根据形态学评分筛选胚胎。因此,总结PGT-A相关数据,探讨胚胎形态学与染色体倍性之间的关系,对于胚胎选择具有重要参考意义。
目前囊胚形态学评分多采用Gardner系统,分别对囊胚扩张程度、内细胞团及滋养外胚层进行综合评价,将囊胚分为高、一般及低质量等级[8]。囊胚形态学评分与整倍体检测结果具有相关性,评分更高的囊胚整倍体率更高[13],这一相关性解释了优质囊胚具有更高的种植潜能的原因,也提供了临床实践中优先移植优质囊胚的依据。但过分倚重形态学评分往往诱导患者轻视非优质囊胚的价值,尤其当没有优质囊胚或优质囊胚移植失败、仅剩余非优质囊胚时,患者往往对移植结局没有信心,甚至要求废弃剩余囊胚重新取卵。本研究结果表明,非优质囊胚中仍有37.28%为整倍体囊胚。进一步对非优质整倍体囊胚的妊娠结局进行追踪,并与优质囊胚的妊娠结局进行比较,结果发现解冻移植后仍有67.62%获得了临床妊娠,其HCG阳性率、临床妊娠率、自然流产率及活产率与优质整倍体囊胚组相比均无显著性差异(P>0.05)。这也进一步证明胚胎发育潜能主要与染色体倍性相关[5]。胚胎具有自我纠正的能力,其可能机制包括染色体异常的卵裂球凋亡、染色体异常细胞定向发育,以及非整倍体细胞自我纠正等[14]。2014年Fragouli等[15]的研究结果表明,在胚胎卵裂阶段胚胎的倍性与其形态学无关,但良好形态评分的囊胚和更快进入囊胚阶段的胚胎整倍体率更高。因此,继续培养可将存在潜在遗传异常的胚胎淘汰,通过囊胚的形成进一步选择有发育潜能的胚胎。
囊胚的非整倍体性广泛存在,本研究中优质囊胚的整倍体率仅45.18%,而非优质囊胚的整倍体率也有37.28%。非优质囊胚组的非整倍体率及嵌合体率更高(P<0.05),意味着非优质囊胚的临床移植具有更高的生殖风险,因此非优质囊胚更需要进行PGT-A来避免不良妊娠结局的发生。2019年Cimadomo等[16]经研究认为非优质囊胚进行囊胚活检及PGT-A检测更具临床价值及可操作性。因此在临床操作中不能矫枉过正,放弃非优质囊胚的活检机会或移植机会。继续培养过程本身是对胚胎发育潜能的一种选择,形态学可用囊胚已经经历了优胜劣汰,故应谨慎对待非优质囊胚,尤其对于高龄女性,获得优质胚胎的可能性下降,因此经历过继续培养后获得的可用囊胚更显珍贵,同样具有应用价值。
本研究中所有移植周期均为单整倍体囊胚移植,妊娠结局显示优质囊胚组妊娠结局倾向于更优,但差异无统计学意义(P>0.05)。整倍体囊胚的形态学评分并不影响其妊娠结局,并且即使是非优质囊胚中的整倍体胚胎,活产率仍达57.14%。因此对于整倍体囊胚,移植时无需过于关注其囊胚分级,更无需因整倍体囊胚的评分较差而放弃移植[17-18]。
综上所述,形态学评分为优质的囊胚更倾向为整倍体囊胚,但是囊胚的形态学评分并不影响整倍体囊胚的妊娠结局。对于整倍体囊胚而言,囊胚形态可能不是需要考虑的关键因素。
