CO2相变爆炸激发药剂热化学安定性研究
2022-02-23杜明燃王任松王尹军杨海斌李继红胡赏赏
杜明燃,王任松,王尹军,杨海斌,李继红,曹 稳,胡赏赏
(1.安徽理工大学化学工程学院,安徽 淮南 232000;2.宏大爆破工程集团有限责任公司,广州 510623;3.矿冶科技集团有限公司,北京100160;4.中国矿业大学(北京)力学与建筑工程学院,北京 100083;5.河北云山化工集团有限公司,河北 邢台 054011)
二氧化碳相变爆炸技术最初起源于英、美等国[1-2],其作用原理是通过瞬间加热使液态CO2转变为超临界状态,整体转化成高压气体,快速膨胀对外做功完成爆破作业过程[3]。在二氧化碳相变爆炸中提供热量的激发药剂的热化学安定性与该技术的可靠性与安全性关系很大。使用最多的激发药剂主要成分为高氯酸钾(KP)、草酸铵(C2H8N2O4)、水杨酸(C7H6O3),其中KP为氧化剂[4],其占比和热分解特性影响着激发药剂整体安全性。近年来,国内出现了多起二氧化碳爆破事故,其中部分事故与激发药剂直接相关[5],因此对其热化学安定性进行深入研究,具有重要的现实意义。
徐敏潇等[6]对高氯酸钾、草酸铵、水杨酸配方的发热管药剂性质开展研究,结果表明该药剂可以定性为爆炸性物质,但是足够钝感,可不划分为爆炸品。夏军等[7]对装配式激发管某比例药剂进行了燃烧和激发试验,结果表明该药剂在露天环境下很难用明火点燃;黄鲁湘等[8]对二氧化碳爆破激发管药剂进行了抗爆性能试验,结果表明导爆管雷管和乳化炸药均不能将其引爆;王国强等[9]研究了高氯酸钾复合推进剂的耐温性能,结果表明在180 ℃下保温48 h各项性能变化很小,可以用于深层油气井压裂弹;谭惠平等[10]研究发现钴氧化物、铜氧化物和铁氧化物对KP的热分解反应均有催化作用;郭超等[11]计算了激发药剂的爆轰参数;杨海斌等[12]研究认为激发药剂中草酸铵对药剂燃烧具有抑制作用。但是,目前关于激发药剂热化学安定性研究几乎是一个空白。
本文利用TG、ARC测试技术和耐温试验等方法,研究了高氯酸钾(KP)、草酸铵(C2H8N2O4)、水杨酸(C7H6O3)混合而成的激发药剂的热分解特性和耐温性,用Ozawa[13]法对所得热力学数据进行理论计算,并参考经验公式计算了该激发药剂的长期使用温度,研究结果可为二氧化碳相变爆炸激发药剂的配方设计、研发、生产、使用和储存等,提供试验依据和指导。
1 实验
1.1 试验样品
试验所用激发药剂由河北云山化工集团提供,主要组分为工业级的高氯酸钾、草酸铵(GR:99.9 %)、水杨酸(GR:99.9 %)。
1.2 测试仪器及条件
热重法测试仪:梅特勒托利多TGA2,英国THT公司,试样质量为3 mg左右,升温速率α分别为1、2.5、5 ℃/min,升温区间为室温到800 ℃,样品容器为氧化铝敞开式坩埚,带盖,非密闭状态,氮气气氛。
绝热加速量热仪:ESARC,英国THT公司,试样质量为200 mg左右,升温区间为室温到500 ℃,样品容器为口径1/4 in的厚壁钛合金小球(Ti-LCQ),密闭状态。
干燥箱:DHGXIX系列鼓风干燥箱,试样质量20 g左右,升温区间为室温到80 ℃和室温到200 ℃,样品容器为石英皿。
2 测试结果与分析
2.1 TG测试结果与分析
在低速升温条件下,物质在低温段反应时间较长,能够将各阶段分解峰更好地分开,因此,本文分别采用1、2.5、5 ℃/min升温速率进行测试。测得的激发药剂TG曲线如图1 a所示,DTG曲线如图1c所示。为进行对比分析,在相同试验条件下,测试了KP在升温速率分别为1、2.5、5℃/min条件下的热分解曲线,如图1 b所示。

由图1 a可知,激发药剂在3个升温速率下的热分解趋势基本一致,每个阶段的热失重有较明显的区分度,而图1 b则表明,KP在3个升温速率下的热分解过程几乎完全重合,整个过程的热失重差别不明显。
图1 a中各拐点对应的温度如表1所示,各拐点之间的温度差如表2所示,并根据各拐点将激发药剂热分解过程划分为4个阶段,各阶段对应的失重率和总失重率如表3所示。
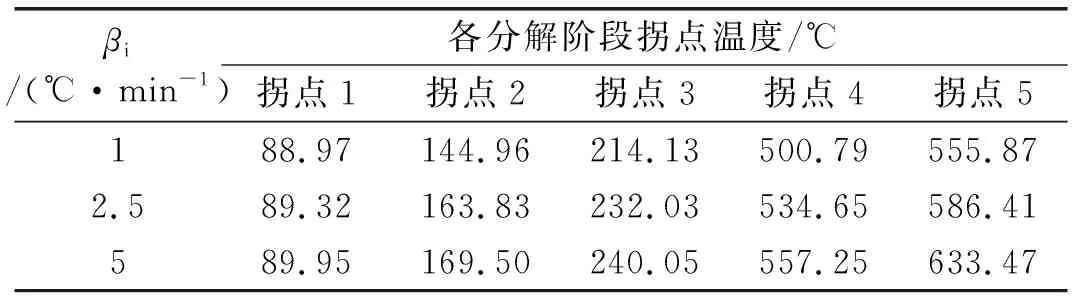
表1 不同升温速率下各分解阶段拐点温度

表2 不同升温速率下各拐点间温度差
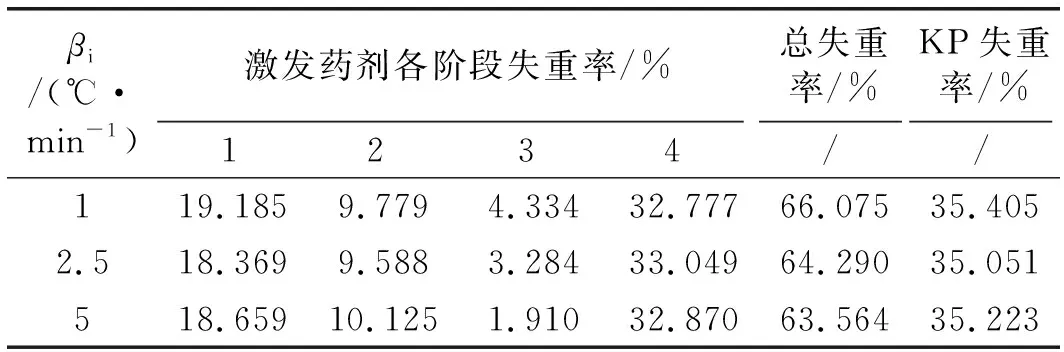
表3 不同升温速率下KP和激发药剂各阶段失重率
激发药剂热分解过程的4个阶段分别如下:
第1阶段在90~170 ℃左右区间,TG曲线先缓慢平稳下降后迅速下降,质量损失约19 %,对应图1 c中DTG曲线有一个较平缓的峰和一个较陡峭峰。根据水杨酸76 ℃开始升华和草酸铵95 ℃脱水的物理性质推断,这一阶段热失重应该为部分水杨酸升华、激发药剂所含的水分缓慢损失和草酸铵晶体受热失去结晶水的过程。
第2阶段为170~240 ℃左右区间,质量损失约10 %,TG曲线下降趋势变缓,对应于图1 c中DTG曲线的较平缓峰。根据草酸铵受热分解为草酸和NH3,草酸在150~160 ℃升华,以及草酸分解生成H2O和CO2的特性,这一阶段应该为草酸铵完全分解的过程[14]。
第3阶段为240~557 ℃左右区间,质量损失约为3 %,该阶段的特点是温差很大而失重很小,TG曲线下降趋势更加缓慢,几近水平,对应于图1 c中DTG曲线上的峰面非常平缓,说明在该阶段易于升华和分解的水杨酸与草酸铵均已流失殆尽。根据高氯酸钾的DSC晶型变化吸热峰温度300 ℃推断[10],这一阶段应为高氯酸钾晶型转变过程,即由斜方晶型转变为立方晶型[15],该过程无质量变化。之所以有3 %的质量损失应该是第2阶段中未分解完全的水杨酸与草酸铵继续分解之后的质量损失所致。
第4阶段为557~633 ℃左右区间,质量损失约33 %,该阶段的TG曲线迅速下降,对应于图1 c中DTG曲线上的尖锐峰,这一阶段为在高温作用下高氯酸钾完全分解,与图1b高氯酸钾分解温度基本一致。
由以上分析可以看出,随着温度升高,激发药剂先损失水分等易挥发组分,接着水杨酸升华和草酸铵分解,然后高氯酸钾发生晶型转变,最后高氯酸钾完全分解。由此可见,在非密闭条件下,激发药剂的热化学安定性主要体现为各组分的热稳定性,各组分之间未发生氧化还原反应。
2.2 ARC的测试结果与分析
采用ARC技术,在升温速率5 ℃/min和密闭条件下,测试激发药剂的热分解过程,结果如图2所示。
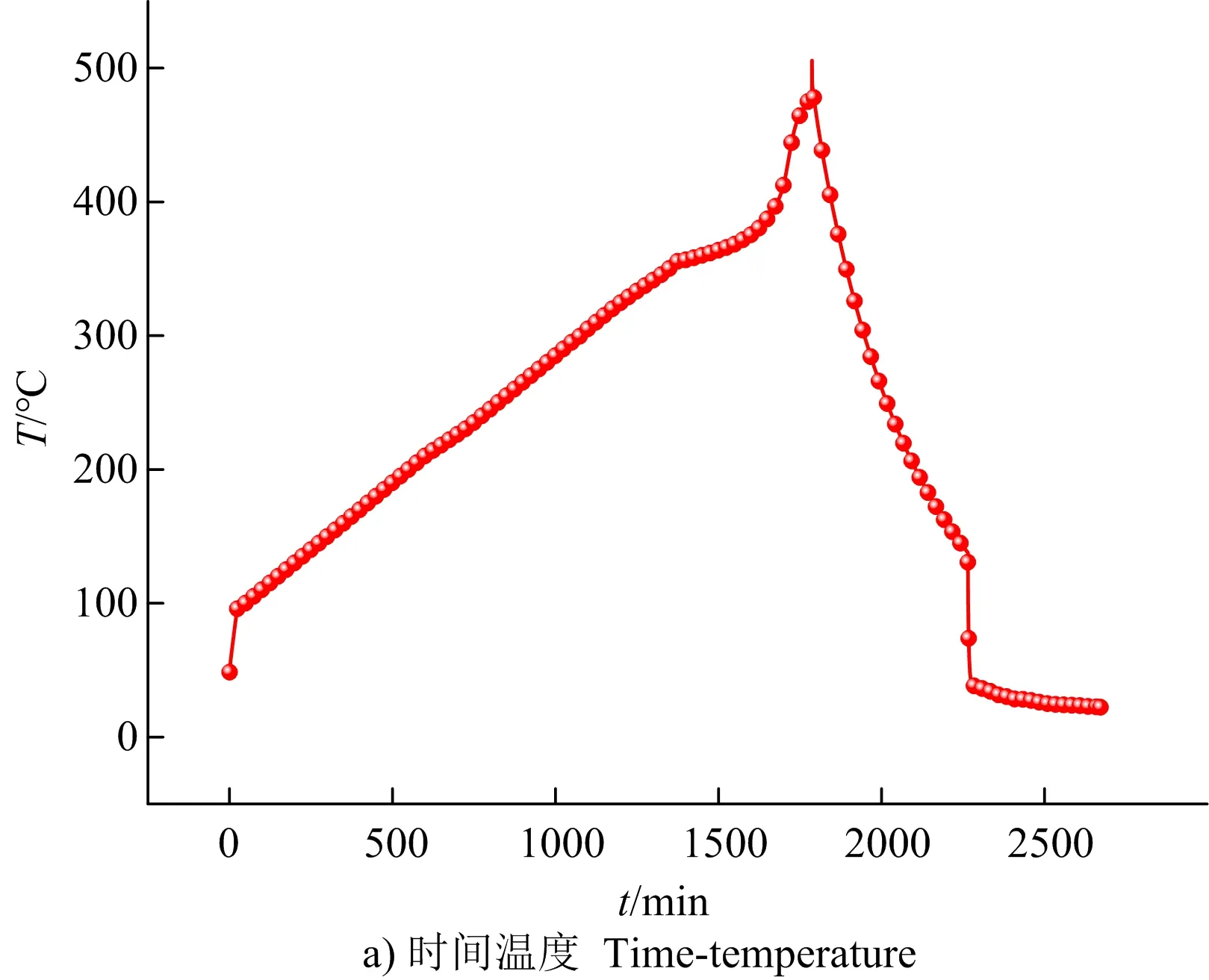
由图2 a可知,随着时间的推移,温度先匀速缓慢上升,在1 785 min时,温度急剧增大至505.50 ℃。由图2 b可知,在1 761 min时,压力由16.42 bar急剧增大至29.26 bar,其原因为激发药剂分解产生的CO2、NH3等气体,使密闭的样品容器内压力迅速增大,高氯酸钾分解产生的氧气与还原性气体发生剧烈的氧化还原反应,放出大量热量使温度迅速上升。由图2 c可见,随着温度上升,压力变化也可大致分划为4个阶段。
第1阶段,从90~250 ℃。大于90 ℃之后,压力开始缓慢上升,在140 ℃左右,上升趋势增大,在250 ℃左右趋于平衡,这与TG曲线第1和第2阶段表现基本一致,随着草酸铵受热脱水,并随着温度上升进一步分解产生NH3和CO2等气体产物,样品容器内压力逐渐增大。
第2阶段,从250~370 ℃。从250~330 ℃,压力无明显增大趋势,在330 ℃左右压力骤升后速度下降,并在370 ℃左右趋于平衡,此为部分水杨酸分解和高氯酸钾晶型转变过程。
第3阶段,从370~460 ℃。从370~420 ℃,压力增长趋于平衡,在420 ℃左右,压力缓慢上升,这与TG曲线基本一致,为水杨酸继续分解过程。
第4阶段,大于460 ℃。在460 ℃左右压力骤增并迅速达到平衡。压力骤增说明快速地生成大量气体,迅速地达到平衡说明生成大量气体是一个短暂的过程,该特征表明发生了氧化还原反应。
与非密闭条件下TG实验结果相比较,试验结束时的峰温降低了约140 ℃,且反应速度非常快,说明激发药剂在密闭条件下,高氯酸钾与草酸铵和水杨酸的分解产物发生了剧烈的氧化还原反应[16],放出大量热量。本实验结果可以为解释激发药剂需要在一定的外部压力作用下才能被可靠地点燃的现象[6],提供实验依据。
2.3 激发药剂耐温性能测试与分析
为了以进一步表征激发药剂耐温性能,结合TG试验数据,采用如下经验公式[17],计算温度指数,即:
Ts=0.49[T1+0.6(T2-T1)]
(1)
式中:Ts为温度指数,即样品长期使用温度,℃;T1为质量损失5 %时的温度,℃;T2为质量损失30 %时的温度,℃。根据图3中TG曲线结果,取T1为112.8 ℃、T2为231.6 ℃,代入式(1)计算得出激发药剂温度指数Ts为90.199 ℃,表明激发药剂在90 ℃以下耐温性能良好[9,18]。
为了验证上述温度指数Ts计算结果,采用KP型复合推进剂耐温性能测试方法[9],开展了耐温试验。由上述TG实验结果可知,激发药剂在90 ℃时开始失重,在200 ℃左右开始缓慢热分解,但未发生剧烈反应,因此称取2份30 g激发药剂,分别在80 ℃和200 ℃下保存48 h,观测其状态变化情况。对应的样品,分别标记为样品1和样品2,试验前后的样品状态如图3所示。

图3 耐温试验前后激发药剂状态Fig.3 KP type heating agent before and after temperature test
试验结果表明,样品1未自燃,也无明显的颜色变化,经称量,保温前后质量无明显变化,符合“热失重不大于3 %”热稳定性要求[9]。样品2也未自燃,但颜色由白变黄,试验过程中有烟雾生成,试验结束时烘箱内壁附着有针状和毛状晶体(见图4),质量减小约29.5 %,与TG实验中激发药剂在200 ℃左右质量损失约30 %的结果基本一致。从晶体形状和水杨酸从76 ℃开始升华的物理性质,可以推断出,结晶体应为水杨酸升华后遇冷附着在烘箱内壁所致,而损失的质量应包括蒸发的水分、草酸铵分解产生的氨气等所形成的烟雾和升华的水杨酸。

图4 200 ℃加热结晶现象Fig.4 200 ℃ heating crystallization phenomenon
耐温试验结果表明,在小于温度指数Ts计算值90.199 ℃的80 ℃温度下,激发药剂比较稳定,而200 ℃温度下激发药剂组分损失严重,说明温度指数Ts计算结果是合理的。
3 理论计算与分析
为了得到激发药剂的动力学参数,利用Ozawa法对相同转化率、升温速率分别为1、2.5、5 ℃/min的TG曲线进行计算,得到表观活化能。Ozawa法采用的热动力学方程为
(2)
式中:βi为升温速率,℃/min;A为表观指前因子,min-1;E为表观活化能,kJ/mol;R为摩尔气体常数,8.314 J/(mol·k);G(α)为反应机理函数;α为转化率,%;Tpi为分解峰温,K。
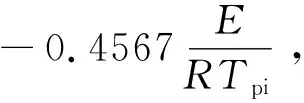
样品在不同升温速率βi和不同转化率α下的反应温度T如表4所示。根据式(2)和表4中所列数据,用Ozawa法对lgβi和1/T进行线性回归分析,结果如图5所示。根据图5中直线斜率求得表观活化能E,所得各转化率下表观活化能如表5所示(其中r和Q分别为相关系数和剩余标准差)。
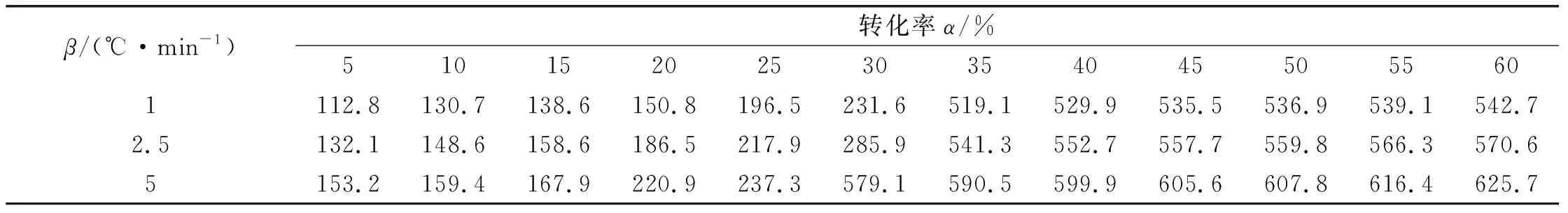
表4 不同升温速率和转化率下的反应温度

图5 Ozawa法得到的lgβi(103/T)曲线拟合结果Fig.5 Fitting results of lgβi vs.103/T by Ozawa’s method

表5 Ozawa法所得的动力学参数
从表4可以看出,在转化率为5 %~25 %时线性拟合度较好,在30%~60 %时线性拟合度较差,这与温度跃迁有关。在转化率为30%~35%时,升温速率为1、2.5 ℃/min时均发生了温度跃迁;在转化率为25%~30%时,升温速率为5 ℃/min也发生了温度跃迁。在转化率为30 %时,活化能明显降低。经计算激发药剂的平均活化能为86.986 kJ/mol。
4 结论
1)无论在非密闭条件下还是在密闭条件下,激发药剂均在升温至90 ℃时开始质量损失。在非密闭条件下缓慢升温,激发药剂的质量损失先后为水分蒸发、水杨酸升华、草酸铵和高氯酸钾分解,各组分之间未发生氧化还原反应,激发药剂的热化学安定性主要体现为各组分的热稳定性。经计算,平均活化能为86.986 kJ/mol。
2)在密闭条件下,升温至460 ℃之后,激发药剂发生氧化还原反应。一方面表明激发药剂热化学安定性良好,另一方面表明一定的压力作用有利于激发药剂燃烧反应。
3)耐温试验结果表明,在80 ℃下,激发药剂比较稳定,而200 ℃温度下激发药剂组分损失严重,说明温度指数Ts计算值90.199 ℃是合理的。
