微囊载体固定化多酶的研究进展
2022-02-23吕永琴
王 静,吕永琴
(北京化工大学 生命科学与技术学院 北京市生物加工过程重点实验室,北京100029)
生物制造是生物经济发展的关键,而生物制造产业的核心是微生物细胞反应器或无细胞合成体系,它们是高效合成化学品的生物工厂。无细胞合成生物技术可以利用体外系统合成产品,一定程度上克服了活体细胞的限制,所以更容易实现人为控制和精确调控,在控制反应器体积、流速和反应周期的同时还可以模拟细胞体内的环境,从而发挥最佳性能[1-2]。生物体的酶催化大多是通过多酶协同催化或级联催化系统来实现的,多酶催化具有反应的高效性和特异性、产品纯度高、反应时间短和耗能低等优势,所以被广泛用在生物传感、生物合成和转化、生物医药、生物材料和环境保护等领域。然而,虽然大多数酶可以在温和的条件下实现高效催化,但是天然的多酶催化体系在实际的催化过程中存在一些局限性,如不稳定性、不相容性、难以回收和重复利用等[3]。
对酶进行固定化,可以克服游离酶的缺点,提高酶的稳定性、可重复使用性和催化效率[4]。事实上,酶固定化的方式和材料均会直接影响酶的催化性能[5]。对多酶进行固定化,存在共固定和分别固定的方式。多酶共固定化可以提高中间体的局部浓度,从而降低物质运输扩散的影响,提高催化速率[6]。但多酶共固定化也存在一些问题,如不同酶之间的最佳催化环境不匹配使每种酶的最优催化能力难以发挥,甚至有时多酶体系中有些酶不相容,从而抑制酶的活性甚至导致酶的失活[7]。因此,在多酶固定化过程中应该保证酶在空间上的隔离,以避免不同酶之间的不良反应,营造适合每种酶催化的微环境,这对实现多酶协同高效催化是非常有必要的[8]。
微囊具有制备方法简便、形式多样、生物相容性好且负载能力强等优势,是多酶固定化的优良载体。通过精准调节内核模板和外层基质进行多样化精细地制备,微囊可以满足不同体系的多酶催化的个性化需求,如稳定性、催化活性、相容性和底物特异性等。早在1975年,Chang课题组将不同的多酶体系共固定在半渗透性胶棉微囊中,分别实现了腺嘌呤核苷三磷酸(ATP)、烟酰胺腺嘌呤二核苷酸(NAD+)和还原型烟酰胺腺嘌呤二核苷酸磷酸(NADPH)辅因子循环再生[9-11]。之后该课题组又制备了半透性尼龙聚乙烯亚胺微囊,在固载多酶的过程中将辅因子NAD+与葡聚糖结合,防止辅因子的泄露,达到了每小时72个循环的辅因子回收率[12]。微囊除了应用于固定化酶外,还可以固定化细菌和细胞[13-14],为其在生物催化和生物医学的应用开拓了思路。
根据制备方式和材料的不同,可将微囊分为以CaCO3为模板、以聚合物为支架和以凝胶为基质的微囊这三大类。本文中,笔者总结了不同制备方式和材料构建的微囊,综述以此进行体外固定化多酶的研究及应用的进展。
1 以CaCO3为模板制备微囊对多酶进行固定化
球形CaCO3微粒可以通过Ca2+和CO32-之间的相互作用极其简便地制得,一般尺寸为2~8 μm,具有无毒、负载能力强和生物友好等优势,以它为模板对酶进行固定化,再利用乙二胺四乙酸(EDTA)有效脱除模板,这样的研究已被广泛报道。
以CaCO3为内核模板,通过EDTA去除模板后形成具有空心内腔的微囊,可用于多酶的固定化。Jiang等[7]首先将酶包埋在CaCO3颗粒内作为内核模板,再通过逐层自组装合成了负载酶的鱼精蛋白SiO2杂化的微囊,以此作为客体分子再包埋至藻酸盐珠粒中,构建酶催化微反应器(图1)。带负电的聚(4-苯乙烯磺酸钠)(PSS)的加入,使得CaCO3表面形成负电荷,有助于沉积带正电的鱼精蛋白层,而鱼精蛋白又可以吸附并诱导SiO2层的形成。去除CaCO3模板后,制备出粒径约3 μm的多层杂化微囊。将分别负载甲酸脱氢酶(FateDH)、甲醛脱氢酶(FaldDH)和醇脱氢酶(ADH)的杂化微囊作为客体分子包封至力学强度高、孔径合适且易于回收的珠粒中,构建多酶协同催化CO2转化为甲醇的微反应器。外层珠粒的平均孔径为3.9 nm,既可以保证物质运输又可以防止酶的泄露。该微囊体系提高了酶活和甲醇产率,当NADH浓度为100 μmol/L时,比游离酶的甲醇产率提高了近6倍。Wang等[15]通过在CaCO3表面沉积儿茶酚改性的明胶(GelC),再原位诱导SiO2的生长,去除CaCO3模板后形成厚度为70 nm、孔径为3.6 nm的GelC/SiO2超薄杂化微囊,利用该体系有序高效地固载FateDH、FaldDH和ADH这3种酶,最终甲醇的产率和选择性分别是游离酶的2倍和1.8倍,循环使用9次后,甲醇的产率仍为初始的73.5%。

图1 制备含酶的杂化微囊及构建珠包囊结构的微反应器[7]Fig.1 Preparation of enzyme-containing hybrid microcapsules and construction of capsules-inbead structured microreactor[7]
Shi等[16]整合仿生矿化和双模板的策略,制备了具有微米级内腔和纳米级膜间隙的有机层(藻酸盐)-无机层(SiO2)杂化双层膜微囊(HDMMs),其中,CaCO3为内核模板,SiO2为膜间隙模板。通过改变硅酸盐的浓度来调控SiO2的厚度,进而调节膜间隙的尺寸。当硅酸盐的浓度为10~70 mmol/L时,SiO2层的厚度为70~140 nm。由于外膜和内膜的孔径分别为2.2和30 nm,合适的孔径在防止酶泄露的同时,又保障了底物的自由运输,这种独特的结构有助于酶活、产率和稳定性的同步提高。
聚多巴胺(PDA)可由多巴胺在特定条件下发生温和的氧化自聚反应来制备,具有极好的生物相容性、亲水性和可控性。PDA层的厚度可以通过改变聚合时间、多巴胺的浓度和水溶液的pH来控制。因此,将PDA层和CaCO3内核模板相结合,可以构建生物相容性好的PDA层微囊。Zhang等[17-18]分别在CaCO3模板的表面形成孔径为3.8 nm的聚多巴胺层和在CaCO3模板表面依次沉积TiO2和PDA,去除CaCO3模板后,分别形成了PDA微囊和鱼精蛋白/TiO2/PDA杂化微胶囊,2种体系固载葡萄糖苷酶、β-淀粉酶和α-淀粉酶3种酶分别在内腔、PDA壁层内和附着在微囊外表面,最终多酶微囊体系显示出高催化活性和高循环稳定性。
金属有机框架(MOF)具有高比表面积、独特的孔径率和结构多功能性,在用于固定化酶载体的同时,还具有模拟酶的活性[19]。Wang等[20]将具有过氧化物酶活性的ZIF-8结合葡萄糖氧化酶(GOx),制备了PDA/ZIF -8微囊用于葡萄糖检测,整合石墨烯纳米片(rGO)加速电子转移,并固定在玻璃碳极(GCE)上,开发了一种GOx/PDA/ZIF -8@rGO/GCE新型生物传感器,检测限可达0.333 μmol/L。该传感器可对1 mmol/L的葡萄糖连续扫描25个循环,峰值电流仍没有明显变化,运行15 d后对应的电流仍为初始电流的95%,具有极强的可重复性和储存稳定性。
MOF还可以作为模板,参与微囊的制备过程。Wang等[21]以ZIF -8作为微囊壳上的外层模板,制备了表面粗糙的超薄的TiO2微囊(图2)。首先,在掺杂PSS的CaCO3内核模板上依次涂覆单宁酸(TA)、疏水性ZIF -8和TA;接着,仿生矿化沉积鱼精蛋白/TiO2双层结构;最后,通过EDTA同时去除CaCO3和ZIF -8双模板,形成以TiO2为壳的表面粗糙的Z -TiO2微囊。通过调节ZIF-8的尺寸可以调节微囊表面的粗糙度,该体系具有酶的负载量高、热稳定性好和储存稳定性强的特点。

图2 Z-TiO2微囊的制备过程示意[21]Fig.2 Schematic representation of the fabrication process of Z-TiO2 microcapsules[21]
CaCO3除了作为内核模板,还可以作为壁层模板。Kreft等[22]提出由2个同心的CaCO3制备囊中囊的结构,内芯CaCO3和外壳CaCO3表面均通过聚电解质多层(PEM)堆积5个双层的阴离子PSS和阳离子聚丙烯胺盐酸盐(PAH),形成PSS/PAH双层膜,去除双模板后,形成内芯直径为3~4 μm、外径为8~10 μm的两室壳中壳的独特结构。Shi等[23]整合亲水性PAH的分离,仿生矿化的性能和CaCO3双模板的功能制备出介孔杂化微囊。PAH作为外壁模型支架,在戊二醛(GA)交联下,诱导矿化在外层间隙合成TiO2,通过去除内核和外壳间隔的CaCO3双模板合成PGTi杂化微囊。通过改变PAH分子量的大小来调节微囊的形态和囊壁的厚度,当PAH的分子量为1.5×104时,囊壁为更薄(~230 nm)的折叠形态;当PAH的分子量为7.0×104时,囊壁为更厚(~600 nm)的完整球态。杂化微囊具有极高的力学强度,中孔结构可以实现可控传质,在酶催化、废水处理和药物递送方面均表现出卓越的性能。
2 以聚合物为支架合成囊泡对多酶进行固定化
受细胞膜和脂质体结构的启发,由疏水性尾部和亲水性头部组成的两亲性嵌段共聚物可自组装成空心球状物,即聚合物囊泡。这种人造的聚合物囊泡可以结合聚合物化学修饰的多功能性,通过精准设计来实现稳定性和可协调性,甚至提高酶的催化性能[24-28]。
基于聚合物囊泡构建纳米反应器来固定化酶,可以使酶免受极端、苛刻环境的破坏从而提高酶的稳定性。Vriezema等[29-30]由二嵌段共聚物聚苯乙烯40-b -聚(异氰丙氨酸(2-噻吩-3-乙基)酰胺)50(PS-b-PIAT)合成聚合物囊泡,实现3种酶精准定位在囊泡的不同区室内(图3)。该聚合物囊泡的平均直径为7 μm,平均膜厚度为(27±5)nm,约是嵌段共聚物长度的2倍。利用聚合物膜的多孔特性,将酶分子截留在内部,而小分子可以自由扩散,这为构建酶反应器提供了条件。3种酶在空间上有序分布,依次是第1种酶GOx固载在囊泡的内部,第2种酶辣根过氧化物酶(HRP)通过冻干的方法固载至膜内,第3种酶南极假丝酵母脂肪酶B(CALB)在囊泡外部,实现三酶有序组装。van Dongen等[31]对PS-b-PIAT合成的多聚体囊泡的表面进行乙炔官能团化修饰形成锚点,与叠氮官能团化的HRP通过点击化学实现共价偶联,在囊泡的外表面形成酶的外壳,实现三酶有序定位。Meeuwissen等[32]首次将聚合物囊泡用来实现辅因子再生的反应器,将6-磷酸葡萄糖脱氢酶(G6PDH)封装至PS -b-PIAT合成的囊泡的内部,而苯丙酮单加氧酶(PAMO)在溶液中或共价固定在囊泡表面,基于Baeyer-Villiger反应构建NADP+和NADPH辅因子循环双酶系统。
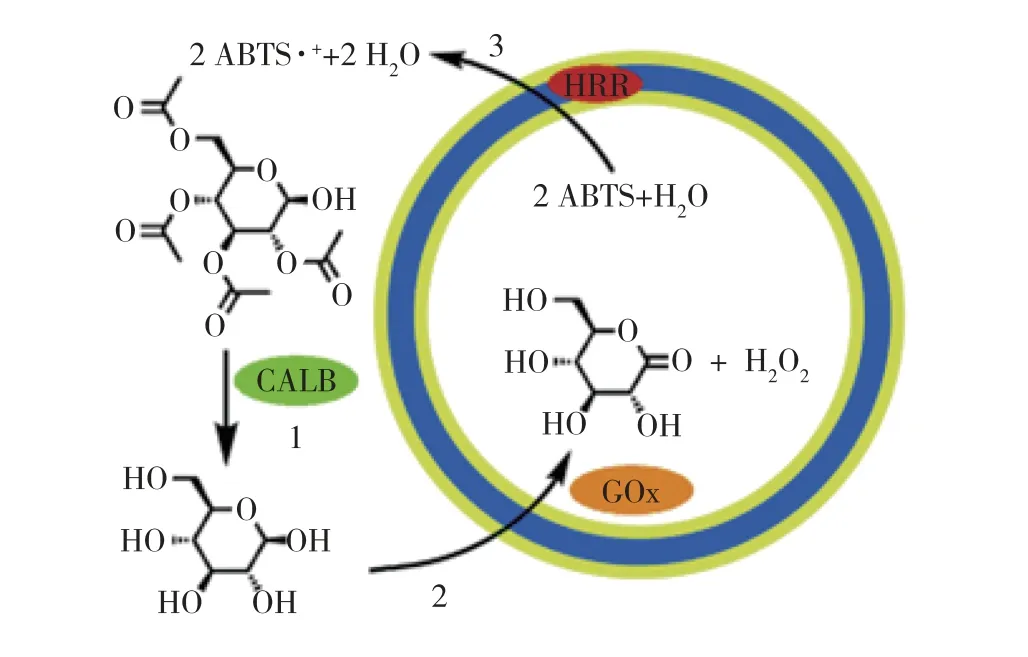
图3 三酶囊泡体系发生多步反应的示意[29]Fig.3 Schematic representation of the multistep reaction taking place in the three-enzymepolymersome system[29]
囊泡包囊泡这种精细的隔室结构可以改善多酶催化的不相容性。Peters等[33]将包封酶的PSb-PIAT聚合物囊泡与游离酶和底物共同再封装至由聚丁二烯-b -聚(环氧乙烷)(PB -b-PEO)聚合而成的更大的囊泡中,形成囊泡包囊泡的精细结构,这种囊中囊的结构与真核细胞包含多个细胞器的结构类似,实现酶促多室催化。CALB和ADH包封在内部囊的亚室内,PAMO在外部囊的腔室内,实现三酶级联反应。将具有酯酶活性的碱性蛋白酶代替CALB,由于其具有蛋白酶降解的特性,则与其他酶不相容。囊中囊的纳米多室反应器固载含有碱性蛋白酶的多酶级联体系相比于游离酶体系,其蛋白酶的降解效果明显降低,证明了这种囊中囊的多室结构改善了级联反应中酶与酶之间不相容性的问题。
然而,不少酶的催化活性受到小分子抑制乃至变性失活,聚合物囊泡虽然力学稳定性较好,但膜渗透效果不好。提高膜渗透性可以使用多孔膜、刺激响应性膜和插入通道蛋白等方法,而这些方法对于小分子物质难以实现选择性输运。Klermund等[34]制备了超高选择性的渗透膜,改善了小分子参与交叉抑制的多酶级联反应(图4)。此多酶级联反应分为三步:首先,N- 乙酰氨基葡萄糖(GlcNAc)在变构激活剂ATP和N- 酰基-D -氨基葡萄糖2-表异构酶(AGE)催化下转化成N-乙酰甘露糖胺(ManNAc);接着,ManNAc和丙酮又在N-乙酰神经氨酸裂解酶(NAL)催化下生成N-乙酰神经氨酸(Neu5Ac);最后,Neu5Ac在胞苷三磷酸(CTP)的激活下被CMP -唾液酸合成酶(CSS)催化下生成CMPNeu5Ac。但是,AGE的酶活受到小分子CTP的抑制。为了解除这种抑制,将AGE和ATP一起封装在渗透性很低的聚(甲基恶唑啉)15-聚(二甲基硅氧烷)68-聚(甲基恶唑啉)15(PMOXA -PDMSPMOXA)聚合物囊腔内部,NAL和CSS这2种酶用疏水性肽锚定在多聚体外表面,实现空间上的分离。为了实现高选择性的传质效应,将突变后的通道蛋白OmpF G119D掺入膜内。OmpF G119D分子量截留值为300,孔径更小,且带有负电荷;而CTP的分子量为483,带负电。因此,OmpF G119D可以有效阻拦CTP的运输。这种独特的区室化纳米反应器相比于非区室化的多酶催化,产量提高了2.2倍。

图4 聚合体中的区室化反应[34]Fig.4 Compartmentalized reaction scheme in polymersomes[34]
构建酶-材料复合物可制备高于游离酶活性的固定化酶[35]。将聚合物和酶分子结合,可以构建聚合物-酶杂化物。制备方法包括共价偶联、酶蛋白原位生长聚合物和受控的自由基聚合等。Grotzky等[36]将HRP和超氧化物歧化酶(SOD)配位至阳离子树枝状聚合物上,使得酶分子在空间上互相接近,并将酶-聚合物杂化物一并包封在直径20 μm巨型磷脂囊泡中。Delaittre等[37]构建了新型的全酶纳米反应器,由HRP -聚苯乙烯(HRP-PS)或HRP-聚甲基丙烯酸甲酯(HRP-PMAA)2种HRP亲水的头部和聚合物疏水的尾部构成酶-聚合物,在自组装的过程中将GOx包封在囊泡内部,两层HRP在囊膜的外侧,聚合物尾对尾在膜内部。这种独特的囊泡结构在保护GOx的同时还可以防止HRP聚集堆积。与PS相比,基于PMMA组件的微囊显示出更高的级联催化转化率,这归因于PMMA链的疏水性更低,因此使底物可以更易接近酶的活性位点。
此外,嵌段共聚物还可以与量子点[38]、金属离子配位[39]、表面功能化[25]、相转移工程化制备[40]及生物糖醇检测[41]等技术相结合,为酶催化的应用提供了有力支撑。
3 以凝胶为基质构建腔室对多酶进行固定化
纳米凝胶通过亲水聚合物交联而得,具有生物相容性好、表面积大和负载量高的特点[42],可以为酶提供一个温和的环境,从而保留甚至增强酶的活性,作为保护层使得以凝胶为基质的固定化酶具有很高的稳定性。Yan等[43]首次通过原位水聚合将单个酶封装至纳米凝胶中,当丙烯酰胺单体与HRP的摩尔比为800时,合成了直径为17 nm、厚度为~5 nm的球形纳米凝胶单酶,这样不仅保留了酶的催化活性,还极大地提高了HRP对热和有机溶剂的稳定性。许松伟等[44]制备的海藻酸(ALG)-SiO2杂化凝胶比ALG凝胶具有更紧凑的结构,固载的多酶可以很好地保留酶的活性,防止酶的泄露且具有很好的储存稳定性和重复使用性。
将凝胶与聚合物囊泡结合,De Hoog等[45]首次将包含酶的聚合物囊泡进一步凝胶化,以实现重复使用。通过透射电子显微镜(TEM)和共聚焦荧光显微镜(CFM)分析发现,包含CALB的聚合物囊泡固定在透明质酸(HA)功能化的凝胶中,且囊泡保留了完整性。水凝胶一般具有缓释能力,而在固定化酶的过程中,缓释则意味着酶的泄露。这种凝胶化的聚合物囊泡则几乎没有酶的泄露。这种固载方式可以重复使用8个循环仍保留较好的酶活性,对分别包含GOx和CALB水凝胶囊泡进行堆叠,制备了连续流间接式反应器。
在多酶固定的过程中,精准控制酶的数量、类型及空间排列,对提高级联反应的催化效率起关键作用。Wang等[46]基于空心水凝胶和反蛋白石,集成微流控电喷雾技术,开发了一种可以精准控制包封酶的数量、类型及空间排列的新型系统(图5)。反蛋白石是一种三维有序的大孔材料,具有鲜明的结构特征,其巨大的表面积可用于固载酶,多孔结构用于多酶催化之间的物质渗透传输,而水凝胶壳在起保护作用的同时提高酶的稳定性。通过2个同轴的圆形毛细管组装成微流控芯片装置,外毛细管和内毛细管的内径分别为580和250 mm,将此芯片与电喷雾集成三孔道装置用于可控制备三酶微囊体系。外相为20 g/L的海藻酸钠(Na -Alg)溶液,内相为固载了不同酶的反蛋白石溶于质量分数2%羧甲基纤维素钠的溶液,基于流体动力学聚焦效应,在电场的作用下分散成微滴,滴入20 g/L的CaCl2溶液中使海藻酸钠凝胶化,形成以反蛋白石为内核、水凝胶为壳的一包三的精准微囊结构。固载的3种酶为β-葡萄糖苷酶、GOx和HRP,结果发现,基于反蛋白石微胶囊体系比游离的反蛋白质体系级联催化效率高得多,这是因为微囊可以实现多酶间更快的传质。这种空心水凝胶一包三的精细结构可用于精准调控更加复杂的多酶催化网络体系。

图5 生物启发的微囊的制备示意[46]Fig.5 Schematics of the preparation of the bioinspired microcapsules[46]
在这种分区的腔室结构中,大多通过多酶在空间位置上的接近以提高反应中间物的传质速率,从而实现酶催化活性不同程度的提高。而针对底物结合的特异性,则研究较少。Zhang等[47]通过水相沉淀聚合法制备分子印迹纳米凝胶聚合物、生长在具有过氧化物酶活性的Fe3O4纳米颗粒(Fe3O4NPs)上,去除底物模板后,形成具有底物结合口袋的纳米凝胶壳,口袋腔室用于提高不同底物的特异性结合。该纳米酶可以催化2种底物,分别为3,3′,5,5′-四甲基联苯胺(TMB)和2,2′-叠氮基双(3-乙基苯并噻唑啉-6-磺酸)二铵盐(ABTS),将分别印迹TMB和ABTS这2种底物的纳米凝胶分别记为T -MIP和A -MIP,结果发现:T-MIP对TMB的表观催化活性比游离的Fe3O4提高了2.8倍,而AMIP对TMB的表观催化活性比游离的Fe3O4要低;同样地,A- MIP对ABTS的表观催化活性比游离的Fe3O4提高了4倍,而T -MIP对ABTS的表观催化活性比游离的Fe3O4要低很多,以上差异证明了这种印迹纳米凝胶极大地增强了底物的特异性和催化活性。由于TMB带正电荷、ABTS带负电荷,因此,在合成分子印迹聚合物的过程中引入带电单体,借助静电作用,可以进一步增强底物的特异性。选用N-[3-(二甲氨基)丙基]甲基丙烯酰胺(DMPA)为阳离子单体和2-丙烯酸酰胺基-2-甲基-1-丙烷磺酸(AMPS)为阴离子单体代替中性单体,在印迹TMB过程中若加入阴离子AMPS,则纳米凝胶带负电,记为T-MIPneg,若加入阳离子DMPA,则纳米凝胶带正电,记为T -MIPpos;同理可制得A -MIPneg和A-MIPpos。带电凝胶可以极大提高催化效率和底物选择性,T-MIPneg催化效率比Fe3O4的高15倍,使用T -MIPneg纳米凝胶对TMB的选择性是ABTS的98倍,A -MIPpos对ABTS的选择性是TMB的33倍。
4 结论与展望
多酶的共固定化可以解决游离酶催化存在的稳定性差、难以重复使用等问题,提高多酶的协同催化效率。微囊作为一种制备简单、形式多样、生物相容性好、稳定性高的固定化酶载体,在催化过程中既可以实现底物的自由运输又可以防止酶的泄露。
微囊载体的研究为提高酶的实际应用提供了丰富的可能,在医学、食品工业、化妆品等领域已有广泛的应用。例如,利用微胶囊固定化酪氨酸酶、胰岛素或青霉素酰胺酶可清除体内酪氨酸、治疗糖尿病和白血病等;包埋溶菌酶可实现杀菌,防止食品腐败变质。然而,微囊载体对多酶的共固定化目前大多仍停留在理论研究阶段,实际应用较少,主要有辅因子再生、还原CO2生产甲醇、葡萄糖检测等例子。为实现微囊固定化多酶体系的大规模应用,应面向生物化工领域的重要难题,通过材料科学、纳米技术和生物技术的交叉融合,开发高性能、低成本的微囊材料。未来,应深入探索多酶体系中酶-底物、酶-酶、酶-载体、酶-溶剂的相互作用机制,根据作用机制设计构建新型的多酶固定化载体和方法,实现固相化多酶的规模化制备,为绿色生物制造提供稳定、高活性的多酶催化剂。
