生物催化中的酶固定化研究进展
2022-02-23张璟譞高兵兵何冰芳
张璟譞,高兵兵,何冰芳,
(1.南京工业大学 生物与制药工程学院,江苏 南京211800;2.南京工业大学 药学院,江苏 南京211800)
酶催化剂在食品、化学和制药等不同领域均发挥着重要作用[1-5],促进了大宗化学品、食品添加剂以及药物的可持续生产。我国通过“十一五”[6]和“十二五”[7]期间相关国家科技计划的部署实施,成功实现了部分重大化工产品生物制造的产业化应用。当前,生物催化由于其优秀的反应选择性已成为低碳经济发展趋势下新一轮技术革新和产业改革中的焦点[8]。工业化催化反应中,通常使用有机疏水相反应体系[9],游离酶由于在较高的反应温度或极端不稳定的pH范围内的弱稳定性和对疏水溶剂的低适应性,使其无法在工业化生产中被大规模使用。此外,游离酶通常难以与反应系统分离并且难以重复使用[10-11]。
因 此,在20世 纪60年 代,固 定 化 酶(immobilized enzyme)这个专业用语被首次提出并采用[12]。其定义如下:使用某种方法将酶和载体结合在一起,使之不溶于含有底物的反应相中,以控制酶解反应发生在一定的空间范围内[13]。酶的固定化有助于实现其回收后的重复使用并提高其稳定性[14]。固定化酶相较于游离酶在工业化连续生产中表现出很多不可或缺的优点,固定化酶表面微环境和酶之间的作用力,可以适当维持活性中心结构的刚性,从而使酶维持在一个稳定的高活性状态,从而有效增加产物收率;而且将酶固定在合适的载体上,简化了反应液中回收酶的步骤,同时增强了酶的力学性能和热稳定性。更重要的是,由于固定化后的酶不会发生严重的团聚作用,反应体系中没有酶液的残留,从而简化了后续的提纯工艺,反应过程变得可控且更适合多酶反应体系,尤其是在可以提高使用微流体反应器进行连续流动反应时酶自身的可操作性和力学性能以及热稳定性[15-16]。然而,较高的生产成本和较低的蛋白质载量以及固定化效率都限制了固定化载体的商业应用[17]。随着现代生物技术的不断发展以及学科间的相互渗透,相较于基于普适性思维设计的传统固定化酶策略,根据酶的特性以及应用需求研发的新型固定化方法[18]以及具有理想比表面积的微/纳米结构材料[19],使得酶往往具有更高的担载量,因而有效提高了酶的固定化效率。为顺应绿色制造和精细化工技术时代的要求,酶固定化技术越来越多地被应用于化工生产、食品、医药、环境治理和生物能源等领域。笔者重点综述了传统和新兴的酶固定化方法,以期为研究者提供相关参考。
1 传统的酶固定化技术
传统的酶固定化方法可粗分为4种:吸附法、共价结合固定法、包埋及衍生微囊法和交联法[20]。
1.1 吸附法
吸附法[21]是最早发展起来的酶固定化方法之一,也是固定化酶具有可操作性的重要理论依据,它通过载体和酶分子自身结构之间产生的非特异性的物理吸附[22]、离子吸附[23]、生物特异性吸附、亲和吸附和疏水作用等,将酶分子固定在载体周围,从而成功制备了种类丰富的固定化酶。吸附法制备固定化酶的操作比较简便,无需经过化学反应,不采用有毒试剂,条件相对温和,酶活回收率较为理想,但吸附特异性较低。因此,常作为基础方法与其他方法联用,从而衍生出特异性更强的酶固定化策略。
1.2 共价结合固定法
共价结合固定法是指将酶蛋白分子上可反应的官能团与载体表面已有的活性基团间形成化学共价键,从而将载体和酶进行有效衔接[24]。这种方法由于有稳固的共价键结合,使得酶不易从载体上脱落,易从反应体系中被回收,且重复使用次数较多,但载体激活方法易产生毒废料且化学键结合易使酶的构型发生不可控的改变,继而导致部分酶失活。
1.3 包埋及衍生微囊法
包埋法,即通过将高分子材料分散到流体介质中形成格子结构或者微囊结构,以达到将酶或者其他生物催化剂约束在载体中以及阻止蛋白流失的目的[25]。底物能够通过孔隙进入不溶性载体中与酶接触,此法操作条件温和简单,但对底物和产物的尺寸有一定要求,较适合两者均为小分子的酶类。
酶的微囊固定化法实质上属于包埋固定化的一种衍生方法,是指将水溶性或冻干酶、细胞通过界面沉淀聚合法以及二级乳化法,将酶包埋在直径为1~100 μm的半透性高分子膜内的固定方法[26]。
1.4 交联法
交联法是指利用双功能试剂作为链接臂对酶蛋白进行分子间的交联反应,该法通过化学反应产生共价键连接,形成疏水性三维共价键网架结构后,再从亲水性溶液中被析出[27]。由于交联反应的无序性,可能在酶的活性中心发生交联而使酶活降低或失活,从而明显降低固定化酶的酶活回收率。同时,由简单交联形成的固定化酶交联体的力学性能较差,因此交联法很少被单独应用于酶的固定化中,通常与其他固定化方法结合,以巩固或提高原有固定化策略的效果。
2 新兴的酶固定化方法
2.1 交联酶聚集体技术
以交联酶聚集体法(mCLEAs)为代表的无载体固定化技术是指先采用物理方法将酶蛋白聚集,之后采用交联剂对酶进行交联。相较于传统的交联法,该法在固定化过程中通常串联或者并联多个酶,有更高的酶活性和可控性以及更低的生产成本,因而能够在同体系催化多级级联或非级联的生物转化。该固定化技术中常用的双功能交联剂为半缩醛和半缩醛寡聚体形式的戊二醛。Pervez等[28]通 过 在 酶 溶 液 中 加 入 质 量 分 数40%(NH4)2SO4和1.5%戊二醛,在4 h内制备出具有94%聚集率的交联淀粉葡糖苷酶聚集体(CLAA)。脂肪酶和多种复合酶蛋白存在着界面激活效应,酶的自固定化概念也由此被提出,即将酶的水溶液与含表面活性剂的非水相溶液混合,同时加入双功能交联剂,借助物理方法,从而形成微乳化体系。由于自身结构特点,酶倾向于向油水界面靠近,交联剂使微乳球表面附近的酶聚集而表现出高度的疏水性,除去有机试剂后,获得的固定化酶通常处于利于反应的激活态。随后,Arastoo等[29]将Km12脂肪酶的交联酶聚集体进一步与氨基包覆的磁铁矿纳米颗粒耦联,得到磁性纳米mCLEAs- 脂肪酶(mCLEAs-lip),该固定化酶在6个循环后,仍能保持其原始酶活,且在4℃低温环境中被封存24 d后仍能检测到60%的原始酶活。
2.2 柔性长链技术
酶的柔性固定化是指将一些有足够碳链长度且具有一定亲水性的分子链,通过化学法接枝在固定化载体上的技术。带有柔性链的载体在制备固定化酶的过程中,缓解了固定化过程中酶与载体之间的刚性碰撞,从而避免了因构象改变而损失的部分酶活;另外,柔性链既能使酶蛋白构象因受微环境的改变而发生恰当的折叠或改变,又可以部分保留固定化酶在游离态时的构态柔性,从而增加酶的自恢复能力,以降低操作中的不稳定性。Qu等[30]通过原子转移自由基聚合反应,制备了具有环氧基的亲水性梳状聚合物(丙烯酰胺-共甲基丙烯酸缩水甘油酯,acryl-amide-co-glycidyl methacrylate),该载体可用于脂肪酶的共价柔性固定。固定在该载体上的脂肪酶担载量为16.6 U/g,在有效提高了pH和温度稳定性的同时,使用7个循环后,固定化脂肪酶的酶活仍为原始酶活的73.5%。
2.3 定向技术
定向技术克服了传统固定化技术中酶分子与载体表面位点连接的无序性,通过融合标签等方法实现了酶蛋白特定位点的定向结合,以避免活性位点被随机破坏。载体表面形成的有序二维阵列活性位点,通常被设计成面向载体表面外侧,以便于底物分子与活性中心结合,从而有效提高反应效率。定向固定化技术可细分为氨基酸置换法、抗体耦联法、生物素-亲和素亲合法,疏水定向固定化[31-33]和生物酶介导法等。增强的绿色荧光蛋白(EGFP)和谷胱甘肽转移酶(GST)可作为生物酶介导修饰策略的代表模型。Tanaka等[34]将EGFP模型蛋白的C末端用谷氨酰胺(Gln)供体底物肽标签进行标记后,通过转谷氨酰胺酶(MTG)酶促反应,定向地与含有酪蛋白涂层的聚苯乙烯表面亲和结合,该方法只需要廉价的蛋白质吸附剂,且具有很高的特异性。另一类标签蛋白固定化策略以DNA烷基转移酶标签(SNAP- tag)为代表[35-36],将目标酶与SNAP标签蛋白共表达,再利用标签与载体表面的特定残基形成稳定的共价结合。这一类固定化技术本质上是通过蛋白融合而实现的定向共价固定,例如Noba等[37]首先采用特定残基的苄基鸟嘌呤衍生物修饰磷脂成分后,再使用该成分制得脂质体以包裹β-葡萄糖醛酸酶(GUS),随后将其与带有SNAP融合标签的黏附性细菌纤维蛋白AtaA形成稳定的共价结合,而AtaA蛋白的黏附性末端可以被固定在疏水性和亲水性固体表面上。该固定化策略设计性较强且选择性理想,但操作细节较为复杂,目前仅被应用于对灵敏度和精确度要求较高的生物传感器[36]和人工细胞系统的制备方面[37],而关于各类生物酶的普适性催化应用还有待进一步的深入研究。此外,借助辅基-脱辅酶的亲和作用也可以构建出定向共固定化酶体系,例如许永娟[38]将辣根过氧化物酶(HRP)的辅基血红素和葡萄糖氧化酶(GOx)的辅基黄素腺嘌呤二核苷酸(FAD)固定在功能化的氧化石墨烯上制得改性辅基后,将去辅基的酶与改性辅基重组得到氧化石墨烯固定化酶。该研究发现[38]:相较于原始酶的电化学活性,氧化石墨烯改性后的HRP活性提高了将近4倍,而改性后的GOx的活性也提高了将近3倍。
2.4 化学修饰介导技术
化学修饰介导的固定化技术转变了传统的固定化思路,将酶分子氨基酸残基或载体表面通过化学法修饰,从而引入特定基团,使酶与载体间发生特定的化学反应,形成稳定的定向化学共价键吸附[39-40]。该法涉及可参与各种化学反应的氨基、硫醇[41]、羧基、羟基、环氧基、醛基、叠氮和炔烃等各种活性官能团。Li等[42]在聚丙烯腈(PAN)中的空膜表面使用腈点击化学法(Nitrile- click chemistry)进行修饰后,引入藻酸钠(SA),之后用CaCl2对膜进行后处理。制得的PAN -PEI -SA-CaCl2载体用于脂肪酶固定化时,蛋白担载量可达36.90 mg/g,酶活性为54.47 U/g,是Novozym®435的2.5倍。Gossl等[43]将乙炔官能化的碳酸酐酶(CA)和HRP通过Cu(I)催化的点击化学1,3-偶极环加成反应(CuAAC)固定在叠氮化物官能化的介孔SiO2纳米颗粒表面,分别得到99和103 mg/g的担载量。Wei等[44]采用二硫键还原剂(TCEP)使胰蛋白酶带上巯基,随后通过硫醇—烯键产生化学反应,使其与三甲基丙烯酸酯(TRIM)整料表面存在的双键成功键合,使用2个月后的酶活性仅下降13.8%。该化学修饰固定化策略的出现,填补了由于自身缺乏共价结合能力的酶无法进行固定化技术的空白,但该方法的修饰过程中有较多不可控因素,并有改变酶蛋白结构使其酶活降低的可能性。目前有通过生物信息学对修饰位点进行突变的报道[45],以及预测或选取条件较温和的生物相容性无铜点击反应法等[46],以达到降低固定化酶催化活性损失的目的。
2.5 界面聚合技术
界面聚合技术是指发生在两种互不相容或性质差异明显的界面之间的缩聚反应,具有不可逆性,最早被用于化学合成研究中[47]。随着科技的发展,衍生自乳液体系研究的界面聚合微囊技术为固定化提供了一种新的思路:即将目的酶溶解在相应的体系中,通过复杂的界面相互作用缩聚形成的微型囊泡,或水滴状颗粒将酶蛋白包裹,再分离出体系。2015年,Qu等[48]在Pickering乳液的油/水界面处进行多巴胺的选择性聚合后,与脂肪酶通过共价键结合。由于脂肪酶的界面激活效应,固定化脂肪酶的比活性较游离态的酶和包封于胶体水核中的酶分别高出了8和1.4倍,且具有出色的操作稳定性和可回收性,15个循环后仍保留了86.6%的原始酶活。之后,Qu等[49]首次将疏水性Fe3O4@SiO2纳米颗粒(NPs)用于油包水磁性Pickering乳液体系的包埋固定化,发现其比活力最大可得24.17 U/mL。乳液液滴较高的比表面积和底物通过液滴界面时的有效传质系数以及合理设计的疏水性载体,使酶在具有较高的生物催化活性的同时,兼备良好的可回收性和可循环性。Qi等[50]在全新的界面生物催化系统中结合金属有机骨(MOFs)ZIF -8和Pickering界面体系,利用脂肪酶负载的ZIF -8(质量分数为1%)对聚苯乙烯为芯材的Pickering乳液油滴进行固化。相较于游离酶和ZIF -8固定化酶,该油滴状固定化酶的催化活性分别高出了2.51和1.6倍,在6批次反应后仍剩余80%的原始酶活,且能够通过调整水油比例以及油滴大小,使其能参与更多种类的催化反应。
2.6 单酶纳米颗粒技术
单酶纳米颗粒技术(SENs),区别于酶蛋白固定化方法,是将每个酶分子用一种纳米级的有机或无机多孔网状聚合物包围,从而形成的纳米级酶颗粒。2003年单粒酶的概念被首次提出,Kim等[51]将两种胰蛋白酶包埋固定于一种多孔有机-无机材料中,每个酶分子如同被单独封锁于一个四壁非常薄的纳米级的集装箱中。由于其具有的多孔性结构,且尺寸为纳米级别,因此溶剂分散性良好,单粒酶(SENs)与反应底物之间的传质阻力也很小,固定化酶的催化活性得到了有效提升,但其纳米单体尺寸较小,因而不易从反应体系中被回收分离,实际应用中考虑与特殊属性的材料联合使用,以简化其回收和循环使用的相关操作。例如Yang等[52]通过表面改性和原位水聚合,制备了被导电聚合物Fe3O4复合材料外壳包裹着的超顺磁性SENs,在pH为9.0时,相较于游离酶约20%的剩余酶活,仍可保留大约85%的原始活性。此外,多孔的金属有机骨架材料(MOFs)[53]也是单酶固定化的有效策略,如2013年,He等[54]在转化酶、GOx和HRP周围成功形成丙烯酰胺纳米凝胶复合体,使级联反应的周转率提高了10倍以上。2014年,Chapman等[55]成功将ZIF -8和ZIF-10与细胞色素C共同沉淀,之后成功整合了溶菌酶、HRP、脲酶和脂肪酶。随着单粒酶制作工艺被更深层的研究,Cai等[56]通过两步操作,合成了模拟过氧化物酶活性的Cu(OH)23D笼状(SCs)结 构 纳 米 颗 粒,以H2O2为 底 物 时,Cu(OH)2SCs的米氏常数值(Km=0.199)比HRP的低约20倍。由于CuOH2SCs中较高的表面积与体积比,该新型纳米人工酶明显对H2O2具有更好的亲和力,且比先前报道的不规则形状的SENs的催化参数值高大约2倍[57]。随后Beloqui等[58]通过添加少量蔗糖,建立了无需对酶预处理的一步合成SENs的方法,其凝胶层厚度和孔径大小等重要参数可以通过改变合成方法的反应条件来进行微调,且对于来自Aspergillus niger的GOx,13.9 nm孔径的SEN8相较于9.0 nm的SEN11,催化常数(kcat)从(32.2±3.8)s-1提高到(98.1±10.9)s-1,而随着GOx-SEN外壳厚度的增加,最佳pH从5.5变为更宽的范围(pH 4~8)。
2.7 其他新型固定化技术
由于科技发展的日新月异,固定化酶被应用于更加复杂多样的生产环境,更多类型的固定化策略也亟待被开发。随着学科间的相互渗透,在遵守固定化酶制备原则的基础上,研究者们将磁性、金属[59]、光、等离子体和辐射等新兴技术引入修饰方法中,制得了各种高活力的固定化酶。例如,Maria等[59]将脂肪酶固定在柠檬酸修饰的磁铁矿纳米粒子上,催化醇酯交换反应24 h后,即可实现94%的最大转化率,使用10批次后的酶活性没有明显降低。在光催化方面,Zhu等[60]在紫外光辐照下通过夺氢-耦合反应,将异丙基硫氧蒽酮半蒎醇(ITXSP)休眠基接枝到低密度聚乙烯(LDPE)表面。随后,该休眠基在可见光催化下生成的碳自由基再次引发双官能单体聚乙二醇双丙烯酸酯(PEGDA)的接枝聚合,将脂肪酶原位固定在高度交联且厚度可调的水凝胶网络层中。该固定化酶催化葡萄糖与棕榈酸的酯化反应时,7个循环后的酯转化率仅降低了不到2%,仍高于45%。而Wang等[61]通过可见光引发的接枝聚合反应,首先在低密度聚乙烯(LDPE)薄膜上将β-葡萄糖苷酶(BG)原位包裹在较薄的聚乙二醇(PEG)水凝胶内层,随后在PEG内层上重新引发接枝聚合,使得纤维素酶共价附着在外层刷状聚丙烯酸钠(PAANa)表面。BG作为纤维素酶的补充与其分层共固定后,两者酶活力相较于游离酶分别增加了82%和20%,双酶系统在6次循环后,仍可维持89%的总原始活性。此外,大部分载体和酶自身的水油双亲性、溶解度等物化性质均有很大不同,尤其多孔性载体材料与游离酶之间由于各种作用力所引起的接触性障碍,使得固定化过程中体系分散程度不佳,而微波辐射辅助的固定化技术可以在固定化反应原液的准备和固定化反应过程中,借助其对溶液或酶结构的产生影响,促进反应溶液的均匀分散,例如Holyavka等[62]通过研究发现:在151 J/m外辐射强度下,游离态的菠萝蛋白酶的催化活性(0.52 U/mL)有明显增加,且对壳聚糖基质固定化效果并无任何影响。
2.8 基于3D打印技术的酶固定化方法
增材制造(通常称为3D打印)是一种新兴的自下而上的制造技术,可以快速实现复杂几何形状的原型设计[63]。它已被广泛用于工业设计、建筑、组织工程和其他领域[64-68]。3D打印的主要优势在于它可以直接构建成本低廉的复杂结构[69],尤其是一些内部结构参数复杂,具有多孔或者复杂孔道的结构,不会造成材料损失[70]。打印的组件是可调的(图1),仅通过更改原始设计图形,即可实现完全或部分修改组件[71-72]。

图1 用于酶固定化的不同三维结构3D打印支架的数字图像[71]Fig.1 Digital images of different 3D structural scaffolds printed for enzyme immobilization[71]
工程技术的进步和减小的打印设备成本为采用3D打印创建的功能性设备(如生物反应器,组织工程支架和检测器)提供了操作基础[14,72-73]。熔融沉积建模(FDM)技术[74-75]采用可挤出的热塑性塑料,例如丙烯腈-丁二烯-苯乙烯(ABS)[76]和聚乳酸(PLA)[77],按照挤压、烧结、熔融、光固化和喷射等方式逐层堆积制造出三维实体,具有简单且成本低的优点[78]。数十年来,用于3D打印的新型材料不断地被研发出来,包括混入纤维素纳米晶体[79]的PLA,碳纤维增强的PLA(C-PLA)[80],石墨烯[81]和二维过渡金属碳氮化合物[82]。此外,印刷材料的化学修饰[83-86]也引起了越来越多的关注:因其具有高效[87-88],低成本及可操作性强等特点,有潜力成为低成本的固定化载体,既而通用制造平台被应用于在生物催化领域[89]。例如Cesar等[14]设计了一种将酶固定在3D打印的连续流设备上的方法(图2)。Manfred等[90]将来自芽孢杆菌属微生物的酯酶(Est)和醇脱氢酶(ADH)添加到琼脂糖基油墨中,用于温度可控的简单3D打印过程,在60℃条件下经历15 min打印过程后,酯酶(EstⅡ)和醇脱氢酶(ADH)分别保留有(96±12)%和(85±9)%的原始酶活。

图2 FDM打印机打印尼龙材料的过程及功能化修饰后的3D打印反应器[14]Fig.2 Printing process of nylon employing an FDM printer and ustration of the post-functionalisation of the printed reactor[14]
此外,Kennedy等[13]将葡萄糖氧化酶和乳酸氧化酶固定在采用FDM技术制成的检测系统中,通过酶促氧化反应,可在线监测大鼠脑细胞外葡萄糖和乳酸浓度。该ABS流式反应器进样量为20 μL,其检测限对葡萄糖低至0.060 mmol/L,而对乳酸低至0.059 mmol/L,适用于对精准度要求较高的活体大鼠的体内动态监测;Ye等[91]报告了一种利用增材制造技术的新型酶固定化策略,经食人鱼溶液,过氧乙酸和硅烷偶联剂修饰后,比表面积增加了3.63倍(2.2 m2/g),实验证明:可对青霉素G酰基转移酶(PGA),蛋白酶,糖苷酶和脂肪酶进行有效固定。其中PGA催化反应的最终产量可达185.6 mmol/L,乳糖苷酶催化反应的最终乳糖产量为142 g/L,10次循环使用后,PGA的酶活性保留率为88%,糖苷酶的保留率为92.8%。
在传统方法基础上拓展思路,结合新兴技术衍生出的新型固定化策略,虽然部分固定化策略的工艺略显复杂且单体造价稍高,但是通过各种修饰方法创造的表面微环境明显增强了载体与酶之间的特异性吸附,以及酶与底物之间的专一性。此外,新技术不仅能有效降低杂酶的吸附量,提高初始酶活,而且在反应过程中可以最大程度地维持较高的催化活性。以上优势使其普遍具有较高的重复利用率,从而大大降低了工业化生产成本,因此,新型方法不仅适用于各种对灵敏度要求严苛的反应器,在工业化应用方面同样具有较高的性价比和潜力。为方便比较传统酶固定化方法和新型酶固定化方法的优劣,将新型酶固定化策略与传统策略的各项性质比较归纳于表1。
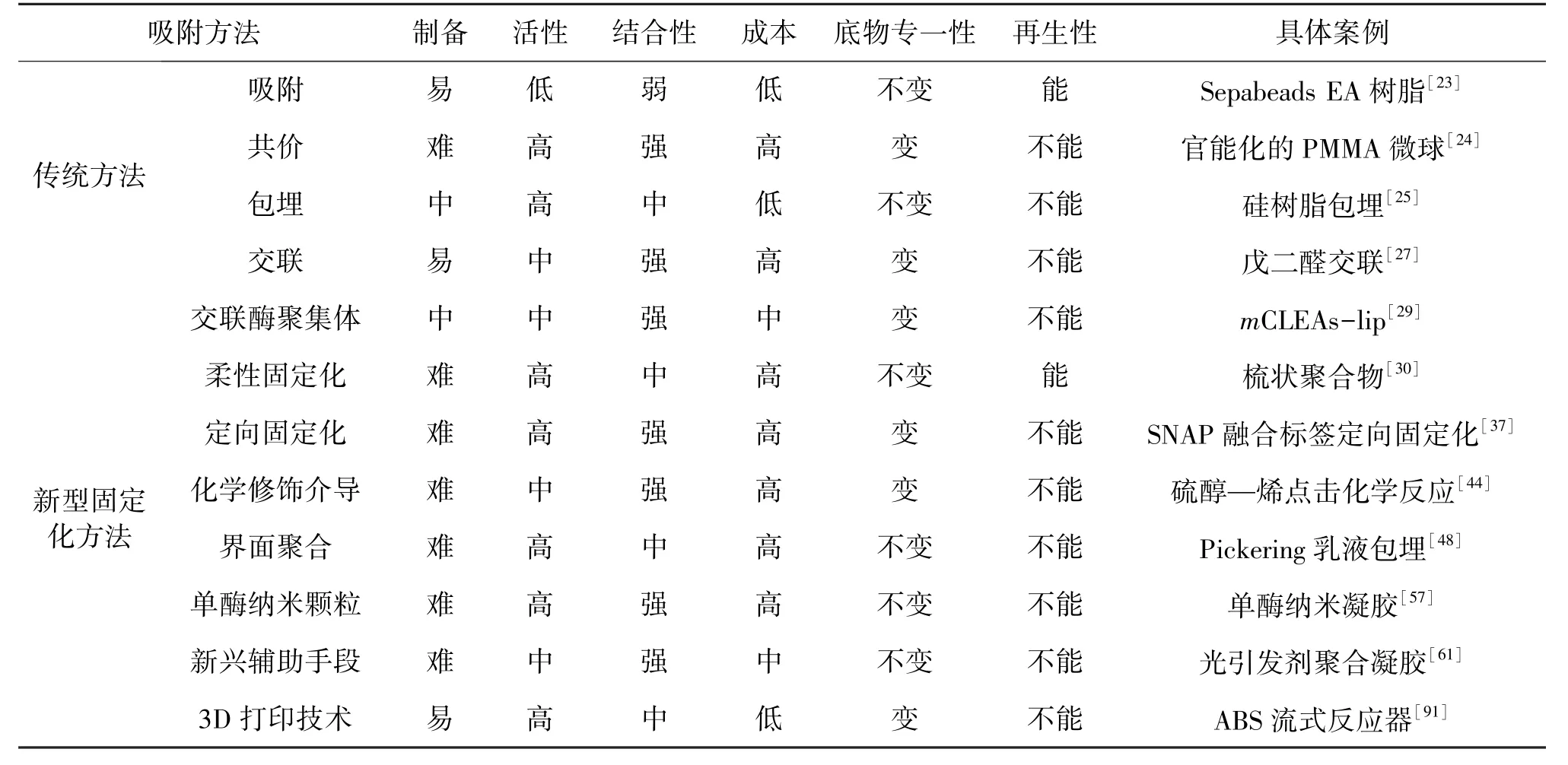
表1 酶固定化策略优劣比较Table 1 The characteristics and examples of various immobilized methods
3 固定化酶的应用
生物酶制剂具有高度的区域性和立体选择性,其催化效率高、副产物少,可催化类型多样且无需引入大量有毒试剂,因此,对环境十分友好。而新型固定化技术进一步提高了酶制剂的催化活力和操作稳定性,简化了回收过程,有效减少了其在实际工业应用中的使用成本。酶的各种优良特性已经被有针对性地应用于各个领域的实际生产中,其中食品行业由于对安全要求严苛,较早使用无毒的酶催化剂进行生产。固定化脂肪酶作为广泛使用的催化剂之一,由于界面激活效应而最早被用于长链脂肪酸的选择性合成中[92],随后酸解和酯化催化特性被分别应用于高酸酱油渣油的脱酸[93]和风味酯的合成[94]中。另外,β-半乳糖苷酶也是最早被应用于乳品生产的典型案例,可有效降低鲜奶中的乳糖含量,避免乳糖不耐症患者饮用鲜奶后产生不适症状,以及解决低温乳制品因乳糖结晶所导致的口感问题[95]。此外,固定化酶在灵敏度要求较高的传感器以及医药行业、环境治理和生物能源等领域也有着大量的应用案例。纳米多孔材料优化了生物传感器的灵敏度和反应时间,由于其简单、专一且成本较低,已成为目前传感器领域的研发热点[96]。
高纯度药物中间体是医药行业关注的热点之一,Di等[97]首次通过离子液体强化的酶法在水性介质中由衣康酸(IA)合成生物质来源中间体衣康酸二甲酯(DI)。该研究表明:采用离子液体1-氟-3-丁基咪唑鎓六氟磷酸盐([bmim][PF6])进行预处理,可以在不影响其酯化活性的前提下,使得脂肪酶的水解活性受到很大程度的抑制,产物DI的产率可达64.3%。在医疗领域,由于具有3D交联网络和可调节的理化特性,采用环保、高效的氧化还原酶引发的自由基聚合反应制备的水凝胶和微/纳米凝胶,被广泛应用于组织工程和药物输送系统中[98]。Attieh等[99]将HRP固定在玻璃微珠上,加入H2O2和乙酰基丙酮(ACAC),形成催化循环,继而引发聚合反应,可制得尺寸为50~300 nm且具有良好的结合性,印迹效应和选择性的分子印迹聚合物(MIPs)。该反应以4-乙烯基吡啶(4-VP)为功能单体,2,4-二氯苯氧基乙酸(2,4-D)为印迹分子,形成可逆复合物,使用1,4-双丙烯酰哌嗪(PDA)作为交联剂,使得功能单体以印迹分子为模板进行聚合。
通过动植物油与短链醇之间酶催化的酯交换反应,获得的脂肪酸烷基酯混合物被认为是可以直接使用或与衍生自石油的柴油混合使用的环境友好型可再生柴油能源。相比于传统固定化策略,Fan等[100]将米赫根毛霉脂肪酶定向固定在磁化的树状分子上,使得固定化酶稳定性增强且兼具磁性,通过载体自带的磁性将固定化酶从反应体系中快速分离,有效解决了传统固定化载体从反应器中分离难的应用障碍。Marta等[101]使用了3种具有不同特异性和酒精耐受性的商品酶Lipozyme®RM IM,Lipozyme®TL IM和Novozym®435,以乙醇为酰基受体,催化低品质鱼油的酯交换反应,其中使用Novozym 435和过量的乙醇(质量比为1∶1.82)可获得最高产量(82.91%),在连续使用10个周期后,其最大活性损失仅为16%。
在环境工程领域,多铜氧化酶家族中的漆酶被广泛应用于降解工业废水和有毒化合物中。20世纪80年代,漆酶的降解能力被首次发现后,早期采用凝胶杂化等方法结合传统材料海藻酸钠对漆酶进行固定化,但其操作稳定性和重复使用率并不理想。庞仕龙[102]将带有羧酸基团的Cu -MOF和Zr-MOF金属有机骨架介孔材料与石墨烯气凝胶合成的复合材料用于漆酶的吸附固定化,经此法固定化后的酶具有良好的操作稳定性和重复性,且酶活的回收率在水相中被封存3周后,仍能达到55%以上。Chauhan等[103]将漆酶固定在电荷可切换的pH响应型银纳米颗粒上,并使用普朗尼克(Pluronic)表面活性剂稳定其表面微环境,有效降低了活化能,并扩大了其反应温度的范围。
4 总结和展望
近年来,众多领域的科研人员在对新型生物酶的固定化策略研发过程中,不断寻找具有创新性的突破口,使大量研究成果不断涌现,同时越来越多的科研理论成果被投入到实际工业化生产中,有效缓解了传统化工对生态环境的压力。虽然新型固定化载体以及其方法在一定程度上克服了传统固定化方法中出现的弊端,但在工业化应用方面仍存在诸多问题,例如材料参数缺乏普适性,对于不同类型的酶和反应体系,其最佳固定化方法都不尽相同,无法修改其中的细节性参数,在一定程度上增加了酶被应用于不同化工生产中的初期试错成本。另一方面,研究人员对固定化参数影响酶催化效率的深层机制仍缺乏理解,大部分采用虚拟环境下的模拟无法完全还原反应的实时动态,因此,对于材料研发较为宏观,缺乏基于反应过程进行预判的细节性设计。因此,笔者建议尝试建立更全面准确的固定化酶载体和策略数据库,使研究人员通过该数据库可以全方位地获得某种酶分子在实际操作中遇到的操作问题,从而使得设计出的固定化策略能够对所参与的各类反应和反应器类型具有更强的普适性。并且注重生物信息学、材料、物理和化学等相关学科更深层次的相互渗透,例如:在化学修饰介导的固定化策略中,可以寻找生物相容性更高或者对环境更为友好的催化剂类型;不断完善酶的生物信息数据库,从而为开发还原度更高的动态模拟分析软件提供更为坚实的理论基础。同时,结合更多物理化学方面的材料表征方法,从酶和载体两方面探究固定化酶各项参数在真实反应体系中影响酶促反应的机制,以期加强固定化技术前期研发设计对载体细节的把控性和对结果的可预判性。随着生物技术和材料、化工、机械和计算机等相关学科之间的渗透发展,固定化技术的研发正逐步向精细化方向发展,对固定化策略效果的要求从粗略定性转向追求精确量化,从随机无序转向定性可控。为获得种类功能更加丰富和全面的高品质固定化酶,采用新兴技术增强固定化策略的目的性、设计性以及经济性,并将其有效应用于连续化工业生产,仍是生物工程领域研究人员为之不懈努力的方向。
