多形汉逊酵母启动子的挖掘
2022-02-23纪璐璐马小军高教琪周雍进
纪璐璐,马小军,高教琪,周雍进
(1.中国科学院 大连化学物理研究所,辽宁 大连116023;2.中国科学院大学,北京100049)
资源短缺和环境恶化迫切需要我们探索新型能源以满足日益增长的生物炼制需求。甲醇是结构最为简单的饱和一元醇,主要来自煤化工行业的副产物或由天然气催化合成[1-2],生产工艺成熟,是一种来源广泛、价格低廉的可替代原料[3]。与常用的发酵底物糖类相比,甲醇具有更强的还原力,能够为异源产物合成提供更多驱动力[4]。由于我国“缺油、少气、富煤”的能源结构特点,近年来国内的甲醇产能和产量大幅增长,因此低价格、高能效的甲醇有望成为潜在的理想细胞工厂能够利用的底物[5]。
自然界中,存在一类天然甲醇代谢微生物——甲基营养型微生物,它们能够利用各种还原碳化合物(如甲醇等)作为碳源和能量来源[6],主要包括甲基营养型细菌和甲醇酵母。目前,已鉴定出四类甲醇酵母,包括巴斯德毕赤酵母(Pichia pastoris)、白色念珠菌(Candida albicans)、多形汉逊酵母(Ogataea polymorpha)和甲醇毕赤酵母(P.methanolica)[7],其中,多形汉逊酵母以其独特的甲醇吸收特性[7]、较短的发酵周期、较高的发酵菌体密度以及耐高温的优良特性,成为外源基因表达及细胞工厂构建的优良宿主。
首先,汉逊酵母作为一种耐热微生物,其最适生长温度为37~43℃,最高生长温度可达48℃[8-9],在45~50℃的条件下可将葡萄糖和木糖转化为乙醇[10]。其次,作为异源蛋白生产的优良宿主,汉逊酵母能够避免分泌高度糖基化的蛋白,而且少量的内源蛋白分泌也有利于分泌产物的下游加工过程[11-13]。最后,多形汉逊酵母还被广泛用于过氧化物酶体改造的基础研究[9]。过氧化物酶体是由一层单位膜包裹的囊泡,在甲醇代谢过程中发挥重要作用。在葡萄糖代谢与甲醇代谢的转换过程中,汉逊酵母细胞内过氧化物酶体的数量、大小、形态以及合成与降解均受到较为严谨的调控[14-16],使其成为极具吸引力的模型生物,用以研究过氧化物酶体形成和降解的分子机制。
因此,无论是作为高附加值产物和蛋白的异源生产宿主,还是用于研究甲醇与过氧化物酶体代谢的相关机制,汉逊酵母均需要进行不同程度的分子改造。特别是在代谢工程改造中,代谢通路基因的简单共表达并不能实现目标产物的高产,所以需要优化目标产物通路的通量来消除动力学瓶颈[17-18]。同样,复杂的合成生物学也需要多个基因协调、平衡共表达[19-21]。为了满足这些需求,需要多种不同强度、不同特性的启动子来协调多基因的表达。在汉逊酵母表达系统中应用最多的内源启动子是汉逊酵母甲醇氧化酶(methanol oxidase)基因启动子PMOX(PAOX)和组成型强启动子——甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase)基因启动子PGAP[22],质膜H+-ATP酶(plasma membrane H(+)-ATPase)基因启动子PPMA1也在多形汉逊酵母中成功应用于异源蛋白的表达[13,23]。但是,总体来说,在汉逊酵母中,可用的内源启动子相对匮乏,无法满足高效遗传改造的需求。
因此,本研究中,笔者挖掘汉逊酵母糖酵解途径及活性氧(ROS)防御途径相关基因启动子,通过报告基因GFPuv检测启动子的表达强度,分析其对不同碳源(葡萄糖和甲醇)响应情况,确定启动子的表达类型与强度,从而拓宽汉逊酵母代谢改造过程中启动子的选择范围,为汉逊酵母利用不同碳源(葡萄糖和甲醇)进行代谢工程改造以及基础应用研究提供参考。
1 材料与方法
1.1 试剂与仪器
高保真PCR酶、2×Taq Master Mix(Dye Plus)和一步克隆酶(ClonExpressⅡOne Step Cloning Kit)等,南京诺唯赞生物科技有限公司;T4 DNA连接酶等,TaKaRa公司;质粒提取试剂盒、PCR纯化试剂盒以及胶回收试剂盒,Omega公司;甲醇、葡萄糖、琼脂粉、无水KH2PO4、各种氨基酸试剂以及各种维他命试剂等,生工生物工程(上海)股份有限公司;(NH4)2SO4、MgSO4以及痕量金属(trace metal)溶液中的各种试剂,天津市科密欧化学试剂有限公司;蛋白胨、酵母粉,Oxoid公司。
ZQZY-CF8型三层组合全温振荡培养箱,上海知楚仪器有限公司;Heraeus Multifuge X1R型离心机,赛默飞世尔科技(中国)有限公司;1-15PK型高速冷冻离心机,Sigma公司;Eppendorf 5425型离心机,Eppendorf公司;HPX -9052 MBE型电热恒温培养箱,上海博讯实业有限公司医疗仪器设备厂;DW-86L626型超低温保存箱,Haier公司;超纯水系统,美国Millipore公司;TECAN SPARK酶标仪,帝肯(上海)贸易有限公司;TaKaRa PCR仪,宝生物工程(大连)有限公司。
1.2 菌株及培养条件
大肠杆菌DH5α菌株用于质粒构建与培养。多形汉逊酵母野生型菌株NCYC 495-3购于中国普通微生物菌种保藏管理中心(CGMCC 2.2412),作为宿主表达GFPuv。
DH5α菌株在LB培养基(5 g/L酵 母 粉、10 g/L胰蛋白胨、10 g/L NaCl)中培养。汉逊酵母菌株在SD培养基(20 g/L葡萄糖、6.7 g/L YNB)或基础盐离子培养基(20 g/L葡萄糖或10 g/L甲醇、14.4 g/L KH2PO4、2.5 g/L(NH4)2SO4、0.5 g/L MgSO4·7H2O)中进行培养,必要时补充响应的氨基酸成分。细胞均在37℃、220 r/min条件下振荡培养。
1.3 启动子-GFPuv表达菌株的构建
筛选基因起始密码子上游1 000 bp的序列作为启动子序列,使用诺唯赞高保真酶进行PCR扩增,所需引物及序列如表1所示。以PAOX启动子作为对照组。表达载体构建流程如图1所示。

图1 重组质粒构建策略Fig.1 Map of recombinant plasmid construction strategy

表1 构建表达载体的引物Table 1 Primer list for expression vector construction

续表
将PCR扩增得到的启动子及GFPuv片段进行 融合PCR得到启动子GFPuv片段,通过T4 DNA连接酶或一步克隆酶进行连接,转入大肠杆菌进行筛选与培养,采用相应抗生素(博来霉素及氨苄青霉素)筛选,得到的克隆转化子经验证后,提取质粒酶切再验证后,阳性克隆送生工生物工程(上海)股份有限公司基因测序;最终将测序结果正确的质粒通过电转化[24]的方法转化至汉逊酵母NCYC 495-3中进行筛选。
1.4 报告基因活性检测
汉逊酵母GFPuv表达菌株在基础盐培养基(葡萄糖为碳源)37℃预培养48 h,以不含碳源的基础盐培养基洗涤细胞2次,初始OD600为0.1转接至20 mL以葡萄糖为碳源的基础盐培养基(初始OD600为0.2转接至20 mL以甲醇为碳源的基础盐培养基)。绿色荧光蛋白的荧光值一般在16~18 h时达到最大[25],但考虑到汉逊酵母在甲醇培养基中生长较为缓慢,因此在葡萄糖培养基中培养24、48及72 h取样检测生物量OD600及荧光值,在甲醇培养基中培养72 h取样检测生物量OD600及荧光值。取稀释至OD为0.2~0.8的细胞培养液2 mL,使用紫外分光光度计在600 nm处检测吸光度;细胞洗涤1次且稀释至OD600约为1.0,取200 μL至96孔板,使用酶标仪(TECAN SPARK)进行检测。
2 结果与讨论
2.1 糖酵解及活性氧(ROS)防御途径启动子的挖掘
汉逊酵母菌株DL -1和菌株NCYC 495均进行了全基因组测序与分析[15,26],根据基因组序列信息,通过BLAST比对得到汉逊酵母中目标基因的序列信息。酵母启动子长度可能存在较大差异。酿酒酵母启动子长度的中位数为455 bp,也有其他长度如800和1 000 bp等的例子,启动子长度因基因种类、功能不同而存在差异[27]。毕赤酵母使用1 000 bp长度或者从起始密码子与上游基因之间的序列作为启动子[18,28]。本研究使用起始密码子上游1 000 bp序列作为汉逊酵母启动子,并利用SnapGene软件设计相应目标启动子的上下游引物。
本研究中,笔者筛选汉逊酵母糖酵解途径及ROS防御途径启动子,以GFPuv为报告基因,构建不同启动子驱动的表达载体,以不同碳源(葡萄糖与甲醇)为底物摇瓶培养,以荧光值大小评价启动子表达强度,具体流程如图2所示。

图2 实验流程示意Fig.2 Overview of experimental flow
2.2 GFPuv激发光谱与发射光谱
GFPuv是绿色荧光蛋白GFP的一种变体,本研究中,使用GFPuv作为报告基因用以启动子表达水平的检测,因此,有必要对报告基因GFPuv的激发光谱与发射光谱进行全波长扫描,以确定GFPuv的最大激发波长与发射波长。
图3为GFPuv激发与发射光谱。由图3可知,GFPuv激发和发射光谱的最大峰分别在396和510 nm处,与文献[29]的结果一致。因此,选择396 nm作为激发波长,510 nm作为发射波长。

图3 报告基因GFPuv激发光谱与发射光谱Fig.3 Excitation and emission spectra of reporter gene GFPuv
2.3 糖酵解途径启动子筛选
多形汉逊酵母糖代谢途径启动子及其表达水平如图4所示。
图4(a)为多形汉逊酵母糖代谢途径。根据图4(a)筛选出代谢过程中所涉及部分基因的启动子,构建不同的质粒表达载体,通过检测其荧光值,即可得到不同启动子的表达强度,为汉逊酵母代谢工程改造提供更多调控元件。
2.3.1 单一葡萄糖培养条件下启动子的表达
通过报告基因GFPuv表达检测启动子的强度,菌株以葡萄糖作为碳源,在基础盐培养基中进行培养,用酶标仪检测24、48及72 h时的荧光强度。糖代谢途径涉及的启动子表达GFPuv的强度如图4(b)~(d)所示。
由图4(b)~(d)可知:在单一葡萄糖条件下,启动子PADH2-1与PGAP驱动的GFPuv荧光强度较高,且表达强度分别是相同条件下PAOX的9倍(图4(d))和7倍(图4(b));其中,启动子PADH2-1在48 h时表达水平最高,启动子PGAP在72 h时表达水平略高于48 h时的表达水平。启动子PAOX与PPFK2驱动的报告基因表达相当,都不足PGAP表达强度的20%。启动子PGPI与PPGM1表达强度则更弱,并且启动子PPGM1的表达强度随培养时间的延长而减弱。
2.3.2 单一甲醇培养条件下启动子的表达
将选定的糖酵解途径启动子克隆到绿色荧光蛋白GFPuv,并以甲醇为碳源培养菌株,并检测培养72 h报告基因荧光强度,结果如图4(c)所示。
由图4(c)可知:以甲醇为唯一碳源培养72 h,启动子PADH2-1与PGAP驱动的GFPuv表达量与葡萄糖条件下的相比基本相当,无明显差异且表达水平高,与PAOX在甲醇条件下的表达强度相当,启动子PADH2-1与PGAP表现为强组成型表达;启动子PAOX在甲醇条件下驱动GFPuv表达量远高于葡萄糖条件(约10倍)下的,表现出明显的强甲醇诱导型;启动子PPGM2在甲醇条件下的表达水平约为葡萄糖条件下的4倍,同样表现为甲醇诱导型,但其表达强度远低于PAOX启动子。启动子PPFK2及PGPI在2种碳源(葡萄糖和甲醇)条件下,表达水平无明显差异,为组成型表达,但表达强度分别为PGAP启动子的20%和10%。

图4 汉逊酵母糖代谢途径启动子及其表达水平Fig.4 Promoters of sugar metabolism pathway in O.palymorpha and its expression level
2.4 ROS防御途径启动子筛选
甲基营养酵母在甲醇氧化、氧化磷酸化及其他代谢过程中会产生过氧化氢(H2O2)和ROS,为防止其对细胞成分造成不可逆氧化损伤[15],细胞自身会启动ROS防御机制,以消除其影响。
2.4.1 单一葡萄糖条件下培养ROS防御途径的启动子表达
以ROS途径(图5(a))涉及启动子驱动报告基因GFPuv的表达,单一葡萄糖条件下荧光检测结果如图5(b)所示。由图5(b)可知:以葡萄糖为碳源对汉逊酵母进行摇瓶培养,4种超氧化物歧化酶驱动的报告基因均有表达,只是表达强度存在明显差异,其中以PSOD1表达强度最高,比同条件下PAOX驱动的基因表达量高约2倍;而PSOD2、PSOD3和PSOD4启动的GFPuv表达量则明显弱于PAOX驱动的基因表达量,约为PAOX的50%,且PSOD3随培养时间的延长,其表达强度呈下降趋势;启动子PGLR、PMSR在葡萄糖条件下基本无荧光表达。
2.4.2 单一甲醇条件下培养ROS防御途径的启动子表达
以ROS防御途径涉及启动子驱动报告基因GFPuv的表达,单一甲醇条件下的荧光检测结果如图5(c)所示。由图5(c)可知:除启动子PGLR外,ROS防御途径涉及的启动子在以甲醇为唯一碳源时,启动子均可以启动报告基因的表达,并显示出差异,其中,以PSOD1为启动子,表达强度最高,约为PAOX的1.5倍,是葡萄糖条件表达强度的5倍多,表现出明显的甲醇诱导作用,属于强甲醇诱导型启动子,与之前的研究结果[15]一致,但与巴斯德毕赤酵母[18]中超氧化物歧化酶(SOD)启动子的表达强度则明显不同。启动子PSOD3也表现为明显的甲醇诱导特性,但表达强度弱,约为PAOX的20%。PSOD2和PMSR的表达则更弱。启动子PSOD4的表达也较弱,但在2种碳源(葡萄糖和甲醇)条件下的表达相当,为组成型表达。
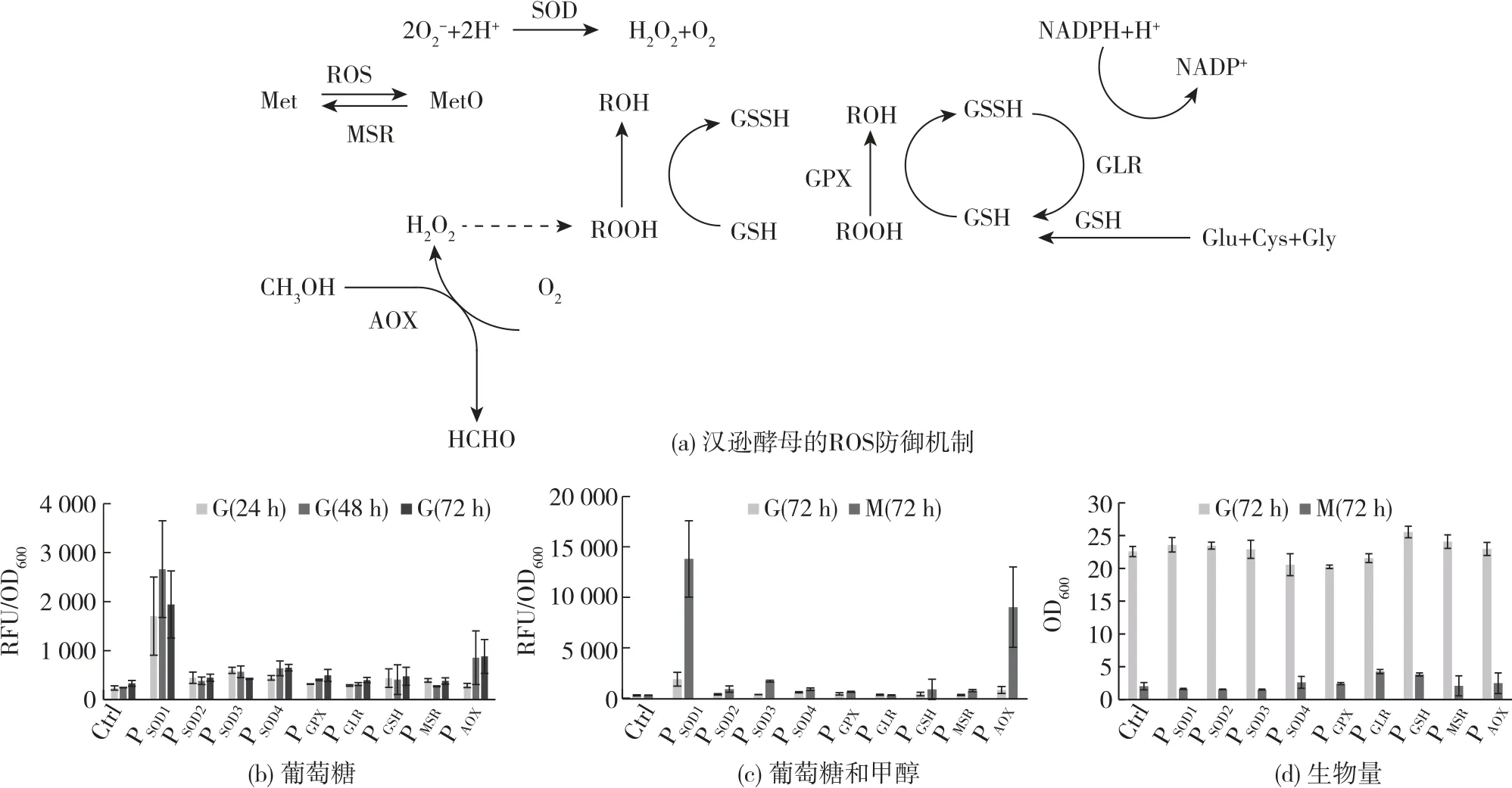
图5 汉逊酵母ROS防御机制启动子及其表达水平Fig.5 Promoters of ROS defense pathway in O.polymorpha and expression level
ROS防御途径主要的生化功能是解除ROS的毒性,因为细胞在葡萄糖消耗过程中产生的ROS及在甲醇氧化过程中产生的H2O2对细胞产生压力与毒性,这促进了途径中的相关基因表达。因此,细胞中的ROS可作为PSOD1的激活剂,在各种胁迫条件下激活相应转录因子从而促进基因的表达。
综上所述,在挖掘鉴定的系列糖酵解途径和ROS防御途径中的相关启动子,根据各启动子启动表达的GFPuv荧光强度与空白对照的倍数差异,定义了强、中弱型启动子。同时,依据启动子在葡萄糖或甲醇条件下的荧光强度差异,以区分组成型和甲醇诱导型启动子,以方便后续改造过程中应用。
通过挖掘糖酵解途径和ROS防御途径关键基因启动子,鉴定了系列可用于代谢工程改造的不同强度启动子,结果见表2。
由表2可知:在甲醇诱导型表达的系列启动子PPGM2、PSOD1、PSOD2、PSOD3、PGSH和PMSR中,以PSOD1表达强度最高,PSOD3、PPGM2次之,其他启动子表达强度则很弱;在组成型表达启动子PPFK2、PGPI、PPGM1、PADH2-1、PADH2-2、PGAP、PGPX和PSOD4中,PADH2-1和PGAP表达水平最高,其余启动子表达水平均较弱。强启动子对于蛋白以及异源代谢途径酶的表达具有重要作用。同时,弱启动子可用于合成生物学应用中多基因共表达的平衡,代谢途径过程中转录水平的精细调节以及代谢改造工程中旁路基因的弱化表达。

表2 汉逊酵母糖酵解和ROS防御途径启动子分类Table 2 Grouping of O.polyporpha glycolysis and ROS defense promoters
3 结论与展望
启动子长度对于代谢途径的组装及表达尤为重要,直接决定了基因表达盒的大小,从而影响了酵母转化效率与整合效率。选用1 000 bp长度的启动子进行活性检测,初步筛选获得了若干可用于后续代谢工程改造的启动子种类。但为了减少PCR扩增的突变概率和尽可能缩短基因表达盒大小,后续研究需要借助启动子分析软件对其功能区进行分析与预测,指导启动子的截短实验,期望得到最短序列启动子而使得基因表达水平较高。同时,在对短序列启动子表达强度检测时,将报告基因的表达与酵母的生长相耦联,得到不同启动子在细胞生长不同时期的表达情况。
综上所述,作为重要的甲醇酵母,多形汉逊酵母能够天然利用葡萄糖、木糖和甲醇等多种碳源,为其成为理想细胞工厂的底盘细胞奠定了良好基础。特别是它在以甲醇作为碳源生产高附加值化学品的过程中,甲醇诱导型的启动子对基因在甲醇条件下的表达具有重要的指导作用。因此,本研究的结果将为促进汉逊酵母葡萄糖代谢与甲醇代谢转换奠定理论基础,拓展了汉逊酵母代谢工程应用的底物谱,也为实现甲醇生物转化以及甲醇代谢基础研究提供参考和应用工具。
