γ射线照射导致心肌细胞坏死性凋亡和线粒体损伤
2022-02-23张愉宁董曦文陈肖华胡舜英
张愉宁,张 幻,周 颖,董曦文,易 静,陈肖华,胡舜英,王 华
(1.军事科学院军事医学研究院辐射医学研究所,北京 100850;2.广西医科大学附属肿瘤医院乳腺及骨、软组织肿瘤内科,广西 南宁 530021;3.解放军总医院心血管病医学部,北京 100853)
放射性心脏病常见于胸部恶性肿瘤患者接受放疗后[1],早期通常无明显临床症状,晚期病变往往会波及心包膜、心肌、心脏传导系统及冠状动脉等[2],引起较重的临床症状,患者的晚期生存率和生活质量下降。对其发病机制的研究,倾向于认为血管内皮细胞是射线损伤的靶细胞[3],心肌细胞变性和心肌纤维化是继发于内皮细胞受损后心脏微循环障碍所致[4]。而心肌细胞作为心脏结构及功能重要组成部分被归属为放射不敏感细胞,放射对心肌细胞本身的影响、损伤机制、心肌细胞损伤在放射性心脏病发生发展中发挥的作用尚不十分清楚。其他放射性疾病的研究发现,辐射暴露常诱导多种并存的死亡方式,除引起细胞凋亡外,也会诱导细胞坏死[5]。细胞坏死认为是一种不受调控的细胞被动死亡方式,然而越来越多的研究发现,细胞中存在着控制坏死的专用分子通路[6],其中研究最为深入的是坏死性凋亡。坏死性凋亡是一种主动调节细胞坏死的方式,在形态上与坏死极为相似,但却受到具体的通路调节,主要通过受体相互作用蛋白激酶 1(receptor protein-interacting kinase 1,RIPK1)和RIPK3传递死亡信号,募集并磷酸化混合系列蛋白激酶样结构域(mixed series protein kinase-like domain,MLKL),磷酸化的MLKL多聚化并定位在细胞膜上,影响细胞膜的完整性和通透性,导致细胞发生坏死[7]。有研究显示,坏死性凋亡参与缺血再灌注过程中心肌损伤的病理生理过程[8],心肌细胞坏死性凋亡在心肌重塑和心力衰竭中也扮演着重要角色[9],通过RIPK1抑制剂、基因调控对坏死性凋亡进行调节可发挥心肌保护作用[10]。然而坏死性凋亡是否参与辐射诱导的心肌细胞死亡尚不清楚。诸多研究表明,坏死性凋亡的发生在很大程度上取决于线粒体功能紊乱和氧化应激水平増高[11-12]。线粒体酪氨酸磷酸化酶 1(protein tyrosine phosphatase,mitochondrial 1,PTPMT1)是一种新发现的仅存在于线粒体内的蛋白酪氨酸磷酸酶,广泛定位于各种组织的线粒体内膜[13]。已有研究表明,PTPMT1参与调控构成线粒体内膜的重要磷脂成分之一——心磷脂的合成路径,PTPMT1表达下降可影响心磷脂的合成,从而严重干扰线粒体功能[14-15],但PTPMT1在辐射引起的细胞损伤中发挥的作用尚不清楚。本研究将通过单次照射H9C2细胞,检测线粒体功能的改变和坏死性凋亡的相关表型,探讨γ射线照射对大鼠心肌细胞生物学特性的影响。
1 材料与方法
1.1 细胞、试剂和仪器
大鼠心肌H9C2细胞,美国菌种保藏中心。DMEM培养基、活性氧(reactive oxygen species,ROS)检测试剂盒和BCA蛋白质定量检测试剂盒,美国Thermo公司;胎牛血清,美国Gemini公司;HEPES液,北京索莱宝公司;RIPA裂解液和线粒体膜电位(mitochondrial membrane potential,MMP)(ΔΨm)检测试剂盒,北京碧云天公司;细胞线粒体膜通道孔(mitochondrial permeability transition pore,mPTP)检测试剂盒,上海杰美基因公司;APCAnnexinⅤ/7AAD凋亡检测试剂盒,美国Biogens公司;CCK-8细胞活性检测试剂盒,上海奕衫生物公司;兔抗大鼠活化的胱天蛋白酶3(cleavedcaspase 3)多抗、兔抗大鼠胱天蛋白酶原3(procaspase 3)多抗、兔抗大鼠RIPK1单抗、兔抗大鼠RIPK3单抗和兔抗大鼠磷酸化MLKL(phosphorylated MLKL,p-MLKL)单抗(一抗),美国CST公司;兔抗大鼠GAPDH单抗、兔抗大鼠β肌动蛋白多抗和兔抗大鼠PTPMT1多抗(一抗),美国Proteintech公司;辣根过氧化物酶(horseradish peroxidase,HRP)标记的山羊抗兔IgG单抗(二抗),北京中杉金桥公司;ECL发光液,北京庄盟公司。Power-Pac164-5050电泳仪,美国Bio-Rad公司;BD FACS Calibur流式细胞仪,美国BD公司;x-Light V3转盘共聚焦,意大利CrestOptics公司;7500Fast实时荧光定量PCR系统,美国ABI公司;Tanon5200全自动化学发光成像仪,上海天能公司;Varioskan Flash光谱扫描多功能读数仪,美国Thermo公司。
1.2 H9C2细胞培养和传代
以含有10%胎牛血清与1% HEPES液的DMEM为H9C2细胞的培养基,置37℃,5% CO2的恒温细胞培养箱中培养,隔2 d换液,待细胞生长至80%~90%融合度时传代,传代比例为1∶3。
1.3 H9C2细胞60Co γ射线照射
将生长状态良好的H9C2细胞以3×108L-1的密度接种于6孔板内(每孔2 mL)或96孔板中(每孔100 μL)置37℃,5% CO2的恒温细胞培养箱中培养24 h使细胞均匀贴壁后,使用60Co γ射线分别以5,10和20 Gy进行照射,并设未照射的细胞对照组。细胞照射后立即换液。
1.4 CCK-8法检测H9C2细胞存活率
H9C2细胞经5,10和20 Gy照射后24,48和72 h,每剂量和时间点设4复孔,吸弃基,加含有10% CCK-8的新鲜培养基100 mL继续培养3 h,在激发光波长为450 nm的条件下,使用光谱扫描多功能读数仪检测吸光度值(A450nm)。以含有10% CCK8的新鲜培养基为空白组,计算细胞存活率。细胞存活率(%)=(照射组A450nm-空白组A450nm)/(对照组A450nm-空白组A450nm)×100%。
1.5 流式细胞术检测H9C2细胞凋亡率
H9C2细胞经10和20 Gy照射后24,48和72 h,收集上清,300×g离心5 min收集培养上清中的细胞;随后用不含EDTA的胰酶消化贴壁的H9C2细胞,300×g离心5 min,收集细胞。两者混合,用PBS漂洗2次。加5 μL APC-AnnexinⅤ混匀,室温避光孵育15 min;再加入7AAD细胞核染料5 μL混匀,室温避光孵育10 min。洗涤后加入PBS 400 μL重悬细胞,用流式细胞仪分析计算H9C2细胞凋亡率〔早期凋亡细胞(APC+7AAD-)和晚期凋亡或坏死细胞(APC+/7AAD+)〕。
1.6 Western印迹法检测H9C2细胞凋亡和坏死性凋亡相关蛋白表达
H9C2细胞经10和20 Gy照射后24,48和72 h,用RIPA裂解液裂解,10 000×g,4℃离心10 min,吸取上清液。BCA法测定蛋白质浓度,调整各组蛋白质浓度,以4∶1体积比加入5×上样缓冲液混匀,100℃煮10 min。将提取的蛋白质进行聚丙烯酰胺凝胶电泳,上样量为20 μg,分离后转至PVDF膜,5%脱脂奶粉室温封闭2 h。后加入一抗(抗活化的胱天蛋白酶3、胱天蛋白酶3酶原、RIPK1、RIPK3、p-MLKL和PTPMT1抗体,稀释比均为1∶2000),4℃孵育过夜。TBS-T清洗4次,每次5 min。随后加HRP标记山羊抗兔IgG抗体(二抗)(1∶5000),室温孵育1 h,TBS-T洗膜4次,每次5 min。以β肌动蛋白或GAPDH作为内参对照。发光、显影、扫描后分析蛋白条带积分吸光度(integrated absorbance,IA),待测蛋白表达水平用IA待测蛋白/IAGAPDH比值或IA待测蛋白/IAβ肌动蛋白比值表示。
1.7 流式细胞术检测H9C2细胞活性氧水平
H9C2细胞经5,10和20 Gy照射后6,24和48 h,弃细胞培养上清,更换2 mL不含血清的DMEM培养基,每孔加入10 mmol·L-1的H2DCFDA探针 2 μL,使探针终浓度为 10 μmol·L-1,孵 育30 min。孵育结束后用PBS清洗3次,胰酶消化,离心弃上清;用PBS漂洗2次,加PBS 400 μL重悬细胞,用流式细胞仪检测H9C2细胞绿色荧光强度,反映ROS水平。
1.8 免疫荧光和流式细胞术检测H9C2细胞线粒体膜电位
按线粒体膜电位免疫荧光检测试剂盒操作说明操作。H9C2细胞经5,10和20 Gy照射后24和48 h,吸弃细胞培养上清,加新鲜细胞培养液1 mL和JC-1染色工作液0.5 mL,充分混匀,孵育20 min;孵育结束后吸弃上清,用预冷1×JC-1缓冲液洗涤2次,加细胞培养液1 mL,在激光共聚焦显微镜下观察贴壁细胞,进行定性分析。红色荧光减弱、绿色荧光增强表明MMP(ΔΨm)下降。
H9C2细胞经5,10和20 Gy照射后24和48 h,胰酶消化细胞,离心弃上清,用PBS漂洗1次,加培养基500 μL重悬细胞;再加染色工作液500 μL,混匀置培养箱避光孵育20 min;4℃,300×g离心5 min,弃上清,用预冷1×缓冲液漂洗2次;1×缓冲液500 μL重悬细胞,用流式细胞仪检测H9C2细胞中红色荧光细胞百分数,对MMP的变化进行定量分析。
1.9 免疫荧光和流式细胞术检测H9C2细胞线粒体膜通道孔开放状态
按mPTP检测试剂盒操作说明操作。H9C2细胞经5,10和20 Gy照射后24和48 h,小心吸弃细胞培养上清,加37℃预热的清理液0.5 mL清洗1次,再加染色工作液0.5 mL,充分混匀,置培养箱37℃避光孵育20 min,孵育结束后吸弃染色工作液,用预热的清理液清洗2次,通过激光共聚焦显微镜观察贴壁细胞,进行mPTP开放定性分析。绿色荧光减弱表明mPTP活性增强、开放增加。
H9C2细胞经5,10和20 Gy照射后24和48 h,胰酶消化细胞,离心弃上清,使用PBS漂洗1遍,加清理液500 μL重悬细胞,离心弃上清,再加工作液500 μL,混匀置培养箱避光孵育20 min,用预热的清理液漂洗2次后重悬细胞,用流式细胞仪检测H9C2细胞绿色荧光强度,对mPTP活性进行定量分析。
1.10 统计学分析
2 结果
2.1 γ射线照射对H9C2细胞存活率的影响
CCK-8法检测结果(图1)显示,与细胞对照组相比,20 Gy照射各时间组,5和10 Gy照射48和72 h组H9C2细胞存活率降低(P<0.05)。

Fig.1 Effect of γ ray irradiation on cell survival of H9C2 cells by CCK-8 kit.H9C2 cells were irradiated by60Co γ ray of 5,10 and 20 Gy and the cell survival rates were detected after 24,48 and 72 h,respectively.±s,n=3.*P<0.05,compared with cell control group.
2.2 γ射线照射对H9C2细胞凋亡率的影响
流式细胞术检测结果(图2)显示,与细胞对照组相比,20 Gy照射各时间组H9C2细胞凋亡率增加(P<0.01);10 Gy照射48和72 h组H9C2细胞凋亡率增加(P<0.05)。

Fig.2 Effect of γ ray irradiation on apoptosis of H9C2 cells by flow cytometry.See Fig.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.3 γ射线照射对H9C2细胞凋亡相关蛋白表达的影响
Western印迹实验结果(图3)显示,与细胞对照组相比,20 Gy照射各时间组H9C2细胞活化的胱天蛋白酶3水平显著升高(P<0.05),胱天蛋白酶原3水平显著降低(P<0.05);10 Gy照射48 h组H9C2细胞活化的胱天蛋白酶3水平显著升高(P<0.05);10 Gy照射24 h组H9C2细胞胱天蛋白酶原3水平显著降低(P<0.05)。

Fig.3 Effect of γ ray irradiation on levels of cleaved-caspase 3 and pro-caspase 3 in H9C2 cells by Western blotting.See Fig.1 for the cell treatment.IA:integrated absorbance.B1 and B2 were the semi-quantitative results of A1(24 h),A2(48 h)and A3(72 h).x±s,n=3.*P<0.05,compared with cell control group.
2.4 γ射线照射对H9C2细胞坏死性凋亡相关蛋白表达的影响
Western印迹实验结果(图4)显示,与细胞对照组相比,20 Gy照射48 h组H9C2细胞p-MLKL,RIPK1和RIPK3水平显著升高(P<0.01);10 Gy照射24 h组H9C2细胞RIPK1水平显著升高(P<0.05);10 Gy照射48 h组H9C2细胞p-MLKL水平显著升高(P<0.01);5 Gy照射各时间组H9C2细胞RIPK3水平显著升高(P<0.01),5 Gy照射48 h组H9C2细胞p-MLKL水平显著升高(P<0.05);提示γ射线照射诱导H9C2细胞发生坏死性凋亡。
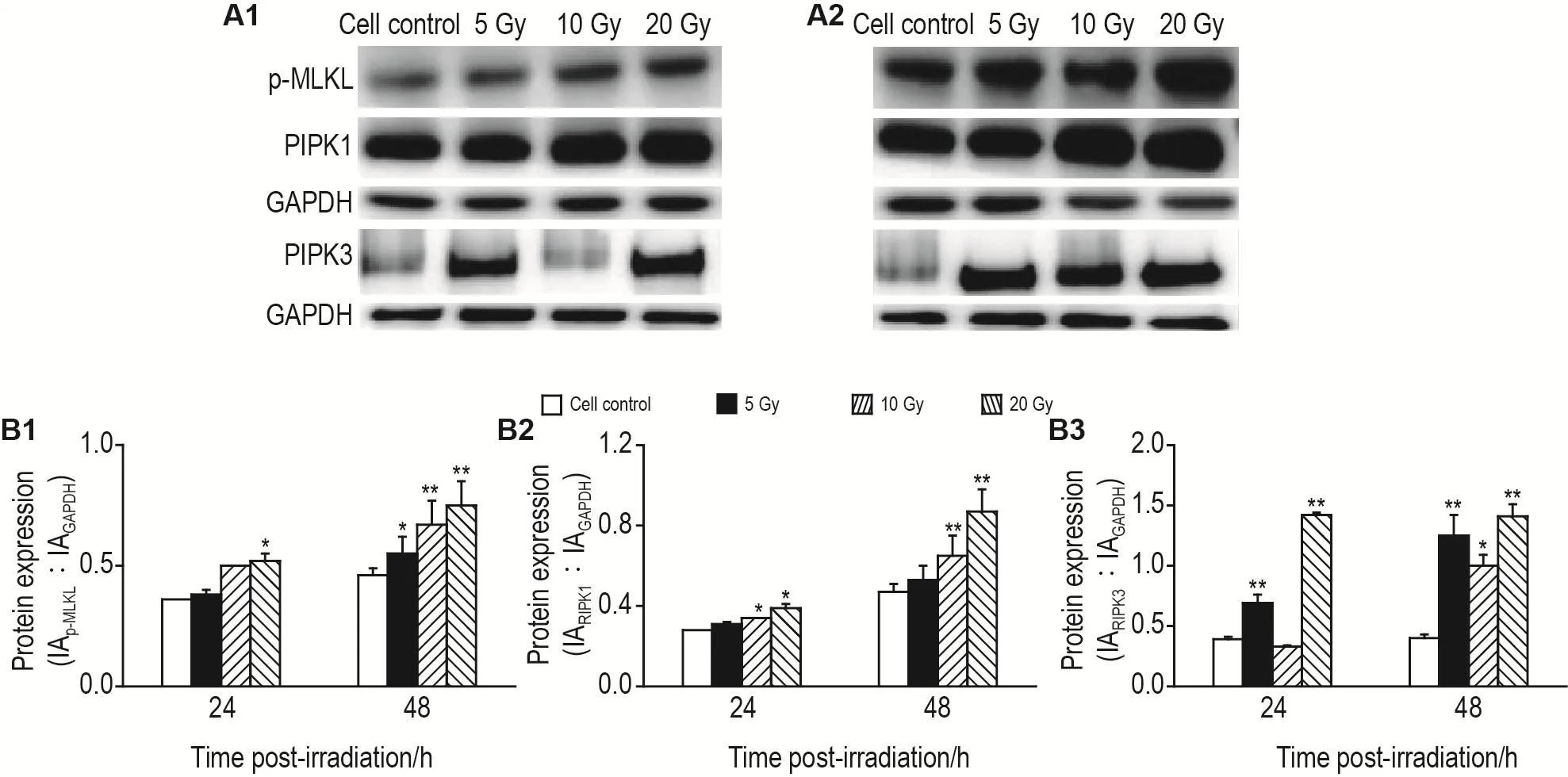
Fig.4 Effect of γ ray irradiation on levels of receptor protein-interacting kinase 1(RlPK1),RlPK3,and phosphorylated mixed series protein kinase-like domain(p-MLKL)in H9C2 cells by Western blotting.See Fig.1 for the cell treatment.B1,B2 and B3 were the semi-quantitative results of A1(24 h)and A2(48 h).±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.5 γ射线照射对H9C2细胞产生活性氧的影响
流式细胞术结果(图5)显示,与细胞对照组相比,20 Gy照射各时间组H9C2细胞绿色荧光强度明显增加(P<0.01);10 Gy照射各时间组H9C2细胞绿色荧光强度明显增加(P<0.05);5 Gy照射24 h时间组H9C2细胞绿色荧光强度明显增加(P<0.05);表明γ射线照射导致H9C2细胞ROS产生增加。

Fig.5 Effect of γ ray irradiation on reactive oxygen species(ROS)production in H9C2 cells by flow cytometry.See Fig.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
2.6 γ射线照射对H9C2细胞线粒体膜电位的影响
流式细胞术结果(图6)显示,与细胞对照组相比,20 Gy照射各时间组H9C2细胞红色荧光比例明显减少(P<0.01);10 Gy照射48 h组H9C2细胞红色荧光比例明显减少(P<0.01);5 Gy照射48 h组H9C2细胞红色荧光比例明显减少(P<0.05),表明γ射线照射会导致H9C2细胞线粒体去极化,线粒体膜电位下降。激光共聚焦显微镜定性观察(图7)结果与上述结果一致。

Fig.6 Effect of γ ray irradiation on mitochondrial membrane potential(MMP)in H9C2 cells by flow cytometry.See Fig.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.

Fig.7 Effect of γ ray irradiation on MMP in H9C2 cells by laser confocal fluorescence imaging.See Fig.1 for the cell treatment.The intensity variation of red or green fluorescence represents the change of MMP in H9C2 cells after different treatment.
2.7 γ射线照射对H9C2细胞线粒体膜通道孔开放的影响
流式细胞术结果(图8)显示,与细胞对照组相比,20 Gy照射各时间组H9C2细胞绿色荧光强度明显减弱(P<0.01);10 Gy照射48 h组H9C2细胞绿色荧光强度明显减弱(P<0.01);5 Gy照射48 h组H9C2细胞绿色荧光强度明显减弱(P<0.05);提示γ射线照射导致H9C2细胞mPTP开放、活性增强。激光共聚焦显微镜定性观察(图9)结果与上述结果一致。

Fig.8 Effect of γ ray irradiation on mitochondrial permeability transition pore(mPTP)opening in H9C2 cells by flow cytometry.See Fig.1 for the cell treatment.B was the quantitative result of A.±s,n=3.*P<0.05,**P<0.01,compared with cell control group.

Fig.9 Effect of γ ray irradiation on mPTP opening in H9C2 cells by laser confocal fluorescence imaging.SeeFig.1 for the cell treatment.The intensity variation of green fluorescence represents the change of mPTP opening in H9C2 cells after different treatment.
2.8 γ射线照射对H9C2细胞PTPMT1表达水平的影响
Western印迹实验结果(图10)显示,与细胞对照组相比,10和20 Gy照射组各时间点H9C2细胞PTPMT1水平均显著降低(P<0.01),5 Gy照射24 h组H9C2细胞PTPMT1水平显著降低(P<0.05)。

Fig.10 Effect of γ ray irradiation on levels of protein tyrosine phosphatase,mitochondrial 1(PTPMT1) in H9C2 cells by Western blotting.See Fig.1 for the cell treatment.B were the semi-quantitative result of A1(24 h)and A2(48 h).±s,n=3.*P<0.05,**P<0.01,compared with cell control group.
3 讨论
放射性心脏病是一种常见的放疗不良反应,严重影响患者的预后和生活质量,其发生发展包含了炎症浸润、电离损伤和凋亡水平增加等多种机制。在对大鼠进行心脏局部照射的在体实验中证实,线粒体在辐射效应中发挥着非常重要的作用,照射后心脏中分离的心肌线粒体存在功能障碍,表现为mPTP开放增加和线粒体膜电位降低[16]。本研究用体外照射模型证实,照射可损伤H9C2细胞线粒体,引起mPTP开放、活性增加,线粒体膜电位降低,ROS产生增多。
心肌作为终末分化永久性细胞,过去常认为心肌细胞的死亡形式主要为坏死和凋亡,Kung等[17]提出坏死性凋亡是一种介导心血管疾病中细胞死亡的新形式,坏死性凋亡过程主要涉及RIPK1,RIPK3和MLKL等几个关键分子。有研究指出,坏死性凋亡在心肌梗死缺血再灌注心肌重塑和心衰中至关重要[18],RIPK3缺陷小鼠在发生缺血再灌注后,心肌细胞死亡减少,心衰情况改善,其中RIPK3通过介导钙调蛋白依赖激酶Ⅱ的激活,触发线粒体通透性转换孔开放以及心肌细胞坏死性凋亡[9]。此外有研究证明,Nec-1作为一种特异性坏死性凋亡抑制剂,还可减少过氧化物诱导的H9C2心肌细胞死亡,该作用机制在于Nec-1延迟了mPTP的开放[19]。MLKL作为坏死性凋亡的终末效应分子,磷酸化的MLKL多聚化并锚定在细胞膜上,是引起细胞死亡的关键点,目前对于MLKL如何触发细胞死亡仍不清楚。有研究指出,p-MLKL会与磷脂酰肌醇脂类和心磷脂结合,直接渗透细胞膜[20]。本研究表明,大剂量γ射线照射可在短期内对心肌细胞造成严重损伤,降低细胞活性,导致心肌细胞数量减少,细胞的损伤包括凋亡和坏死性凋亡,其中流式结果显示受照后心肌细胞多为晚期凋亡和坏死,早期凋亡所占比例较少,结合免疫印迹结果48 h凋亡相关蛋白变化不明显,而坏死性凋亡相关蛋白差异具有显著性,因此推测照射引起的H9C2细胞死亡存在动态的变化过程,起初凋亡占主要部分,随着时间延长坏死性凋亡所占比例上升居于主导地位。照射诱导的心肌细胞凋亡与坏死性凋亡之间的关系与动态变化,尚需进一步实验证实。
PTPMT1是一类在各类组织的线粒体广泛分布的酪氨酸磷酸酶,参与调控作为构成线粒体内膜的重要磷脂成分之一的心磷脂的合成路径,PTPMT1表达下降会影响心磷脂的合成,从而干扰线粒体功能并改变线粒体形态[14]。本研究发现,照射可引起H9C2细胞PTPMT1表达降低,提示PTPMT1分子可能参与调控心肌细胞坏死性凋亡和线粒体损伤。
本研究基于放射性损伤与线粒体功能紊乱、氧化应激、以及坏死性凋亡发生之间的紧密联系,结合PTPMT1分子在线粒体结构和功能中发挥的重要作用,采用激光共聚焦、流式、Western印迹等方法,系统探究了γ射线照射对大鼠心肌细胞H9C2一系列表型的影响。研究还存在许多不足和局限性。例如,本研究以心肌细胞系作为研究对象进行体外实验,实验结果尚需用原代细胞或体内实验证实;尚未充分探讨照射导致的心肌细胞凋亡和坏死性凋亡的相互关系;未揭示照射损伤心肌细胞线粒体和坏死性凋亡之间的明确关系以及PTPMT1在其中发挥作用的具体分子机制。上述问题均有待进一步研究。
