新型AMPA受体调节剂LCX001抗阿片受体激动剂TH-030418致呼吸抑制效应及其机制
2022-02-23樊永正苏瑞斌
高 翔,樊永正,2,代 威,雍 政,苏瑞斌
(1.军事科学院军事医学研究院毒物药物研究所,抗毒药物与毒理学国家重点实验室,神经精神药理学北京市重点实验室,北京 100850;2.联勤保障部队第九九一医院,湖北 襄阳 441000)
以阿片类药物为代表的镇痛药在疼痛治疗和诱导麻醉中的作用迄今无可替代,但该类药物引发的严重呼吸抑制是导致死亡的重要原因之一[1-2]。虽然临床上常用阿片受体拮抗剂(如纳洛酮等)缓解阿片致呼吸抑制,但其在缓解呼吸抑制效应的同时会抵消阿片的镇痛效果,同时存在给药方式单一、持续时间短、剂量不可控、需长时间密切观察等缺点[3-5],用于对抗呼吸抑制需要进一步评估和密切监测患者各项体征。因此,探索可以改善阿片致呼吸抑制且并不影响阿片镇痛效果的新型药物,成为目前该类药物开发的新思路,对于提升临床急救能力具有重要意义。
近几年众多文献报道,α-氨基-3-羟基-5-甲基-4-异唑丙酸(α-amino-3-hydroxyl-5-methyl-4-isoxazole-propionic acid,AMPA)受体调节剂可调控呼吸功能,该受体在延髓呼吸中枢的前包钦格复合体广泛分布,对调节呼吸节律的形成和呼吸冲动的传导发挥着关键作用[6-7]。有研究证实,以安帕金(ampakine)为代表的AMPA受体调节剂可对抗多种药物所致的呼吸抑制[8-11]。AMPA受体调节剂潜在的镇痛、改善学习记忆和神经保护等作用,与纳洛酮等阿片受体拮抗剂相比,具有显著优势,可使救治预后更好,有望成为非特异性抗阿片致呼吸抑制药物。
基于以上研究背景,本研究所药物化学研究室在美国RespireRx制药公司研发的苯甲酰胺类系列AMPA受体调节剂基础上,通过三维药效团模型模拟、计算机辅助设计及虚拟筛选,合成了200余个潜在AMPA受体调节剂。其中代号为LCX001的化合物(相对分子质量275,化学结构见图1)可显著提高阿片受体激动剂TH-030418所致小鼠急性死亡生存率[12-15],且具有良好的镇痛及镇静效应,同时放射性配体受体结合实验显示,LCX001与[3H]AMPA无竞争结合,但可以明显促进[3H]AMPA与AMPA受体结合,表明LCX001通过调节AMPA受体发挥效应,属于AMPA受体调节剂范畴,而非AMPA受体激动剂或拮抗剂[14-15]。提示LCX001是具有抗阿片致呼吸抑制效应的新型AMPA受体调节剂。本研究拟在前期初步筛选基础上,对LCX001抗呼吸抑制量效和时效关系进行系统评价,并初步探讨其作用机制。

Fig.1 Chemical structure of LCX001.
1 材料与方法
1.1 动物、试剂和仪器
SD大鼠,雄性,SPF级,体重为180~220 g,由军事医学研究院动物中心提供,合格证号:SCXK-(军)2016-004。大鼠饲养环境室温24~26℃,湿度40%~60%,12 h/12 h交替日光灯照明。每笼5只,自由饮水与摄食。所有操作均按照军事医学研究院实验动物管理与使用委员会的要求(批准编号:06-2018-020)进行。
LCX001(批号:140315,纯度≥98%)和TH-030418(批号:030418,纯度≥98%)由本所药物化学研究室合成;羟丙基-β-环糊精(批号E0276),北京凤礼精求商贸有限责任公司;邻苯二甲醛(批号:BCCC3481,纯度≥99%),美国Sigma公司。LCX001加入20%羟丙基-β-环糊精溶液配制至所需浓度;TH-030418溶于注射用水配制至所需浓度;以上药物均现用现配。
清醒动物肺功能测定仪,美国DSI公司;雷度ABL90系列血气分析仪和PICO70自吸式动脉血气针,丹麦Radiometer公司;安捷伦1200系列液相色谱工作站,美国Agilent公司;DECAYDEⅡ电化学检测器,荷兰Antec Leyden公司;HoneyCombTM低温样品自动收集器、M2250型微透析探针(透析膜长度4 mm)和Ω-型脑内引导管,美国BAS公司;CMA120清醒动物装置和CMA100微量注射泵,瑞典CMA公司;ODS-C18色谱柱(10 μm,250 mm×4.6 mm),迪马公司。
1.2 大鼠肺功能参数检测
肺功能检测仪由气泵、透明有机玻璃箱、压力传感器、信号调节器和计算机操作界面相继连接组成。气泵用于连续输送新鲜空气和滤除二氧化碳,压力传感器测量气压变化,信号调节器将气压变化通过电信号转化成具体数据在计算机界面上显示。设置清醒无创大鼠肺功能检测仪参数和监测条件:气泵流量1.5 L·min-1,增益放大倍数1倍,传感器放大倍数200倍,采样功率500 Hz。将大鼠随机分为呼吸抑制模型组(iv给予TH-030418 20 μg·kg-1)和模型+LCX001治疗组(iv给予TH-030418 20 μg·kg-1,17.5 min后,iv给予LCX001 5,10和20 mg·kg-1),每组5只。检测时,将大鼠置于透明有机玻璃箱内适应30~40 min,而后连续测定15 min稳定的肺功能参数〔每分钟通气量(minute ventilation,MV)、呼吸频率(respiratory frequency,RF)和呼吸气道阻力(enhanced pause,EP)〕的基础值,而后取出大鼠按分组给药,给药后放回检测仪中,2.5 min后开始记录肺功能参数,随后每5 min测1次,直至62.5 min。将给予TH-030418前17.5,12.5和7.5 min 3个时间点的大鼠肺功能参数测量值的平均值定义为基线值,实验结果以各测量值与基线值的百分比表示。
1.3 大鼠血气参数检测
将大鼠随机分为模型组(iv给予TH-030418 20 μg·kg-1构建呼吸抑制模型)和模型+LCX001治疗组(iv给予TH-030418 20 μg·kg-1,5 min后,iv给予LCX001 5,10和20 mg·kg-1),每组5只。分别在给予TH-030418后0,5,15,30和60 min 5个时间点,使用雷度PICO70血气针自大鼠腹主动脉取血(每次取血量>65 μL),每次取血后1~2 min内将血气针置入ABL90血气分析仪进样口,仪器自动取样并检测动脉血气参数〔氧分压(oxygen partial pressure,pO2)、二氧化碳分压(carbon dioxide partial pressure,pCO2)和血氧饱和度(oxygen saturation,sO2)〕值。
1.4 脑微透析和高效液相-电化学(high-performance liquid chromatography-electrochemical detector,HPLC-ECD)法检测大鼠海马神经细胞外液谷氨酸(Glu)含量
1.4.1 大鼠脑立体定位置管手术
大鼠ip给予水合氯醛(400 mg·kg-1)麻醉,俯卧固定于立体定位仪上,充分暴露颅骨表面,定位海马区的坐标:前囟后5.2~5.5 mm,前囟侧4~6 mm,颅骨面下5 mm。将引导管垂直插至指定深度,用小螺钉和牙科水泥将其固定于颅骨面。术后缝合皮肤,将大鼠单笼饲养,恢复48~72 h后用于脑微透析实验。
1.4.2 大鼠药物处理和脑微透析样品采集
置管手术后,将大鼠随机分为4组,分别为溶剂对照组(ip给予20%羟丙基-β-环糊精)、LCX001对照组(ip给予LCX001 20mg·kg-1)、模型组(iv给予TH-030418 20 μg·kg-1)和模型+LCX001 预防组(ip给予LCX001 20 mg·kg-1,15 min后,iv给予TH-030418 20 μg·kg-1),每组5只。给药前,将大鼠用乙醚轻微麻醉,小心取出引导管内的钢芯,将M2250型探针置入导管内,探针事先通过连接管与微量注射泵和收集器的收集针相连,微量注射泵以1.5 μL·min-1的速度灌流人工脑脊液(mmol·L-1:NaCl 124,KCl 5,NaH2PO41.25,MgSO42,葡萄糖10,CaCl22和NaHCO326),收集器温度调至4°C。将大鼠置于观察笼内,每20 min收集25 μL脑脊液微透析样品,平衡透析1 h后,加入2 μL邻苯二甲醛进行衍生化反应10 min,随后取25 μL样品进行HPLC-ECD检测。呼吸抑制组在给药前测定40 min的Glu基础释放值变化,并于0 min时间点给予TH-030418,随后每隔20 min收集一次透析样品并进行HPLC-ECD检测至160 min;溶剂对照组、LCX001对照组和模型+LCX001预防组在给药前测定20 min的Glu基础释放值变化,并于-15 min时间点分别给予溶剂和LCX001(其中模型+LCX001预防组在给LCX001 15 min后给予TH-030418),15 min后取样1次并进行HPLC-ECD检测,随后每隔20 min收集1次透析样品并进行HPLC-ECD检测至160 min。将给予TH-030418前40和20 min 2个时间点的谷氨酸含量测量值的平均值定义为基线值,实验结果以各测量值与基线值的百分比表示。实验结束后处死大鼠,取全脑切片检查,剔除置管位置不正确的动物数据。
1.4.3 HPLC-ECD色谱条件
流动相配制:磷酸二氢钠15.59 g,辛烷磺酸钠0.1605 g,EDTA0.0080 g,氯化钾 0.1493 g,溶于800 mL双蒸水中,加入乙腈10 mL,乙酸5 mL,甲醇150 mL,用浓磷酸调pH至3.32,加双蒸水定容至1000 mL,0.22 μm微孔滤膜抽滤。电化学检测器的工作电极为玻璃碳,参比电极为固态Ag/AgCl,检测工作电压为±0.70 V,流速为1.0 mL·min-1,柱温28℃。
1.5 统计学分析
2 结果
2.1 LCX001对TH-030418致呼吸抑制大鼠肺功能参数的影响
iv 给予 TH-03041820 μg·kg-1后,大鼠立即出现静止不动、木僵、竖尾和呼吸困难等现象。肺功能参数检测结果(图2)显示,在给予TH-030418后2.5 min时间点,呼吸抑制模型组大鼠MV和RF均比基础值显著下降(P<0.01),而EP则比基础值显著增加(P<0.01)。而模型+不同剂量LCX001组大鼠MV,RF和EP均表现出一定程度的改善,其中模型+LCX001 20 mg·kg-1组在给予 TH-030418后22.5 min时间点MV迅速上升至与基础值相近的水平(P=0.67);与相同时间点模型组相比,模型+LCX001 20 mg·kg-1组在37.5~62.5 min MV显著升高(P<0.01),在22.5~62.5 min RF显著升高(P<0.01);在47.5,57.5和62.5 min EP显著降低(P<0.05),提示LCX001能有效逆转TH-030418所致的大鼠MV和RF下降及EP升高,改善大鼠呼吸状态。
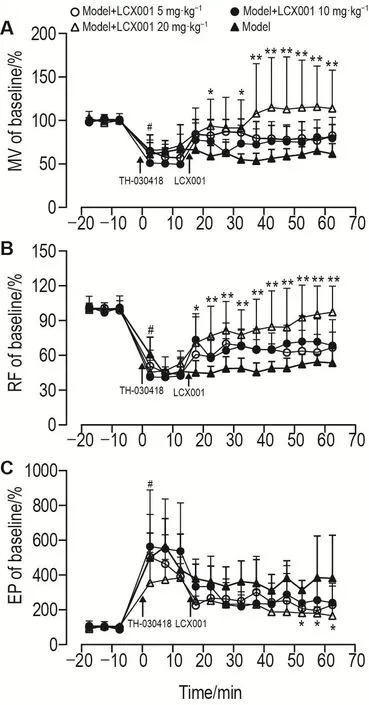
Fig.2 Effects of LCX001 on lung function parameters in TH-030418-induced respiratory depression rats.Rats were divided into respiratory depression model group that was iv given TH-030418 20 μg·kg-1(0 min)and model+LCX001 groups[iv given TH-030418 20 μg·kg-1(0 min),15 min later iv given LCX001 5,10 or 20 mg·kg-1].The mean of the measured values at-17.5(17.5 min before TH-030418 administration),-12.5 and-7.5 min was defined as 100%.All the data were normalized to a percentage by dividing the mean.Lung function parameters were measured every 5 min.MV:minute ventilation;RF:respiratory frequency;EP:enhanced pause.±s,n=5.*P<0.05,**P<0.01,compared with the corresponding time point of model group;#P<0.01,compared with-7.5 min of model group.
2.2 LCX001对TH-030418致呼吸抑制大鼠动脉血气参数的影响
大鼠 iv 给予 TH-030418 20 μg·kg-1后腹主动脉血颜色暗红,给予LCX001 20 mg·kg-1后15,30和60 min由暗红逐渐变为鲜红。动脉血气参数检测结果(图3)显示,在给予TH-030418后5 min,模型组大鼠pCO2显著上升,pO2和sO2显著下降(P<0.01),提示TH-030418引发大鼠明显呼吸抑制。与相同时间点模型组相比,模型+LCX001 20 mg·kg-1组大鼠pCO2显著下降,pO2和sO2显著上升(P<0.01)。提示LCX001可以逆转TH-030418所致呼吸抑制大鼠动脉血气参数的变化,使其恢复或接近基础值水平。
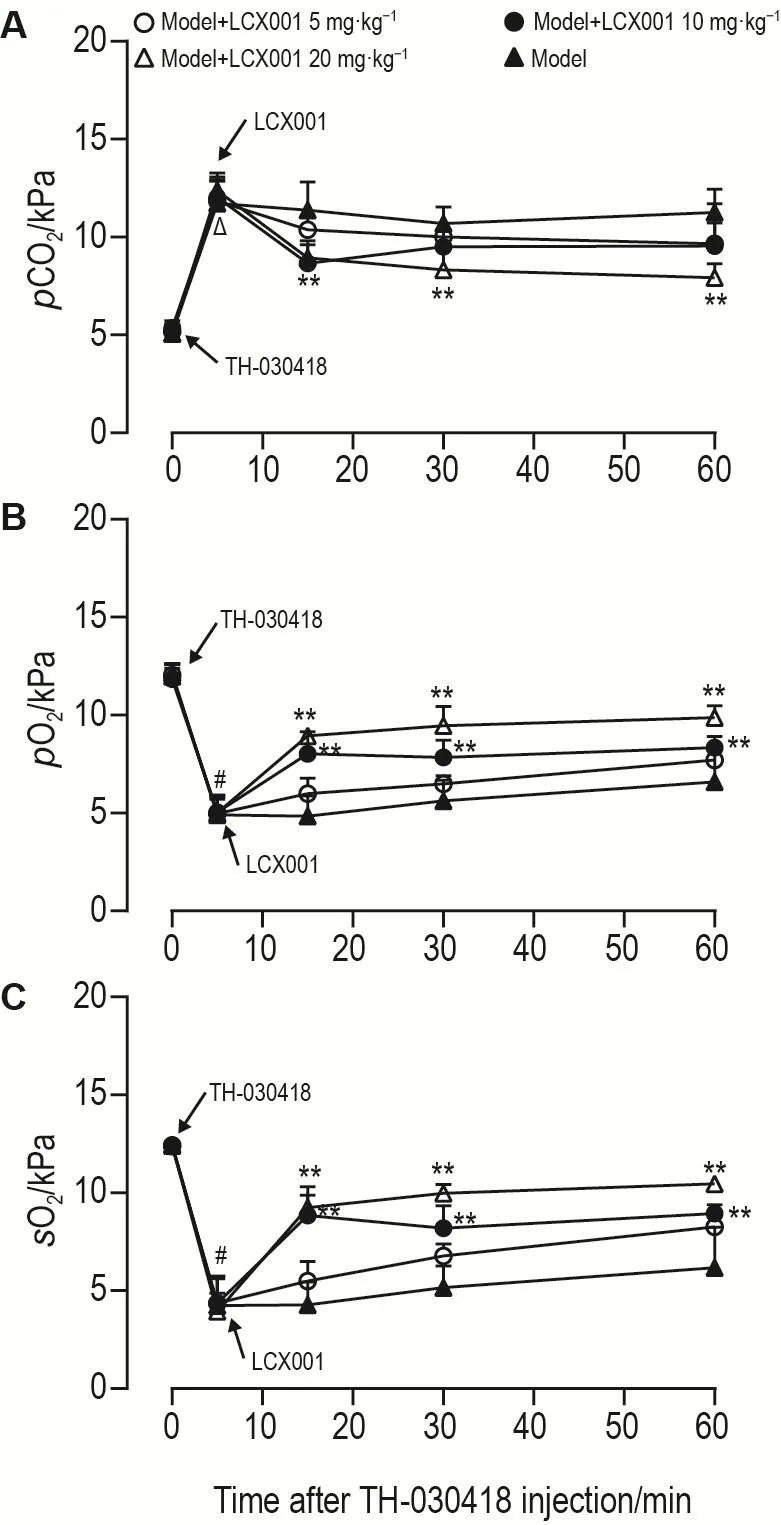
Fig.3 Effects of LCX001 on arterial blood gas parameters in TH-030418-induced respiratory depression rats.Rats were divided into respiratory depression model group(iv given TH-030418 20 μg·kg-1)and model+LCX001 groups(iv given TH-030418 20 μg · kg-1,5 min later iv given LCX001 5,10 and 20 mg·kg-1).pCO2:carbon dioxide partial pressure;pO2:oxygen partial pressure;sO2:oxygen saturation.± s,n=5. **P<0.01,compared with the corresponding time point of TH-030418 group;#P<0.01,compared with 0 min of model group.
2.3 LCX001对TH-030418致呼吸抑制大鼠海马神经细胞外液中Glu含量的影响
LCX001对照组(P=0.12)和溶剂对照组(P=0.40)各时间点脑脊液中Glu含量均未见明显变化,提示单用LCX001并不引起Glu含量释放的明显改变。模型组大鼠给予TH-030418后20 min与该组给予TH-030418前20 min时间点相比,大鼠脑脊液中Glu含量明显下降(P<0.05)。模型+LCX001组在给予TH-030418后20,60,120和160 min时间点大鼠脑脊液中Glu含量均比相应时间点的模型组显著升高(P<0.05,P<0.01),提示LCX001可逆转TH-030418引起的大鼠脑脊液Glu含量减少(图4)。

Fig.4 Effect of LCX001 on glutamate(Glu)release in TH-030418-induced respiratory depression rats.Rats were divided into vehicle group[ip given 20% hydroxypropyl-βcyclodextrin at 15 min before TH-030418 injection(-15 min)],LCX001 control group(ip given LCX001 20 mg·kg-1at-15 min),model group(iv given TH-030418 20 μg·kg-1at-15 min)and model+LCX001 group(ip given LCX001 20 mg·kg-1at-15 min,15 min later iv given TH-030418 20 μg · kg-1).The mean of the measured values at-40 and-20 min was defined as 100%.All the data were normalized to a percentage by dividing the mean.Glu content was measured every 20 min.±s,n=5.*P<0.05,compared with-20 min time point of model group;#P<0.05,##P<0.01,compared with the corresponding time point of model group.
3 讨论
本研究对新型AMPA受体调节剂LCX001改善阿片类药物所致呼吸抑制的量效和时效进行评价,并对其作用机制进行初步探讨,结果提示,LCX001可明显逆转TH-030418所致呼吸抑制大鼠的肺功能参数,并显著改善动脉血气,有效对抗阿片类致大鼠呼吸抑制,这一效应可能与LCX001调节呼吸抑制大鼠海马脑区神经细胞外液的Glu神经递质释放有关。
近几年众多研究表明,AMPA受体与呼吸功能关系密切,尤其表达于介导呼吸节律产生的重要核团前包钦格复合体的AMPA受体参与呼吸节律和幅度的调控,在内源性激动剂Glu的激活作用下,AMPA受体对中枢神经元的兴奋和抑制平衡进行调节,并维持呼吸中枢的正常功能[16-17]。与现有临床使用的特异性拮抗剂及呼吸兴奋剂相比较,AMPA受体调节剂表现出对抗呼吸抑制特点,具有副作用低、安全性好等优势,同时可能具有的镇静、镇痛、改善学习记忆和神经保护等作用,可以使救治预后更好。
LCX001是在AMPA受体调节剂CX717和CX1739结构基础上进行改构合成的新结构类型的化合物,可通过调节AMPA受体的功能发挥生物学效应,与AMPA受体激动剂不同的是,该类化合物不会产生抽搐等惊厥样行为,目前CX717已经作为改善阿片类致呼吸抑制药物进入Ⅱ期临床试验[18]。本课题组前期体外实验已证实,LCX001对AMPA受体有正向调节作用,可以促进神经元的兴奋性传递[15]。本研究选用阿片类药物TH-030418建立呼吸抑制大鼠模型,系统考察了LCX001改善呼吸抑制的量效和时效关系。TH-030418是我所自行设计合成的一个结构新颖的长效阿片受体激动剂,作为噻吩诺啡的衍生物,可以非选择性地与各亚型阿片受体结合,并具有很强的亲和力,是一类比吗啡和二氢埃托啡更为强效的阿片类镇痛药。TH-030418的镇静和麻醉作用明确,呼吸抑制强度具有明显剂量依赖性,在较低剂量下(8 μg·kg-1)即可产生呼吸抑制,且持续时间长,更有意义的是,在纳洛酮催促戒断、条件性位置偏爱和自身给药实验中,均未发现有明显身体依赖和精神依赖潜能[12-14]。上述药理药效特点说明,TH-030418可作为良好的工具药用于中重度呼吸抑制模型的建立。考虑到避免雌性发情周期对实验结果的干扰及性别导致的阿片受体敏感性差异,本研究选择了雄性大鼠给予TH-030418建立呼吸抑制模型,测定处于清醒和自由活动大鼠的MV、RF和EP等呼吸指标,结果显示,LCX001能有效逆转TH-030418所致大鼠RF降低、MV下降和EP增加等呼吸抑制状态。呼吸抑制大鼠的动脉血气参数pO2、pCO2和sO2也进一步确证LCX001抗阿片类致呼吸抑制的有效性。
目前已证实,阿片受体、Glu、γ-氨基丁酸、甘氨酸和Ca2+等都参与呼吸节律的调控。延髓呼吸中枢产生的节律性呼吸依赖于延髓呼吸中枢内各神经元之间复杂的相互联系和相互作用,其中Glu系统是兴奋呼吸中枢的主要神经系统,可调控呼吸节律,增强兴奋性神经冲动向膈肌运动神经元的传递。中枢Glu释放与激动AMPA受体和NMDA受体密切相关。而直接作用于AMPA受体的激动剂,由于直接与受体的结合位点结合,易对受体产生过度刺激引发神经毒性[19-21]。为了考察LCX001改善呼吸抑制的作用机制,本研究采用微透析法测定与呼吸密切相关的海马脑区的Glu释放。结果显示,TH-030418使海马脑区细胞外液Glu释放明显减少,单用LCX001对海马脑区细胞外液Glu含量无影响,但预先给予LCX001后可缓解TH-030418所致的Glu释放减少,使其恢复至接近基础值状态,且未造成过度激活。以上结果表明,LCX001发挥变构调节功能,可能是通过与AMPA受体激动剂不同的受体结合位点,通过增强AMPA受体激动剂与AMPA受体的结合,影响AMPA受体的脱敏和失活过程实现对AMPA受体的精确调控,相比于直接作用于AMPA受体的激动剂更具优势。
