脉络舒通丸对血栓闭塞性脉管炎模型大鼠的治疗作用
2022-02-23王梦丽楚尧娟左莉华赵梦帆刘霁云张晓坚杜书章
王梦丽,楚尧娟,左莉华,赵梦帆,刘霁云,李 冰,孙 志,张晓坚,杜书章
(1.郑州大学第一附属医院,河南 郑州 450000;2.河南省精准医学临床质谱工程研究中心,河南 郑州450000;3.中药制药共性技术国家重点实验室,山东 临沂 276000)
血栓闭塞性脉管炎(thromboangiitis obliterans,TAO)是一种主要损伤四肢远端中小动静及浅静脉的炎症性血管疾病,其特征是高度单核细胞血栓形成的节段性血管闭塞[1-2],临床症状表现为四肢组织供血不足,具有慢性、进行性、持续性和阶段性的特点,治疗预后良好,但坏死性病变的发病率很高[3-4]。现代医学对TAO发病原因及机制的阐述尚未明确,目前研究认为其与烟草、免疫和高凝状态等因素密切相关。许多研究表明,香烟中存在的氧化物质损害血小板和血管内皮细胞的功能,从而增加了血栓的形成,介导炎症反应[5],血栓和炎症是TAO发展的2个主要事件[6]。中医学认为,TAO的发生因心、脾、肾亏虚,复感寒湿之邪,使经络瘀阻,阳气不能温达四末,肢端失于供养,郁邪化热,而致“脱疽”[7]。凝滞脉络或热毒炽盛,闭塞不通,血运不畅,阳气不达,气血两虚,失于温通濡养所致脉络痹阻,气血流通不畅为其主要病机,与血栓形成和炎症反应相对应[8]。因此,用来治疗TAO的中药制剂主要在于其活血化瘀、清热祛湿等功效。
脉络舒通丸(Mailuo Shutong pills,MLST),由黄芪、金银花、黄柏、苍术、薏苡仁、玄参、当归、白芍、甘草、水蛭、蜈蚣和全蝎等12味药材炮制而成,黄芪和金银花为君药,发挥解毒消肿的功能;而黄柏、苍术、薏苡仁、玄参、当归、白芍和甘草为臣药,发挥清热祛湿的作用;水蛭、蜈蚣和全蝎为佐药,达到驱除瘀血的作用[9]。多味药材合用,临床疗效确切,常用于湿热瘀阻脉络所致的血栓性浅静脉炎,非急性期深静脉血栓形成所致的下肢肢体肿胀、疼痛、肤色暗红或伴有条索状物,具有清热解毒、化瘀通络、祛湿消肿的功效[10],与治疗TAO的中药功效相吻合。目前有关MLST治疗TAO的研究多偏重于临床疗效的观察,发现MLST与其他抗凝血药物联用后患者脚和小腿部位酸痛感减轻,步行不适感消失[11],但单独使用治疗TAO的治疗效果和作用机制尚不明确。因此,本研究通过制备TAO大鼠模型,观察MLST对TAO的治疗作用及炎症因子和凝血因子的变化,为TAO的治疗开辟新的思路。
1 材料与方法
1.1 动物、药物、试剂和主要仪器
清洁级雄性SD大鼠,体重230~270 g〔动物生产许可证号:SCXK(豫)2017-0001〕,购自郑州大学医学实验中心,饲养环境温度为23~27℃,相对湿度为45%~55%,每12 h明暗交替,自由饮食饮水,适应性喂养7 d后开始实验。动物实验遵循郑州大学动物实验伦理委员会规定。
MLST,国药准字Z20090636,批号:18200141,每克含黄芪甲苷≥0.30 mg,每克含绿原酸≥3.2 mg,鲁南厚普制药有限公司;通塞脉片(Tongsaimai tablet,TSM),国药准字Z32020535,批号:170402,江苏康缘阳光药业有限公司。月桂酸钠(纯度98%,批号:R007037),上海易恩化学技术有限公司;大鼠内皮素1(endothelin-1,ET-1)、血栓素2(thromboxane-2,TXB-2)和 6-酮-前列腺素(6-keto-prostaglandin,6-K-PGF1α)ELISA试剂盒(批号:E06979r,E08047r和E14411r),武汉华美生物工程有限公司;白细胞介素1β(interleukin-1β,IL-1β)ELISA试剂盒(批号:EK301B/3-24),杭州联科生物技术股份有限公司;兔抗大鼠NF-κB单克隆抗体(一抗)和CY3标记的山羊抗兔IgG抗体(二抗),武汉塞维尔生物科技有限公司。
AL104型电子天平(德国梅特勒-托利多仪器有限公司);D3024R台式高速冷冻离心机(大龙兴创实验仪器股份公司);RT-3100C全自动洗板机(雷杜生命科技有限公司);GEL-70电热鼓风干燥箱(天津莱玻特瑞仪器有限公司);MX-F型涡旋混合器(武汉赛维尔生物科技有限公司);Epoch型酶标检测仪(美国博腾仪器有限公司)。
1.2 动物分组和给药
60只雄性SD大鼠随机分为:TAO模型组、模型+TSM 2.6 g·kg-1,模型+MLST 3.8,7.6和15.2 g·kg-1及假手术组,每组10只。以造模当天为实验第0天(D0),根据文献[12]向大鼠右后肢股动脉注入0.2 mL月桂酸钠(7 g·L-1)制备TAO模型,假手术组注入0.2 mL生理盐水,手术完毕后ip给予青霉素400 kU,预防感染。注射月桂酸钠后,1 min内肢体皮肤颜色出现苍白(与自身对侧肢体相比)表明月桂酸钠注射成功,次日(D1)注射侧肢体出现缺血性改变(表现为肢体青紫颜色加深,趾尖发黑,有跛行或拖曳现象)表明模型制备成功。D1开始ig给药,将MLST和TSM研磨为粉末与羧甲纤维素钠(sodium carboxymethyl cellulose,CMC-Na)溶液混溶(粉末∶CMC-Na=1∶1.5)用于ig给药,TAO模型组、假手术组给予同体积的CMC-Na溶液。每天同一时间ig给药1次,持续14 d。
1.3 体重和患肢形态变化评级
记录大鼠D1和D14体重,D14参照Shinichiro Ashida等[13]采用的分级标准对患肢形态变化进行评级。0级:整体外观无变化;Ⅰ级:病变局限于趾甲部;Ⅱ级:病变局限于趾部;Ⅲ级:病变局限于足爪部;Ⅳ级:病变超过踝关节,膝关节以下;Ⅴ级:病变发展到膝关节以上。
1.4 血常规检测
按1.2分组处理大鼠,于D15用100 g·L-1水合氯醛(3 mL·kg-1)麻醉,用一次性血液采集针和真空负压管腹主动脉取全血。乙二胺四乙酸二钾(ethylenediamine tetraacetic acid dipotassium,EDTAK2)抗凝采血管收集血液2 mL,检测其白细胞、中性粒细胞、淋巴细胞和血小板数目及红细胞比容。
1.5 凝固法检测凝血纤溶相关指标测
同1.4操作,用柠檬酸钠抗凝采血管收集腹主动脉血液2 mL,3000×g离心15 min,取上层血浆,检测大鼠血浆的凝血酶原时间(prothrombin time,PT)、活化部分凝血活酶时间(activated partial thromboplastin time,APTT)、凝血酶时间(thrombin time,TT)和纤维蛋白原(fibrinogen,FIB)水平。
1.6 ELlSA法测定血浆炎症因子和凝血因子水平
同1.4操作,用肝素钠抗凝管收集大鼠腹主动脉血液,30 min内于4℃ 3000×g离心15 min,取上清置-80℃保存,用于ELISA检测。按ELISA试剂盒说明书测定血浆中ET-1,IL-1β,TXB-2和6-KPGF1α水平。
1.7 HE染色观察股动脉和股静脉组织病理变化
各组大鼠取血后迅速剥离股动脉和股静脉,在穿刺点下方剪取2~3 cm,用生理盐水冲洗后,10%甲醛溶液浸泡。取固定好的大鼠动、静脉组织,经脱水、透明、石蜡包埋、切片、脱蜡、HE染色、封片等操作步骤后,于倒置显微镜下观察组织病理变化并拍照。
1.8 免疫荧光法检测股动脉组织NF- κB表达水平
取1.7制备的大鼠动脉组织切片脱蜡,置盛满EDTA抗原修复缓冲液(pH 8.0)的修复盒中进行抗原修复。用组化笔在组织周围画圈,圈内加入自发荧光淬灭剂保持5 min,冲洗后孵育30 min。加抗NF-κB抗体(一抗,1∶100稀释)4℃孵育过夜;漂洗3次,加CY3标记的山羊抗兔IgG抗体(二抗,1∶500稀释)避光室温孵育50 min,DAPI复染细胞核,封片,镜检拍照,使用Image J计算荧光强度(fluorescence intensity,FI)。
1.9 统计学分析
2 结果
2.1 MLST对TAO模型大鼠体重和患肢形态变化的影响
D1各组大鼠体重无差异。D14,与假手术组相比,TAO模型组体重下降(P<0.05);与TAO模型组相比,模型+MLST 3.8和7.6 g·kg-1组及模型+TSM 2.6 g·kg-1组体重均增加(P<0.05,P<0.01)(图1)。TAO模型组大鼠患肢逐渐紫暗发黑,最后变硬,干枯发黄,木乃伊化,病变部位也从趾端逐渐蔓延至膝关节以上,伴有患肢、跛行和曳行现象,2周内部分大鼠患肢坏疽脱落。假手术组未出现病变。与模型组相比,模型+MLST 3.8和7.6 g·kg-1组与模型+TSM组患肢病变减轻(P<0.05),各组大鼠患肢病变评级见表1。
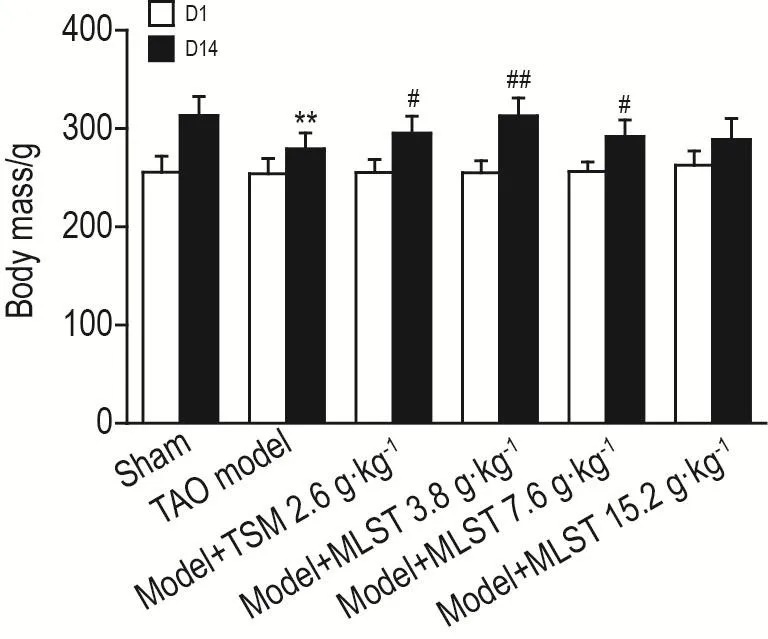
Fig.1 Effect of Mailuo Shutong pills(MLST)on body mass of thromboangiitis obliterans(TAO)model rats.The TAO model was prepared by injecting 0.2 mL sodium laurate 7 g·L-1into the distal end of rats,and 0.2 mL normal saline was injected into the sham group.After injection,paleness in the skin color of the limbs within 1 min indicated the successful injection of sodium laurate,and ischemic changes in the limbs appared the next day(D1)indicated the successful preparation of the model.The administration started on D1,the model+TSM group was ig given TSM 2.6 g·kg-1and the model+MLST group was ig given MLST 3.8,7.6 and 15.2 g·kg-1,respectively,once a day,for 14 d.The sham group was ig given CMC-Na solution.The body mass of rats was recorded on D1 and D14 after drug treatment.x ± s,n=10. **P<0.01,compared with sham group;#P<0.05,##P<0.01,compared with TAO model group.

Tab.1 Effect of MLST on grading of TAO model rats
2.2 MLST对TAO模型大鼠血常规的影响
与假手术组相比,TAO模型组大鼠白细胞、中性粒细胞、淋巴细胞和血小板数目及红细胞比容显著上升(P<0.01);与TAO模型组相比,模型+MLST 7.6 g·kg-1组上述指标匀降低(P<0.01),模型+TSM 2.6 g·kg-1组上述指标亦均降低(P<0.05)(表2)。

Tab.2 Effect of MLST on blood routine indicators of TAO model rats
2.3 MLST对TAO模型大鼠凝血纤溶相关指标的影响
与假手术组相比,TAO模型组PT,APTT和TT缩短(P<0.05,P<0.01),FIB水平升高(P<0.05);与TAO模型组相比,模型+TSM 2.6 g·kg-1及模型+MLST 3.8和7.6 g·kg-1组PT,APTT和TT延长(P<0.05,P<0.01),FIB水平下降(P<0.05)(表3)。
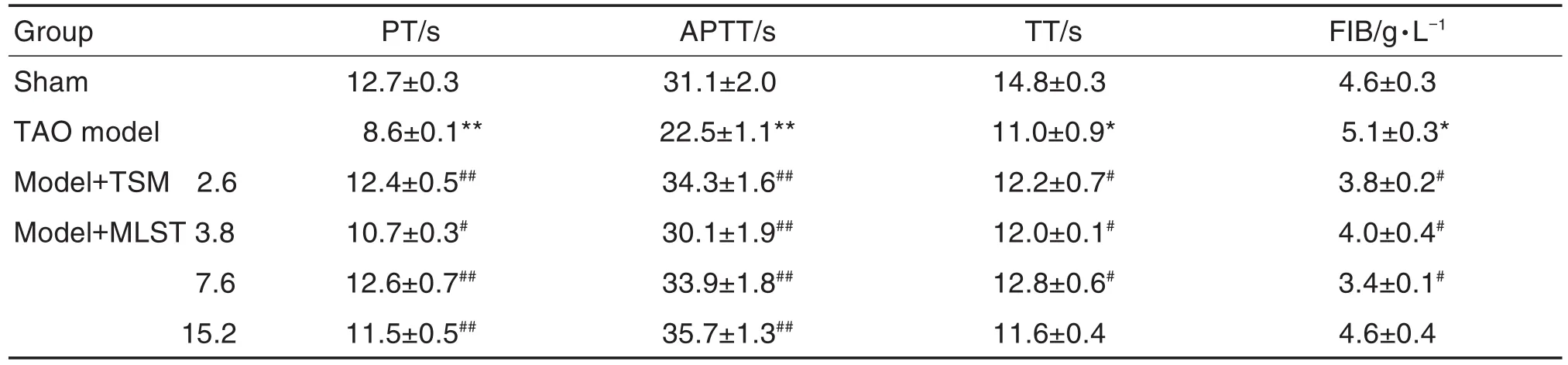
Tab.3 Effect of MLST on coagulation and fibrinolysis indicators of TAO model rats
2.4 MLST对TAO模型大鼠血浆炎症因子和凝血因子水平的影响
与假手术组相比,TAO模型组大鼠血浆ET-1,TXB2和IL-1β水平升高(P<0.01),6-K-PGF1α水平明显降低(P<0.01);与TAO模型组相比,模型+MLST 3.8,7.6和15.2 g·kg-1组及模型+TSM 2.6 g·kg-1组ET-1,TXB-2和IL-1β降低(P<0.05,P<0.01),6-K-PGF1α升高(P<0.01)(表4)。

Tab.4 Effect of MLST on plasma inflammatory factors and thrombotic factors in TAO model rats
2.5 MLST对TAO模型大鼠股动脉和股静脉组织病理变化的影响
股动脉:假手术组股动脉内膜光滑完整,中膜细胞排列有序,外膜和外膜结缔组织无炎症细胞浸润;TAO模型组,中膜、外膜以及外膜结缔组织内膜均被炎症细胞浸润,内膜细胞脱落严重,管腔极度狭窄,细胞排列紊乱;模型+MLST 3.8,7.6和15.2 g·kg-1组和模型+TSM 2.6 g·kg-1组股动脉病变均有不同程度降低(图2A)。股静脉:假手术组膜内无炎症细胞浸润;TAO模型组内膜、中膜和外膜均有炎症细胞浸润,内膜细胞有脱落;模型+MLST 3.8,7.6和15.2 g·kg-1组和模型+TSM 2.6 g·kg-1组内膜细胞无脱落,中膜和外膜炎性细胞浸润减少,病变程度均有所减轻(图2B)。

Fig.2 Effect of MLST on pathological changes of arteriovenous tissue of femoral artery(A)and femoral vein(B)of TAO model rats by HE staining.See Fig.1 for the rat treatment and Tab.2 for detection time.The gray arrow shows the Intima,the red arrow represents the media,and the blue arrow represents the adventitia.
2.6 MLST对TAO模型大鼠股动脉组织NF- κB表达的影响
免疫荧光实验结果(图3)显示,与假手术组相比,TAO模型组大鼠股动脉组织NF-κB表达升高(P<0.01);与TAO模型组相比,模型+TSM 2.6 g·kg-1组及模型+MLST 3.8,7.6和15.2 g·kg-1组股动脉组织NF-κB表达均降低(P<0.05,P<0.01)。

Fig.3 Effect of MLST on expression of NF- κB in femoral artery of TAO model rats by immunofluorescence assay.See Fig.1 for the rat treatment and Tab.2 for detection time.FI:fluorescence intensity.B was the semi-quantitative result of A.±s,n=6.**P<0.01,compared with sham group;#P<0.05,##P<0.01,compared with TAO model group.
3 讨论
本研究采用月桂酸钠注射法成功制备了大鼠TAO模型,并探讨了MLST对TAO的治疗作用。结果显示,TAO模型大鼠股动脉和股静脉组织形态均发生明显病理变化,炎症细胞显著增多;模型+MLST组大鼠股动脉和股静脉炎症细胞浸润出现了不同程度的降低,其中模型+MLST 3.8和7.6 g·kg-1组股动脉和股静脉的内膜细胞炎症反应明显改善。本研究将动脉和静脉分别取样观察,发现静脉的病理特征与动脉类似,均被炎症细胞浸润,表明该模型对动、静脉均造成损伤。目前MLST仅用于浅静脉炎的治疗。本研究结果显示,MLST给药后大鼠动脉和静脉的损伤均有改善。但这可能是多种因素共同作用的结果,还需进一步研究。
内皮细胞和基底膜构成了血管的天然屏障,对维持内环境稳定起着重要作用[14]。造模时月桂酸钠注入造成内皮细胞损伤,内皮细胞在损伤状态下,向血液循环系统释放多种细胞因子,如ET-1和IL-1β等。ET-1是血管内皮功能受损的标志物,可引起细胞内NF-κB信号转导通路激活,介导炎症反应和调控平滑肌增殖,最终导致炎症损伤加重[15]。IL-1β除作用于内皮细胞导致其损伤外,还可与表面受体结合,通过酶反应诱导细胞产生损伤物质,导致其损伤或坏死[16]。当全身循环炎症反应加重时,全身的免疫系统被激活,白细胞和淋巴细胞等亦增多,这与本研究模型组检测结果相符。与模型组相比,模型+MLST 3.8和7.6 g·kg-1组血浆中ET-1和IL-1β表达降低,股动脉组织NF-κB表达下降,表明MLST减轻血管内皮损伤程度,同时抑制NF-κB信号激活,使血管内炎症因子释放减少,也减轻了IL-1β所介导的继发性炎症反应,具有保护血管内皮细胞的作用;模型+MLST 3.8和7.6 g·kg-1组白细胞、中性粒细胞、淋巴细胞和血小板数目下降,提示MLST能减轻全身炎症反应,具有抗炎作用。
TXB2和6-KPGF1α分别是血栓素A2和前列腺素I2的稳定水解产物。血栓素A2可促进血小板聚集和黏附,引起血管收缩,血小板聚集,使血液黏稠度增加,引发血栓形成;前列腺素I2可以保护血管,抑制血小板的聚集,调节微血管血流[17-18]。在正常状态下,体内两者之间达到一种动态平衡,TAO状态下血栓素A2增多,前列腺素I2降低,体内凝血-抗凝血平衡被打破,凝血功能亢进,凝血酶原转化为凝血酶,血液处于高凝状态,血小板聚集,最终导致血栓的形成。与模型组相比,模型+MLST 3.8和7.6 g·kg-1组TXB2表达降低和6-KPGF1α表达升高,PT,APTT和TT延长,表明MLST可能通过选择性地抑制血小板中TXA2的产生,同时保留前列腺素I2的合成来调节体内的凝血-抗凝血平衡,改善凝血状态,使血液黏度降低,抑制血小板的聚集,最终抑制血栓形成。
综上所述,MLST对TAO模型大鼠的治疗作用主要体现在2个方面:①抑制炎症因子,改善血管内损伤状态;②抑制血小板聚集,降低血液黏度,改善凝血和微循环。这可能与其调控血浆IL-1β,ET-1,TXB2和6-K-PGF1α等炎症因子和凝血因子相关。
