甲氰菊酯对大鼠格列喹酮口服吸收及肠道紧密连接蛋白表达的影响
2022-02-23芮雪琳李嘉诚尹登科
徐 莉,刘 扬,杨 晔,2,3,芮雪琳,李嘉诚,尹登科,2,3
(1.安徽中医药大学药学院,安徽 合肥 230012;2.新安医学教育部重点实验室,安徽合肥 230012;3.药物制剂技术与应用安徽省重点实验室,安徽 合肥 230012)
甲氰菊酯(fenpropathrin,Fen)是一类具有光稳定性的拟除虫菊酯类农药,其杀虫谱广,持效期长,防治效果好,适合在害虫、害螨并发时使用,被广泛应用于蔬菜水果等农作物及中药材中防治鳞翅目、同翅目、半翅目、鞘翅目等害虫及螨虫[1],因此农产品及中药材上的农药残留可能使人类长期处于低剂量暴露状态。格列喹酮(gliquidone,Gli),商品名糖适平,是第二代磺酰脲类口服降血糖药物,与第一代相比,其与磺脲类受体结合力更强,可促进胰腺β细胞释放内源性胰岛素,有效降低血糖[2-3]。Gli肠道吸收快,绝大部分经胆汁排泄,尤其适用于肾功能不全的患者[4]。Gli治疗应用的时间较长,具有所需剂量小、不良反应少的优点,因此在临床使用中仍较为稳定和广泛[5]。临床使用Gli的主要不良反应是低血糖,产生这种不良反应的原因难以直接判断,而糖尿病患者血糖变化与Gli血药浓度密切相关[6],所以药物的相互作用及其他原因造成的Gli血药浓度增加或蓄积通常被认为是其诱发低血糖的因素之一[3,7-8]。患者在长期使用治疗药物时,除同时使用的其他临床药物,机体内蓄积的环境污染物引起的机体变化也可能导致药物吸收异常[9]。Fen的急性毒性已有明确记录[10-11],而Fen长期低剂量暴露对Gli的吸收是否产生影响尚不清楚。根据联合国粮食及农业组织和世界卫生组织规定,Fen的日容许摄入量(allowable daily intake,ADI)为0.03 mg·kg-1,根据公式ADI=无可见有害作用水平(no observed adverse effect level,NOAEL)/安全系数,通常取安全系数为100,换算出Fen的NOAEL为3 mg·kg-1[12-13]。根据成人每日临床剂量(2.5 mg·kg-1)以及人与大鼠间的剂量换算,确定Gil剂量为15 mg·kg-1。本研究观察Fen 3 mg·kg-1对Gli 15 mg·kg-1在大鼠体内药动学参数及肠道紧密连接蛋白表达的影响,为Fen暴露对药物吸收影响提供实验依据。
1 材料与方法
1.1 药品、试剂和主要仪器
Gli标准品(含量≥98%,批号0830A02)和羧甲纤维素钠(carboxymethylcellulose sodium,CMC-Na)(批号116Q022),北京索莱宝科技有限公司;Fen标准品(含量≥98%,批号20200317),北京中科质检生物技术有限公司;Gli(批号D07F6J1),上海源叶生物科技有限公司。肝素钠注射液(批号152007040A),常州千红生化制药股份有限公司;二氯甲烷(批号20200619),国药集团化学试剂有限公司;甲醇(批号20110508G103,色谱纯)和乙腈(批号20100628G104,色谱纯),瑞典Oceanpak公司;兔抗大鼠密封蛋白1(claudin-1)抗体(批号 JJ1210)、兔抗大鼠闭合蛋白(occludin)抗体(批号JJ1210)和Cy3-山羊抗兔IgG抗体(批号KK0406),成都正能生物技术有限责任公司;兔抗大鼠闭锁小带蛋白1(zonula occludens protein-1,ZO-1)抗体(批号 BJ07087592),北京博奥森生物技术有限公司;辣根过氧化物酶标记山羊抗兔IgG抗体(批号2117D0107)和DAB显色试剂盒(批号2060A0824),北京中杉金桥生物技术有限公司。
Ultimate 3000高效液相色谱,美国赛默飞世尔科技有限公司;Hypersil BDS C18色谱柱,大连依利特公司;220-A型数显电热恒温干燥箱,上海阳光实验仪器有限公司;KQ2200型超声波清洗器,昆山市超声仪器有限公司;TG16-WS台式高速离心机,长沙湘仪离心机仪器有限公司;ZXZ-Z型循环水式真空泵,河南一恒仪器有限公司。
1.2 动物
健康SD大鼠15只,雌雄不限,SPF级,体重230~270 g,由安徽医科大学实验动物中心提供,动物许可证号SCXK(皖)2017-001。饲养环境温度为18~26℃,光照12 h,黑暗12 h,自由饮水及饮食。本研究通过安徽中医药大学实验动物伦理委员会审批,动物伦理编号为AHUCM-rats-2021043。
1.3 血浆样品处理及分析
大鼠眼眶静脉丛取血,分离血浆200 μL,加入二氯甲烷1 mL,涡旋混匀3 min,1600×g离心10 min,吸取有机层,50℃氮气吹干后用100 μL流动相复溶,14 000×g离心15 min,取20 μL上清进样进行高效液相色谱分析。色谱条件为:Hypersil BDS C18色谱柱(4.6 mm×200 mm,5 μm);流动相:乙腈-水(65∶35,V∶V);柱温:25℃;波长:310 nm;进样量:20 μL;进样时间:10 min;流速:1 mL·min-1。
1.4 样品分析方法验证
1.4.1 专属性
空白大鼠眼眶静脉丛取血得空白血浆,空白血浆内加入0.25 mg·L-1Gli标准品,得含药标准血浆样品,大鼠ig给予Gli 15 mg·kg-130 min后眼眶取血得给药后样品,将空白血浆、含药标准血浆样品、大鼠给药后血浆样品以1.3方法处理进样,考察血浆内源性物质是否干扰Gli检测。
1.4.2 残留效应
配置Gli高浓度(10 mg·L-1)以及定量下限(0.25 mg·L-1)标准血浆样品。进样高浓度样品检测后,进空白样品及定量下限样品。空白样品中Gli的测定信号与定量下限样品测定信号的比值应≤20%。
1.4.3 标准曲线
配制含标准品 Gli 0.25,0.5,1.0,2.5,5.0 和10.0 mg·L-1的标准血浆样品,经1.3方法处理进样。以峰面积为y,药物浓度为x,绘制标准曲线。
1.4.4 精密度和准确度
空白血浆加Gli标准品溶液,配制成质量浓度0.5,2.5和10.0 mg·L-1的标准血浆样品,每浓度设5个平行样。按1.3方法处理进样。计算各浓度平行样品测定结果的日内相对标准差(relative standard deviation,RSD)。样品重复测定3 d,计算测定结果的日间RSD,代表精密度。根据峰面积代入标准曲线计算Gli的浓度,测得浓度与实际浓度之比计算准确度。
1.4.5 稳定性
空白血浆加入Gli标准品溶液,配制成0.5,2.5和10.0 mg·L-1标准血浆样品,每浓度5个样品。室温放置24 h和-20℃放置1周后,按1.3方法处理进样,测定各样品的实测浓度,计算测定结果的RSD和相对误差(relative error,RE)。
1.5 药动学测定
取15只SD大鼠随机分为玉米油组、Gli组和Fen+Gli组,每组5只。Gli用1%CMC-Na配制为1.5 g·L-1混悬液,Fen用玉米油溶解配制为3 g·L-1溶液。大鼠适应性喂养1周后,Gli组ig给予玉米油 1 mL·kg-1,14 d后 ig给予 Gli混悬液10 mL·kg-1;Fen+Gli组 ig 给予 Fen 玉米油溶液14 d后,ig给予Gli混悬液10 mL·kg-1。玉米油组仅ig给予等体积玉米油。大鼠在ig给予Gli前禁食12 h,自由饮水,ig给予 Gli后,分别于 0.25,0.5,1.0,2.0,3.0,4.0,6.0和8.0 h经眼眶静脉丛取血0.5 mL置肝素抗凝管中,离心10 min(900×g)取上清,按1.3方法处理,检测Gli血药浓度,绘制血药浓度-时间曲线图,并采用DAS 2.0软件计算药时曲线下面积(area under the curve,AUC)、清除率(clearance rate,CL)、消除速率常数(elimination rate constant,Ke)、吸收速率常数(absorption rate constant,Ka)、半衰期(eliminate half life,t1/2)、达峰时间(peak time,Tmax)和峰浓度(maximum plasma concentration,Cmax)等药动学参数。
1.6 HE染色法观察大鼠小肠组织形态
1.5中Gli组、Fen+Gli组和玉米油组大鼠取血结束后立即处死,取小肠组织用4%多聚甲醛固定、包埋、切片,切片用染液染色,显微镜下观察大鼠小肠组织形态。
1.7 免疫组化和免疫荧光法检测大鼠小肠组织中紧密连接蛋白的表达
取1.6中Gli组、Fen+Gli组和玉米油组大鼠小肠组织切片,二甲苯脱蜡,梯度乙醇水化,枸橼酸缓冲液抗原修复后PBS溶液冲洗,加内源性过氧化物酶阻断剂,孵育20 min,PBS溶液冲洗。山羊血清封闭1 h,甩去血清后,滴加兔抗大鼠密封蛋白1抗体(1∶200),4℃孵育过夜,TBST溶液冲洗。滴加适量辣根过氧化物酶标记山羊抗兔IgG抗体,室温孵育20 min,TBST溶液冲洗。滴加适量配制好的DAB显色剂,显色10 s。自来水冲洗,苏木精复染10 s,1%盐酸分化,温水返蓝。梯度乙醇脱水、二甲苯透明、封片,倒置显微镜下观察,采集图片,棕黄色为阳性表达区域。同样取小肠组织切片,脱蜡水化,抗原修复后,用0.2%TritonX-100通透20 min,过氧化物酶阻断,山羊血清孵育,滴加兔抗大鼠闭合蛋白和闭锁小带蛋白1抗体(1∶200),4℃下孵育过夜,PBST漂洗,滴加Cy3-山羊抗兔IgG抗体(二抗)(1∶300),37℃避光孵育1 h,PBST漂洗,滴加DAPI染细胞核,室温避光孵育5 min,PBST漂洗,50%甘油封片,荧光显微镜下观察,红色荧光为阳性表达区域。采用Image J图像分析系统分析各组积分吸光度值定量待测蛋白表达水平。
1.8 统计学分析
2 结果
2.1 方法学验证
2.1.1 专属性
大鼠空白血浆、标准血浆样品、大鼠给药后样品的色谱见图1。Gli的保留时间为8.7 min,血浆内源性物质不干扰Gli的检测。
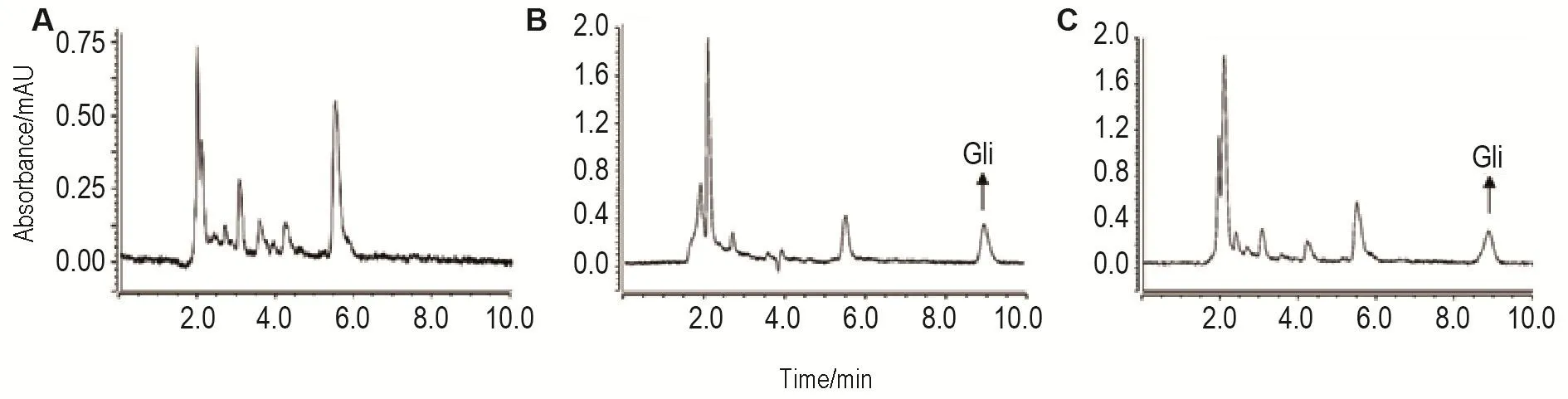
Fig.1 Chromatograms of gliquidone(Gli)in rat plasma.A:blank plasma;B:standard plasma sample containing Gli 0.25 mg·L-1;C:plasma sample acquired 30 min after being ig given Gli 15 mg·kg-1.
2.1.2 残留
高浓度标准品血浆样品(10 mg·L-1)进样后,在空白样品中的残留为定量下限的16.72%(<20%),符合要求。
2.1.3 标准曲线
以Gli的峰面积为y,药物浓度为x,绘制的标准曲线方程为y=0.1311x+0.0038,R2=0.9989,表明Gli在0.25~10.0 mg·L-1范围内线性良好,定量下限为0.25 mg·L-1。
2.1.4 精密度和准确度
Gli定量下限(0.25 mg·L-1)及质量浓度(0.5,2.5和10.0 mg·L-1)标准血浆样品的精密度和准确度见表1。RSD均<15%,准确度85%~115%,满足生物样品分析要求。
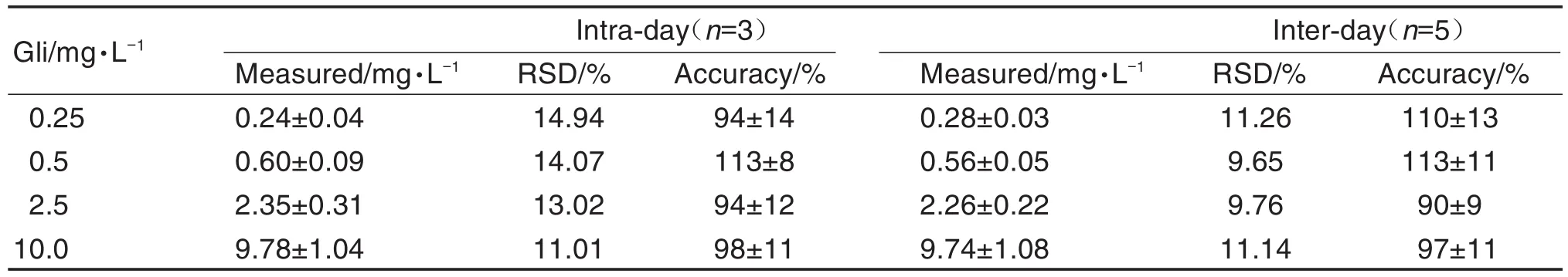
Tab.1 Precision and accuracy of analysis method for determination gliquidone
2.1.5稳定性
Gli高、中、低质量浓度(0.5,2.5,10 mg·L-1)的标准血浆样品的稳定性见表2。RSD均<15%,RE为-15%~15%,表明Gli在储存和分析过程中稳定性良好。
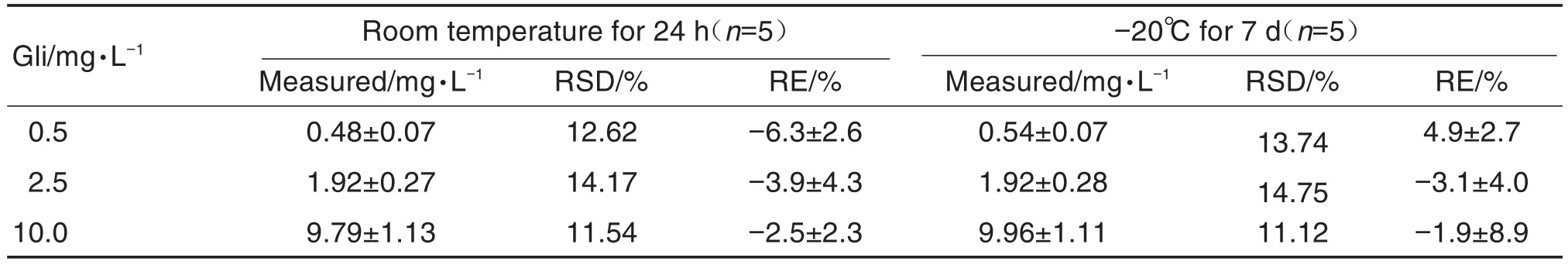
Tab.2 Stability of gliquidone in rat standard plasma samples
2.2 Fen对大鼠灌胃Gli药动学的影响
大鼠ig给予Gli后的药时曲线见图2,相关药动学参数见表3。结果表明,与Gli组大鼠相比,ig给予Fen 14 d后,Fen+Gli组AUC0-t由4.0 mg·L-1·h增加到8.3 mg·L-1·h(P<0.05),Ka由1.0 h-1增加到14.6h-1(P<0.05),Cmax由1.3 mg·L-1增加到3.8 mg·L-1(P<0.05),Tmax由2.80 h缩短到0.90 h(P<0.05)。2组Ke和半衰期均无显著性差异。
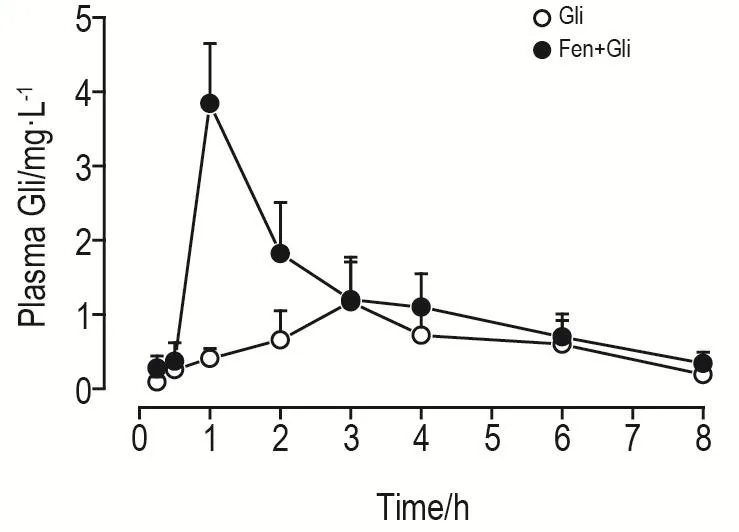
Fig.2 Mean plasma concentration-time curve of gliquidone in rat plasma.The SD rats were randomly divided into corn oil control group(ig given corn oil only),Gil group and Fen+Gli group.The Fen+Gli group and the Gli group were ig given 3 mg·kg-1of Fen or an equal volume of corn oil for 14 d,then ig given Gli 15 mg·kg-1and blood was taken from the orbital venous plexus at different time points after administration.The plasma concentration of Gli was detected by high performance liquid chromatography.x±s,n=5.

Tab.3 Effect of fenpropathrin on pharmacokinetic parameters of gliquidone
2.3 Fen对大鼠小肠组织形态的影响
HE染色结果(图3)表明,与Gli组比较,Fen+Gli组小肠绒毛顶端出现损伤,固有层与肠上皮细胞分离,杯状细胞减少;Gli组与玉米油组比较无明显差异。

Fig.3 Effect of fenpropathrin on intestinal morphology and structure by HE staining.See Fig.2 for the rat treatment.Arrows indicate structural damage.
2.4 Fen对大鼠小肠组织紧密连接蛋白表达的影响
大鼠小肠组织紧密连接蛋白表达检测结果(图4)显示,Fen+Gli组大鼠小肠组织中密封蛋白1、闭合蛋白和闭锁小带蛋白1表达水平较Gil组均显著下降(P<0.05),Gli组与玉米油组比较无显著差异。
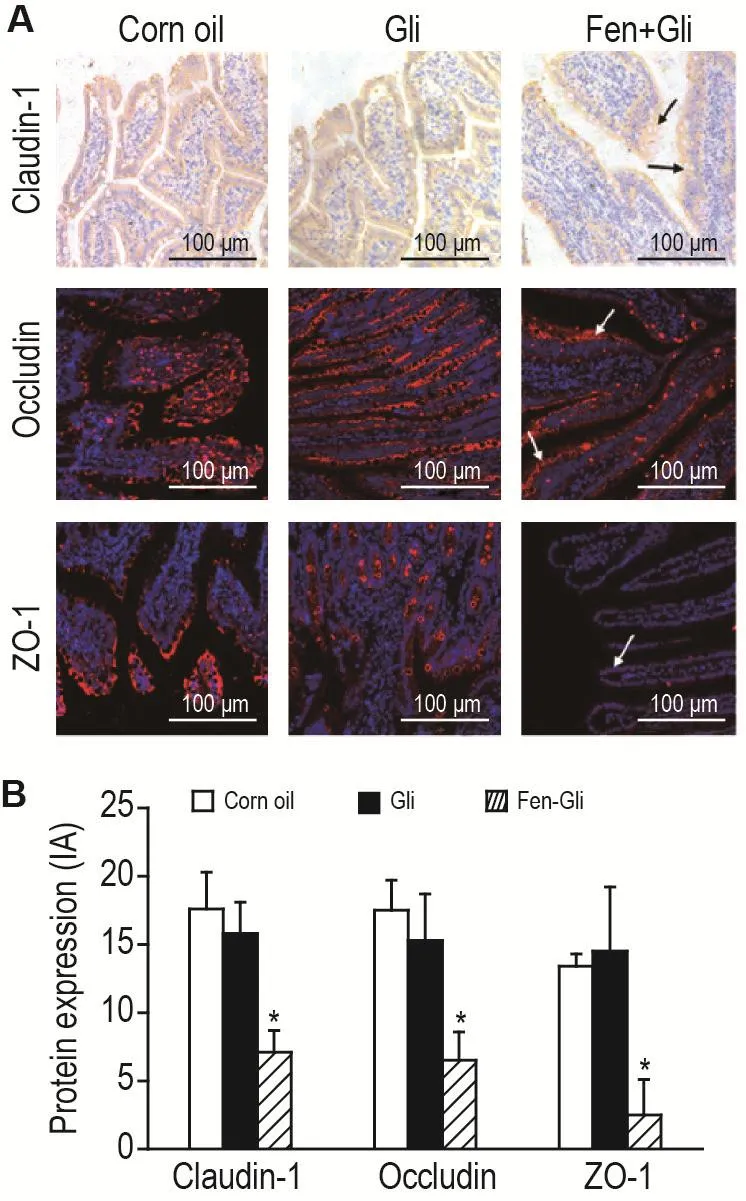
Fig.4 Effect of Fen on protein expressions of claudin-1,occludin and zonula occludens protein-1(ZO-1)in rat intestine by immunohistochemistry.See Fig.2 for the rat treatment.Arrows indicate positive expression.B was the semiquantitative result of A.±s,n=5.*P<0.05,compared with Gil group.
3 讨论
本研究结果表明,Fen 3 mg·kg-1长期暴露可影响 Gli药动学参数,增加 Gli的 AUC0-t,AUC0-∞,Ka,Cmax和Tmax,而未影响Gli的Ke和t1/2。由此推测,2组结果的差异可能主要是由于Fen影响Gli的吸收所致。Fen+Gli组中 Gli的Cmax增加到 3.8 mg·L-1,相当于ig给予大鼠Gli 120 mg·kg-1时的血药浓度,远超临床安全剂量180 mg·d-1换算的大鼠剂量(16 mg·kg-1)[14]。有研究表明,溴氰菊酯暴露诱发了担尼鱼(斑马鱼)肠壁黏膜组织细胞病理改变[15],Adeyemi等[16]得到了相似结果,即氯氰菊酯暴露引起鱼的组织结构改变,如黏膜层严重糜烂,固有层退化,肌肉层解体。本研究结果表明,Fen一定程度上损伤了肠道组织屏障,并降低密封蛋白1、闭合蛋白和闭锁小带蛋白1这3种紧密连接蛋白的表达,提示Fen对肠道的损伤可能是导致Gli吸收增加的原因。拟除虫菊酯类农药的毒性有众多文献报道,其对机体造成损伤的一个重要原因是可诱导机体氧化应激导致神经系统、肝和肾等器官的氧化损伤[17]。同时,氧化应激也会导致肠道线粒体功能障碍,细胞间紧密连接破坏和肠细胞凋亡,大规模肠细胞凋亡和细胞间紧密连接中断也是肠道屏障功能障碍的主要机制。Fen对肠道屏障的损伤作用是否与Fen诱导的氧化应激有关,尚需进一步实验验证。
综上所述,Fen长期暴露增加了Gli的生物利用度和吸收速率,且达峰时间显著提前,这可能是由于其促进Gli的相关吸收途径的作用所致,提示Gli口服吸收的个体差异可能与农药暴露有关。因此,需注意其临床使用时的饮食和环境安全性,以规避可能导致的低血糖及其他不良反应。
