溶质运载蛋白16A家族成员10(SLC16A10)对胶质瘤干细胞增殖及自我更新能力的影响
2022-02-23李圆圆黄浩浩满江红
李圆圆,黄浩浩,满江红
(1.国家生物医学分析中心,北京 100850;2.中国人民解放军中部战区总医院神经外科,湖北 武汉 430070)
多形性胶质母细胞瘤是恶性程度最高的原发性脑胶质瘤,目前临床上常规治疗的方法为最大安全范围手术切除联合放疗及药物化疗综合治疗,但治疗效果仍不甚理想[1-4],患者平均生存周期仅为15~18个月[5-6]。胶质瘤干细胞(glioma stem cells,GSC)是肿瘤组织中具有自我更新、多种系分化和肿瘤形成能力的一小群肿瘤细胞。越来越多的研究表明,GSC是脑胶质瘤发生发展和复发及放疗和化疗抵抗的重要原因[7-8]。
溶质运载蛋白16A家族成员10(solute carrier family 16 member 10,SLC16A10)属于SLC16A家族,该家族还包括其他13个成员,其中SLC16A1,SLC16A3,SLC16A7和SLC16A8编码单羧酸转运体,催化乳酸、丙酮酸和酮体等单羧酸的转运;SLC16A2编码高亲和性甲状腺激素转运体8;其他8个的底物和作用机制尚不清楚[9]。SLC16A10在体内分布广泛,包括小肠、肾、肝和骨骼等[10-12],所编码的芳香族氨基酸转运蛋白能够以不依赖Na+的方式输运芳香氨基酸,如色氨酸、酪氨酸和苯丙氨酸,参与细胞的摄取和排出[13-14]及细胞代谢[4,15-16],对肠道和肾等所产生的芳香族氨基酸转运有重要作用[11]。然而,目前尚无关于SLC16A10芳香族氨基酸转运蛋白对GSC功能影响的研究报道,其作用机制亦不清楚。
本研究室前期通过对387GSC,4121GSC,H2S和456GSC 4株GSC及其分化后的非干性肿瘤细胞(non-stem tumor cells,NSTC)表达的差异蛋白进行质谱鉴定,发现SLC16A10在387GSC中高表达。本研究通过检测387GSC细胞活力和肿瘤细胞球形成能力,观察SLC16A10对387GSC增殖及自我更新能力的影响。
1 材料与方法
1.1 细胞、主要试剂和仪器
人胚胎肾293T细胞购自中国科学院细胞库,培养于含10%胎牛血清(fetal bovine serum,FBS)的DMEM完全培养基中,置37℃,5% CO2恒温培养箱培养;人胶质母细胞瘤干细胞387GSC,受赠于美国克利夫兰医学中心Cleveland Clinic,Jeremy Rich实验室,并经本研究室进行分离与功能鉴定[1],在干细胞完全培养基中于37℃,5% CO2恒温培养箱培养;E.coli-DH5α感受态细胞(BC102-02),北京博迈德基因技术有限公司。FBS,中国依赛科(ExCell Bio)生物科技有限公司;DMEM培养基、青霉素-链霉素双抗混合液、胰蛋白酶、丙酮酸钠、谷氨酰胺和磷酸钙转染试剂盒(MaxiCaP),中科迈晨(北京)科技有限公司;Neurobasal基础培养基和B-27血清替代物,美国Thermo Fisher Scientific公司;碱性成纤维细胞生长因子和上皮生长因子,美国R&D Systems公司;5×慢病毒浓缩液,北京康润诚业生物科技有限公司(Genstar);Prime Script RT Master Mix逆转录试剂盒,日本TaKaRa公司;实时荧光定量PCR预混液(Power Up SYBR Green Master Mix)试剂盒,美国Sigma公司;质粒提取试剂盒和细胞活力检测试剂盒(CellTiter-Glo®Luminescent Cell Viability Assay),美国Promega公司;RNA提取试剂盒(RNeasy Mini Kit),德国Qiagen公司;兔抗人SLC16A10多克隆抗体(一抗),英国Abcam公司;小鼠抗人性别决定区Y框蛋白2(sex-determining region Y-box 2,SOX2)单抗隆抗体(一抗),美国Cell Signaling Technology公司;Alexa Fluor 488(绿色荧光)标记驴抗兔IgG抗体(二抗)、Alexa Fluor 546(红色荧光)标记山羊抗小鼠IgG抗体(二抗)和Hoechst 33342细胞核染料,美国Thermo Fisher Scientific公司;GAPDH抗体,实验室自制。低温高速离心机(型号5424R)和常温高速离心机(型号5424),德国Eppendorf公司;Glomax 96微孔板发光检测仪(型号9101-002),美国Promega公司;电泳仪(Basicpower),美国Bio-Rad公司;实时荧光定量PCR仪(型号LC96),美国Roche公司。
1.2 细胞培养和处理
DMEM完全培养基配制:于DMEM培养基500 mL中加FBS 50 mL和青霉素-链霉素双抗混合液5.5 mL,摇匀置冰箱4℃保存。
干细胞完全培养基配制:向500 mL Neurobasal基础培养基中加青霉素-链霉素双抗混合液、丙酮酸钠和谷氨酰胺各5.3 mL,随后加B-27血清替代物10 mL以及终浓度为10 μg·L-1的碱性成纤维细胞生长因子和上皮生长因子,摇匀于冰箱4℃保存。
387NSTC分化:按血清诱导干细胞分化的方法[1],将消化处理后的387GSC进行细胞计数;取2×106细胞接种于10 cm细胞培养皿,加入DMEM完全培养基10 mL培养7 d后,收取分化后的387NSTC。
1.3 RT-qPCR检测387GSC和387NSTC相关基因表达
用RNA提取试剂盒提取387GSC和387NSTC总RNA,使用PrimeScript RT Master Mix逆转录试剂盒合成cDNA,配制体系为 RNA 500 ng,5×PrimeScript Mix 2 μL,DEPC水补充至10 μL;参照实时荧光定量PCR预混液使用说明进行荧光定量PCR。RT-qPCR所用引物均由PrimerBank网站设计,引物序列见表1,由生工生物科技有限公司合成。反应结束后,用LightCycler®96sw1.1软件分析扩增曲线和熔解曲线,获得目的基因和对照基因Ct值,用 2-ΔΔCt法计算SLC16A10,SOX2,Olig2和GFAP基因mRNA相对表达水平。

Tab.1 Primer sequences for real-time quantitative PCR(RT-qPCR)
1.4 shSLC16A10干涉质粒载体构建和慢病毒包装
载体质粒构建:利用Sigma网站设计SLC16A10基因的小发夹(small hairpin RNA,shRNA)引物序列,选择2对敲低效率最高的引物(分别命名为shSLC16A10#1和shSLC1610#2)分别由生工生物工程股份有限公司合成;非靶向发夹结构(sh-non-target,shNT)的序列咨询擎科生物科技有限公司获得并合成引物序列见表2。将shNT和2对shRNA引物退火后分别连接于pLKO.1质粒载体,构建含shNT,shSLC16A10#1和shSLC16A10#2干涉序列载体的质粒。

Tab.2 Primer sequences for small hairpin RNA(shRNA)
慢病毒包装:将293T细胞消化处理为单个细胞并计数,取3×106细胞接种于10 cm细胞培养皿,待细胞融合度约达60%,用磷酸钙转染试剂盒并根据使用说明进行慢病毒包装。包装质粒psPAX2和pCMV-VSVG及目的质粒(shNT,shSLC16A10#1或shSLC16A10#2)各5 μg加入1 mL HBS(平衡盐溶液)混匀,静置5 min;取70 μL CaCl2缓慢滴入混合液中,缓慢混匀,静置15 min;将转染体系滴加到细胞培养皿中,转染5 h后更换新的DMEM完全培养基。细胞培养72 h后收集培养基上清,600×g离心3 min,取上清用0.45 μm过滤器过滤;过滤后的液体中加入适当体积5×PEG病毒浓缩液混匀,4℃过夜;低温离心机7000×g离心15 min后弃上清,将病毒沉淀用1 mL冰PBS重悬、分装,置-80℃冰箱保存备用。
1.5 慢病毒感染细胞
取1.5×106387GSC接种于10 cm培养皿中,分为shNT对照组、靶点1干涉(shSLC16A10#1)组和靶点2干涉(shSLC16A10#2)组,每皿加PBS病毒重悬液250 μL感染,加入10 mL DMEM完全培养基,置培养箱中培养。培养2 d后加入嘌呤霉素(终浓度2 mg·L-1)进行筛选,筛选2 d后收取慢病毒感染的细胞。
1.6 Western印迹法检测SLC16A10敲低效果
将收取的慢病毒感染的细胞加入M2细胞裂解液(每1×106细胞,加100 μL),100 μL,重悬细胞,冰上裂解30 min后4℃,15 000×g离心15 min,取上清,用Bradford法进行蛋白质定量。取40 μg总蛋白在5%浓缩胶和10%分离胶中电泳后,转膜2 h。用5%脱脂奶粉封闭1 h,加一抗〔抗SLC16A10(1∶1000),抗GAPDH(1∶5000)〕4℃摇床孵育过夜;加二抗室温摇床孵育1 h,用ECL化学发光检测试剂盒显色,在暗室进行曝光显影,用Image J软件进行积分吸光度(integrated absorbance,IA)分析,以SLC16A10蛋白和内参GAPDH蛋白条带IA比值表示目的蛋白相对表达水平。
1.7 SLC16A10敲低后387GSC相对细胞活力和肿瘤细胞球形成数目测定
分别将shNT慢病毒感染对照组shSLC16A10#1和shSLC16A10#2组387GSC消化处理为单个细胞,计数,接种于96孔板,每孔2×103细胞,每组5复孔,各接种4个96孔板。在接种至孔板后分别于培养第0,2,4和6天用CellTiter-Glo试剂盒检测387GSC相对细胞活力。
在培养第4天同时观察各组孔板中细胞生长形态,并用成像显微镜拍照,统计每组肿瘤细胞球数目。
1.8 细胞免疫荧光检测SLC16A10细胞定位
将免疫荧光专用小玻片(platinum line cover glass玻片)置于24孔板内,并加入Metrigel胶300 μL 置 37℃培养箱 30 min,每孔接种 1×105387GSC,培养过夜。用预热的4%多聚甲醛固定15 min,在含0.3%Triton X-100的1×PBS中打孔1 h,加入1%BSA封闭液37℃封闭1 h,加一抗〔抗SLC16A10和抗SOX2(1∶100)〕4℃孵育过夜,加二抗(1∶400)室温孵育1 h,Hoechst 33342(1∶1000)溶于PBS中染核8 min,PBS清洗3次,封片剂封片。用激光共聚焦显微镜观察细胞染色,并采集图像,分析SOX2蛋白表达及SLC16A10和SOX2细胞定位。
1.9 统计学分析
2 结果
2.1 SLC16A10在GSC中高表达
如图1所示,与387GSC相比,387NSTC中SLC16A10mRNA表达明显减弱(P<0.01),表明SLC16A10在387GSC中高表达;同时肿瘤干细胞标志物SOX2和Olig2mRNA表达显著降低(P<0.01),非干细胞标志物GFAP表达显著升高(P<0.01),表明387GSC分化为387NSTC。

Fig.1 Expressions of SLC16A10,SOX2,Olig2 and GFAP mRNA in 387 glioma stem cells(387GSCs)and 387 non-stem tumor cells(387NSTCs)detected by RT-qPCR.Differentiation of 387GSCs was induced by exposure to DMEM with 10% fetal bovine serum for 7 d.±s,n=3.**P<0.01,compared with 387GSC group.
2.2 387GSC中SLC16A10敲低效果
Western印迹法结果(图2)所示,与shNT对照组相比,shSLC16A10#1和shSLC16A10#2组387GSC SLC16A10表达均显著下降(P<0.01),表明2个靶点干涉效果明显,可用于功能实验。

Fig.2 Efficiency of knock down SLC16A10 in 387GSCs by Westren blotting.The 387GSCs were treated with PBS virus resuspension for 48 h and screening 48 h with puromycin 2 mg·L-1.IA:integrated absorbance.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with shNT group.
2.3 敲低SLC16A10抑制387GSC增殖
如图3所示,shNT对照组387GSC相对细胞活力随时间延长现明显升高(P<0.01);与shNT对照组比较,shSLC16A10#1和shSLC16A10#2组387GSC相对细胞活力均下降(P<0.01),表明敲低SLC16A10可明显抑制387GSC增殖。
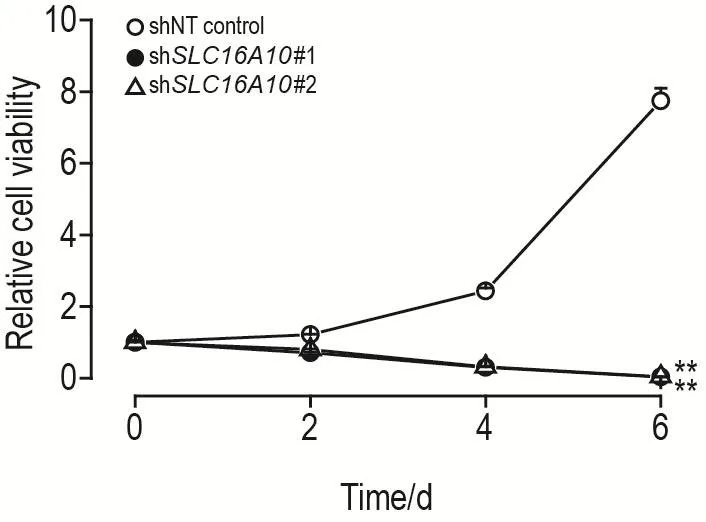
Fig.3 Effect of SLC16A10 knock down on cell viability of 387GSCs detected by CellTiter-Glo kit.±s,n=3.**P<0.01,compared with shNT control group.
2.4 敲低SLC16A10抑制387GSC自我更新
如图4所示,387GSC在体外培养时悬浮生长,易形成肿瘤细胞球。敲低SLC16A10组肿瘤细胞球数量较shNT对照组明显减少(P<0.01),表明敲低SLC16A10后,387GSC肿瘤细胞球的形成能力显著降低。

Fig.4 Effect of SLC16A10 knock down on cell self-renewal of 387GSCs.A was microscopic imaging result of sphere state of cells on the 4thday.B was the semi-quantitative result of A.±s,n=3.**P<0.01,compared with shNT control group.
2.5 SLC16A10在387GSC中细胞定位
如图5所示,红色荧光指示SOX2蛋白表达,绿色荧光指示SLC16A10蛋白定位,蓝色荧光指示细胞核。结果提示,SOX2作为干细胞标志物在多数387GSC中表达,且SOX2主要定位于细胞核,SLC16A10蛋白不定位于GSC细胞核。

Fig.5 Cell localization of SLC16A10 in 387GSCs by immunofluorescence assay.Immunofluro rescence images of 387GSCs with SLC16A10 antibody and SOX2 antibody.Nuclei were labelled with Hoechst 33342.
3 讨论
本研究结果表明,SLC16A10在387GSC中的表达水平显著高于387NSTC,提示SLC16A10在GSC中高表达,在GSC生长、增殖、迁移、侵袭以及抵抗放化疗中可能发挥特殊功能。SOX2和Olig2是肿瘤干细胞标志物,GFAP是非干性肿瘤细胞标志物,可共同指示387GSC分化为387NSTC后细胞干性丢失。研究结果表明,分化7 d后,387NSTC内SOX2和Olig2mRNA表达显著下降,GFAPmRNA表达升高,表明387NSTC已分化完成。
本研究通过慢病毒转染体系干涉GSC中SLC16A10的表达。结果表明,靶向SLC16A10mRNA的2个不同shRNA序列的慢病毒均可明显抑制387GSC中SLC16A10的表达。同时,敲低SLC16A10的387GSC相对细胞活力和细胞球形成均受到显著抑制。细胞球形成数目反映387GSC自我更新能力。由此表明,SLC16A10在387GSC增殖和自我更新过程中发挥重要功能,是一种潜在胶质瘤的治疗靶点。
本研究通过免疫荧光实验检测SLC16A10蛋白在387GSC中的细胞定位,实验结果初步排除了SLC16A10蛋白定位于细胞核的可能性。SLC16A10蛋白的细胞膜或细胞质定位需进一步实验研究。
芳香族氨基酸的非正常代谢是多种疾病的致病因素[17],高含量的芳香族氨基酸也可作为诊断多种癌症的潜在的生物标志物[18]。SLC16A10作为一种重要的芳香族氨基酸转运体,在387GSC中特异性高表达,这是否与脑胶质瘤中芳香族氨基酸代谢有关,尚有待进一步研究。
综上,本研究结果表明,SLC16A10是一种有潜力的胶质瘤治疗靶点或诊断标志物。关于敲低SLC16A10抑制387GSC增殖及自我更新能力的具体机制尚待进一步研究。
