LncRNA XIST通过miR-193a-3p/RSF1轴对骨肉瘤细胞增殖和迁移的作用研究*
2022-02-19孔德海冯德香刘峻滔邓明明付炳金朱晓东
孔德海,冯德香,刘峻滔,邓明明,付炳金,尹 刚,朱晓东
(1.滨州医学院附属医院足踝外科,山东滨州 256600;2.滨州医学院附属医院肿瘤科,山东滨州 256600;3.滨州医学院烟台附属医院创伤骨科,山东滨州 256600)
骨肉瘤是从间质细胞系发展而来的一种恶性成骨性肿瘤,常发于青少年[1]。骨肉瘤可导致肌肉萎缩、骨折,影响运动系统、呼吸系统等功能,威胁患者生命安全。目前我国在骨肉瘤治疗方面取得了一定的进展,但由于骨肉瘤患者易发生早期肺转移,复发率高,因此整体治疗效果较差[2]。骨肉瘤靶向基因治疗一直是基础研究的热点,但目前仍无精确的靶向药物应用于临床,因此探究有效抑制骨肉瘤细胞增殖和迁移的基因,为骨肉瘤的治疗提供新的靶点尤为重要。长链非编码RNA(long noncoding RNA,lncRNA)是一类转录本超过200 nt,不编码蛋白的RNA分子,它能够在多种层面上调控基因的表达[3]。miR-193a-3p和重构剪切因子1(RSF1)是与肿瘤发生、发展相关的基因,参与细胞的多种生物学功能,且RSF1被认为是miR-193a-3p直接作用靶点,miR-193a-3p能通过抑制RSF1基因表达,调控肿瘤细胞的生物学进程[4]。研究证实,lncRNA X染色体失活特异转录本(X chromosome inactivation specific transcripts,XIST)能促进肿瘤的发生、发展,lncRNA XIST在多数肿瘤中上调,并促进肿瘤向远处转移[5]。目前虽有研究发现降低lncRNA XIST可抑制骨肉瘤细胞增殖和迁移,但miR-193a-3p/RSF1轴对骨肉瘤细胞的作用研究较少[6]。因此,本文研究lncRNA XIST通过miR-193a-3p/RSF1轴对骨肉瘤细胞增殖和迁移的作用,为找到治疗骨肉瘤的精确靶点提供参考。
1 材料与方法
1.1 材料
1.1.1组织标本和细胞株
收集2017年9月至2018年12月滨州医学院烟台附属医院30例骨肉瘤切除手术中的癌组织和癌旁组织,液氮中保存。收集病例标准:(1)符合骨肉瘤诊断标准,并经细胞系或病理学确诊的骨肉瘤;(2)未经任何抗肿瘤治疗;(3)经医院伦理委员会审查批准,并征得患者同意,签署知情同意书。人骨肉瘤细胞株HOS购自上海塞默生物科技发展有限公司。
1.1.2主要试剂和仪器
空载质粒、sh-lncRNA XIST重组质粒、miR-193a-3p mimic/inhibitor购自上海吉玛制药技术有限公司;DMEM培养基、10%的胎牛血清(FBS)购自郑州九龙生物制品有限公司;Lipofectamine 2000转染试剂盒购自上海笃玛生物科技有限公司;兔抗人RSF1(一抗)、山羊抗兔RSF1(二抗)购自美国CST公司;CCK-8试剂盒购自北京索莱宝科技有限公司;SYBR Premix Ex Taq Ⅱ试剂盒、TRIzol试剂盒、BCA蛋白定量试剂盒、SDS-PAGE制备试剂盒购自北京智杰方远科技有限公司;DYY-4C电泳仪购自上海巴玖实业有限公司;GE凝胶成像仪购自苏州艾比拓生物技术有限公司;RJ17DG5033A型酶联免疫检测仪购自南京华东电子医疗设备有限责任公司。
1.2 方法
1.2.1RT-qPCR检测骨肉瘤组织及癌旁组织中lncRNA XIST mRNA表达
骨肉瘤组织和旁癌组织中的总RNA提取采用TRIzol试剂盒,反转录成cDNA模板,参照SYBR Premix Ex Taq Ⅱ试剂盒说明书进行RT-qPCR,lncRNA XIST引物序列见表1。反应程序:95 ℃预变性5 min;95 ℃变性40 s,59 ℃退火30 s,72 ℃延伸30 s,35次循环。采用β-actin作为内参,2-△△CT法计算lncRNA XIST的相对表达量。
1.2.2细胞培养、转染及分组
将骨肉瘤细胞株HOS培养于含10% FBS、100 μ/mL青霉素、100 μ/mL链霉素的DMEM培养基中,置于37 ℃、5% CO2培养箱中培养。转染前1 d,将HOS细胞接种到6孔板中,分为3组,分别是空白组、空载组和实验组,每组设5个复孔。空白组HOS细胞不做任何处理,空载组和实验组按Lipofectamine 2000转染试剂说明书将空载质粒和sh-lncRNA XIST重组质粒分别转染至HOS细胞,继续培养48 h后,荧光显微镜检测细胞转染效率,转染效率大于80%进行后续实验。
励志教育是我国高等教育的重要组成部分,不论是在思想观念层面还是实践层面,高校教育工作者都要以各具个性、富有特色的方式灵活开展励志教育,对大学生的当下处境和现实使命进行清晰解读和前瞻性引领,让大学生最大限度地发挥自身潜能。具体而言,大学励志教育对学生能起到思想信念指引、育人文化涵养和学业目标导向等功能。
1.2.3CCK-8法检测细胞增殖能力
取对数期生长的各组细胞,接种于96孔板,调整细胞浓度为1×106/mL,将培养板放入37 ℃、5% CO2的培养箱内,观察培养24、48、72 h,每孔加入10 μL的CCK-8溶液,继续培养4 h,酶联免疫检测仪测量各孔在450 nm处的吸光度(A)值。
1.2.4划痕实验检测细胞迁移能力
取对数期生长的各组细胞,接种到6孔板内,调整细胞密度为5×103/mL,待细胞铺满后,用10 μL无菌枪头在孔板上均匀划线,PBS洗去划下的细胞,不含血清的培养基中培养24 h。倒置显微镜拍摄0、24 h时细胞迁移状态,Image图像分析计算细胞融合距离,细胞融合距离=初始划痕宽度-终末划痕宽度。
1.2.5双荧光素酶报告基因实验检测lncRAN XIST、miR-193a-3p与RSF1之间的作用关系
将miR-193a-3p mimic/inhibitor分别与LncRNA XIST Wt/Mut共转染,在37 ℃、5% CO2培养箱中培养8 h,换0.5 mL含10% FBS且不含维生素的正常DMEM培养基,在37 ℃、5% CO2培养箱中培养48 h,收集细胞。再将miR-193a-3p mimic/inhibitor分别与RSF1 Wt/Mut共转染细胞,操作同上。应用双荧光素酶报告基因实验检测荧光素酶,酶标仪检测萤火虫荧光素光吸收值、海肾荧光素光吸收值,以海肾荧光素光值为内参,荧光素酶活性=萤火虫荧光素光吸收值/海肾荧光素光吸收值。
1.2.6RT-qPCR检测细胞lncRNA XIST、miR-193a-3p、RSF1 mRNA表达
取稳定转染48 h各组细胞,参照TRIzol试剂盒说明书,提取HOS细胞中的总RNA,逆转录获取cDNA模版,参照SYBR Premix Ex Taq Ⅱ试剂盒说明书设定反应体系,引物序列见表1。反应程序:95 ℃预变性5 min;95 ℃变性30 s,58 ℃退火30 s,72 ℃延伸30 s,35次循环。miR-193a-3p采用U6作为内参,lncRNA XIST和RSF1采用β-actin作为内参,2-△△CT法计算lncRNA XIST、miR-193a-3p、RSF1的相对表达量。

表1 相关基因扩增引物序列
1.2.7Western blot检测RSF1蛋白表达
取稳定转染48 h各组细胞,RIPA裂解液提取细胞总蛋白,蛋白浓度用BCA试剂盒检测,SDS-PAGE电泳分离蛋白,电转法将蛋白转移至聚偏氟乙烯膜,5%的脱脂奶粉室温封闭1 h,加入按1∶1 000的一抗,4 ℃培养过夜,TBST溶液清洗3次,加入1∶3 000稀释的二抗,室温孵育1 h,TBST再清洗3次,加入ECL反应液,凝胶成像系统采集图像并观察分析。
1.3 统计学处理
2 结 果
2.1 癌组织与癌旁组织中lncRNA XIST mRNA表达
癌组织中lncRNA XIST mRNA表达(6.27±1.88)明显高于癌旁组织(3.15±0.41),差异有统计学意义(t=8.881,P<0.05)。
2.2 各组细胞A值
与空白组和空载组比较,培养24、48、72 h时,实验组的A值明显降低,差异有统计学意义(P<0.05)。不同时点空白组和空载组比较,差异无统计学意义(P>0.05)。各组随着干预时间的延长A值升高,差异有统计学意义(P<0.05),见表2。

表2 各组细胞不同时点A值比较
2.3 各组细胞融合距离
空白组、空载组、实验组细胞融合距离分别为(87.9±22)μm、(85.7±17)μm、(43.5±11)μm,组间比较,差异有统计学意义(F=10.506,P=0.002)。与空白组和空载组比较,实验组24 h时细胞融合距离明显缩短,差异有统计学意义(t=4.036,P=0.004;t=4.660,P=0.002),而空白组和空载组比较,差异无统计学意义(t=0.177,P=0.864),见图1。

图1 各组细胞迁移情况(×100)
2.4 荧光素酶报告基因实验结果
lncRAN XIST与miR-193a-3p存在互补序列,过表达miR-193a-3p可明显抑制lncRAN XIST-Wt的荧光素酶活性(P<0.05),对lncRAN XIST-Mut荧光素酶活性无抑制作用,见图2、3。miR-193a-3p能结合RSF1的3′UTR区域,二者结合序列与lncRAN XIST、miR-193a-3p结合序列部分相同,过表达miR-193a-3p可明显抑制RSF1-Wt荧光素酶活性(P<0.05),见图4、5。

图2 生物信息学数据库Starbase预测结果
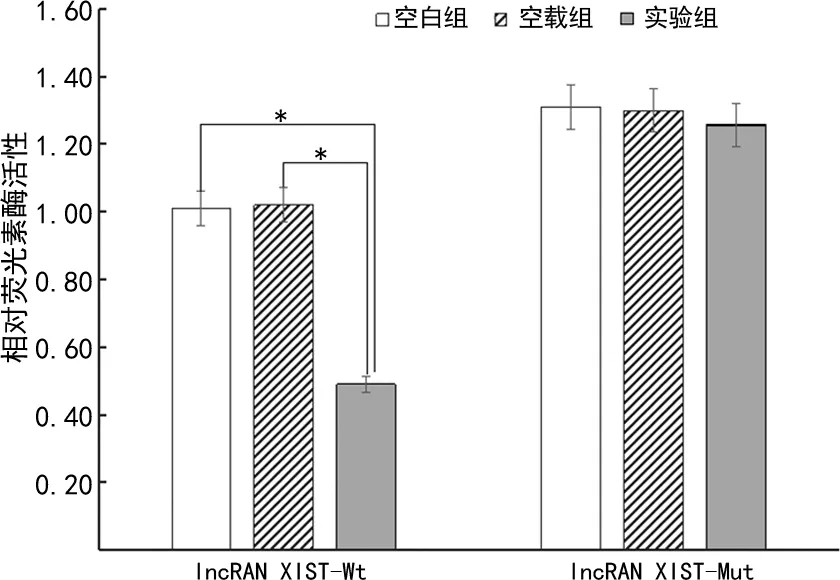
*:P<0.05。图3 lncRAN XIST、miR-193a-3p靶向作用关系

图4 生物信息学数据库TargetScan分析结果

*:P<0.05。图5 miR-193a-3p、RSF1的靶向作用关系
2.5 各组细胞lncRNA XIST、miR-193a-3p、RSF1 mRNA表达
与空白组和空载组比较,实验组lncRNA XIST、RSF1 mRNA表达明显降低,miR-193a-3p mRNA表达明显增加,差异有统计学意义(P<0.05),而空白组和空载组比较,差异无统计学意义(P>0.05),见表3。

表3 各组lncRNA XIST、miR-193a-3p、RSF1 mRNA表达
2.6 各组细胞RSF1蛋白表达
空白组、空载组和实验组的RSF1蛋白表达分别为1.12±0.22、1.08±0.17、0.56±0.07,差异有统计学意义(F=24.988,P<0.001)。与空白组和空载组比较,实验组RSF1蛋白表达明显降低,差异有统计学意义(t=6.392,P<0.001;t=7.541,P<0.001)。空白组和空载组比较,差异无统计学意义(t=0.322,P=0.756),见图6。

图6 各组细胞RSF1蛋白表达情况
3 讨 论
骨肉瘤是骨科常见的恶性肿瘤,起源于骨骼系统的结缔组织,好发部位是股骨远端和胫骨后端。据相关统计,在原发性恶性肿瘤中骨肉瘤是发病率较高的一种,占青少年和儿童骨癌的56%[7-8]。骨肉瘤目前的治疗手段包括手术治疗、化疗和保肢重建手术等多种方式相结合,随着治疗水平的不断提高,骨肉瘤患者5年生存率明显提高[9]。然而,当前的治疗手段也存在不少弊端,例如化疗药物会对正常组织产生毒性,导致患者出现贫血、心脏损伤等不良反应,故寻找有效治疗骨肉瘤的方法迫在眉睫。近年来,基因治疗、分子靶向治疗在骨肉瘤治疗研究中取得了较大进展,有研究发现lncRNA XIST对癌细胞增殖和迁移有较大影响[10]。因此,研究lncRNA XIST对骨肉瘤细胞的调控机制,对治疗骨肉瘤有重要意义。
lncRNA是一类非蛋白编码转录本,大多数lncRNA调控肿瘤发展进程是通过抑制或促进miRNA表达来影响癌细胞的恶性生物学行为,lncRNA可以结合并抑制miRNA活性,降低其对下游基因干扰,从而促进下游基因mRNA翻译,被研究证实在各种生物调控中起重要作用,且与人类的多种疾病相关[11-12]。lncRNA XIST是XIST基因上游非编码区调节因子,在细胞增殖、分化方面起关键作用。GAO等[13]研究发现,敲降lncRNA XIST可抑制骨肉瘤细胞的增殖,促进细胞凋亡。XU等[14]发现敲降lncRNA XIST后,lncRNA XIST能与EZH2结合,下调P21的表达,进而抑制骨肉瘤细胞的增殖、阻滞细胞周期。本研究发现,lncRNA XIST在骨肉瘤细胞中高表达,敲降lncRNA XIST后CCK-8试验显示A值降低,24 h融合距离缩短,说明敲降lncRNA XIST能明显抑制癌细胞增殖和迁移能力。
研究表明,miR-193a-3p的异常表达与多种肿瘤发生、发展有关,在胰腺癌中miR-193a-3p通过靶向CCND1基因抑制癌细胞增长,可能具有抑制癌基因的作用[15]。lncRNA可以充当miRNA的前体来调节mRNA的稳定性,在肿瘤的诊疗中具有重大潜力。随着对lncRNA研究的深入,ZHUANG等[16]发现,lncRNA XIST可通过靶向miR-92抑制肝癌细胞的增殖和迁移,揭示lncRNA XIST/miR-92b/Smad7信号轴能调控肝癌的发展进程。另有研究显示,lncRNA XIST/miR-124/AR信号轴在膀胱癌的细胞增殖、迁移中发挥重要作用[17]。RSF1通过调节染色体结构参与多种细胞转录、复制过程,WU等[18]研究发现,RSF1在骨肉瘤细胞中高度表达,且与miR-193a-3p呈负相关,RSF1被证实是miR-193a-3p的直接靶点,lncRNA XIST可以抑制miR-193a-3p,调节其下游基因RSF1。本研究结果显示,敲降lncRNA XIST,lncRNA XIST、RSFI mRNA表达降低,miR-193a-3p mRNA表达升高,RSFI蛋白表达降低。本研究结合双荧光素酶报告基因实验、RT-qPCR实验发现,lncRNA XIST、miR-193a-3p与RSF1之间存在靶向关系。
综上所述,敲降lncRNA XIST能抑制骨肉瘤细胞增殖和迁移能力,可能是通过上调miR-193a-3p mRNA表达,下调RSFI mRNA和蛋白表达发挥作用。下一步应研究敲降lncRNA XIST是否存在其他调控机制来抑制骨肉瘤细胞增殖和迁移,为临床治疗骨肉瘤提供参考。
