土家药山姜水提物的安全性初步评价*
2022-02-17汪子荣吴美静许太静梁渝敏
汪子荣,吴美静,许 睿,许太静,向 露,梁渝敏,陈 希,向 娟,2,3
(1.吉首大学药学院,湖南 吉首 416000;2.土家医药传承与创新实验室国家民委重点实验室,湖南 吉首 416000;3.湖南省土家医药研究中心,湖南 吉首 416000)
山姜(Alpiniajaponica(Thunb.) Miq.)是姜科山姜属植物,产于我国东南部、南部至西南部各省区,生于林下荫湿处,山姜广泛分布于湖南省湘西地区[1].山姜又名和山姜、姜叶淫羊藿、九龙盘、九姜连、姜七等,在湘西地区又被称之为小杆子、小柑子、小甘草等.山姜具有抗溃疡、镇痛、抑菌、抗肿瘤、抗炎等作用[2-3],化学成分以萜类、黄酮类为主[4-6].湘西地区的土家医、苗医及普通百姓广泛使用山姜的根茎用于治疗感冒等呼吸系统疾病,山姜的常用药用部位为根茎,亦有人采用山姜的果实、种子、茎叶入药,主要用法为水煎服.目前,山姜的使用主要基于民间用药经验,尚缺乏对其药用安全性的评价,开展山姜药用安全性评价是保证其用药安全的重要措施.
为探究山姜水提物的安全性,本研究通过急性毒性试验和亚急性毒性试验对山姜的水提物进行初步的安全性评价,以小鼠的行为特征、体重变化、脏器系数、肌酐(CRE)含量、尿素氮(BUN)含量、谷丙转氨酶(GPT)活力、谷草转氨酶(GOT)活力作为安全性评价的重要依据,以期为山姜的临床研究及临床应用提供一定理论依据.
1 材料与仪器
1.1 试验动物
ICR小鼠,雄性,体重20~24 g,SPF级,试验动物许可证号为SCXK(湘)2019-0004,购于湖南斯莱克景达实验动物有限公司.在开始试验前,笔者对小鼠进行适应性饲养1周,即让小鼠自由进水、进食,使其适应生存环境.小鼠被饲养在相对清洁、安静、恒温(23 ℃±3 ℃)、恒湿(55%±15%)的环境中,日夜周期调节为12 h光照和12 h黑暗,小鼠可自由获得食物和水.本研究所有动物试验符合吉首大学生物医学伦理委员会规定.
1.2 药品及试剂
1.2.1 药材 山姜药材购于湘西土家族苗族自治州吉首市乾州农贸市场,产地吉首.此药材经吉首大学张代贵老师、向娟老师鉴定为姜科山姜属植物山姜的根茎.
1.2.2 试剂 肌酐、尿素氮、谷丙转氨酶、谷草转氨酶的检测试剂盒均购于南京建成生物工程研究所;通用型多聚甲醛固定液购于武汉赛维尔生物科技有限公司;水合氯醛购于天津市科密欧化学试剂有限公司.其他试剂均为市售的纯度为化学纯或分析纯试剂.
1.3 仪器
SUNRISE酶标仪(TECAN)、冷冻干燥机(宁波新芝生物科技股份有限公司)、旋转蒸发仪(瑞士步琪公司)、BM-500T系列生物显微镜(南京南派科技有限公司)、FB224电子天平(上海舜宇恒平科学仪器有限公司).
2 实验方法
2.1 山姜水提物的制备
称取适量干燥的山姜根茎,按照料液比1∶10的比例加入山姜根茎和水,采用加热回流方法提取2次,每次2 h,过滤后合并滤液,浓缩成浸膏状后冷冻干燥,置于4 ℃冰箱备用,计算得到山姜水提物的得率为17.8%.
2.2 急性毒性试验
按照成人(体重70 kg)可服用10 g生药的一般规则,计算出山姜人用给药剂量为0.143 g/kg,将人用给药剂量按体表面积法折算成小鼠的给药剂量,生药量为1.3 g/kg,即浸膏量0.23 g/kg.给药当天将小鼠按体重随机分成山姜水提物组和对照组,每组5只雄性小鼠.山姜水提物组小鼠以最大耐受剂量给药,以浸膏量5 g/kg溶于纯净水配成相应浓度的灌胃液,再以10 mL/kg的给药体积给药[7].小鼠给药前禁食12 h,称重之后进行1次灌胃给药(以5 g/kg给药剂量给药,此剂量大约是临床10 g剂量的22倍),对照组不做处理.对小鼠给药后,密切观察并记录前4 h山姜水提物组和对照组小鼠的状态,4 h后每间隔0.5 h观察1次,8 h后观察间隔时间延长,共观察7 d,记录此期间小鼠的行为特征及体重变化.
2.3 亚急性毒性试验
小鼠给药剂量的换算方法同2.2节,给药剂量分别为1.3,2.6 g/kg.给药当天将小鼠按体重随机分为山姜水提物低剂量组(给药剂量为1.3 g/kg)、高剂量组(给药剂量为2.6 g/kg)和对照组,共3组,每组5只雄性小鼠,对照组不做处理.每天用浸膏以纯净水配置成相应浓度的灌胃液对山姜水提物各剂量组小鼠进行灌胃,按照10 mL/kg的给药体积灌胃给药,每天灌胃1次,连续给药15 d.给药期间,每天观察记录小鼠的行为特征及体重变化.
2.4 尿素氮、肌酐含量及谷丙转氨酶、谷草转氨酶活力的检测
2.4.1 观测指标 每个试验快结束时(急性毒性试验第7 d,亚急性毒性试验第15 d),小鼠均需要在末次给药晚上禁食不禁水过夜.在两个试验结束后一天,即第8 d和第16 d,按10 mL/kg给药体积向小鼠腹腔注射4%水合氯醛,将小鼠麻醉后采血,血液分别置于有肝素钠和无肝素钠的离心管中,于3 000 r/min,4 ℃的离心机中离心10 min,获得的上清液分别为血浆和血清样品,样品置于-20 ℃冰箱备用,用于检测尿素氮、肌酐、谷丙转氨酶、谷草转氨酶等肝、肾功能生化指标.
2.4.2 尿素氮、肌酐含量的测定 待测血浆按照试剂盒说明配成相应的待测溶液后,利用酶标仪在520 nm波长处测定OD值,尿素氮含量的计算公式为:尿素氮(mmol/L)=(OD测定-OD空白)/(OD标准-OD空白)*10.
待测血浆按照试剂盒说明配成相应的待测溶液后,利用酶标仪在546 nm波长处测定吸光度.肌酐含量的计算公式为:肌酐(μmol/L)=(ΔA测定-ΔA空白)/(ΔA标准-ΔA空白)*C标准,其中ΔA=A2-K*A1(A1为加入酶溶液A后的吸光度值,A2为加入酶溶液B后的吸光度值,K为稀释因子,数值为186/246).
2.4.3 谷丙转氨酶活力、谷草转氨酶活力的测定 待测血清按照试剂盒说明配成相应的待测溶液后,利用酶标仪在505 nm波长处测定各管的OD值,OD绝对=OD测定-OD对照,根据试剂盒原始数据绘制标准曲线,将OD绝对代入标准曲线计算求得谷丙转氨酶、谷草转氨酶活力(卡门氏单位),其中1卡门氏单位为0.482 U/L.
2.5 脏器系数的计算
在急性和亚急性毒性试验中,对小鼠腹腔注射4%水合氯醛,麻醉后采血,处死小鼠后收集其肝脏、肾脏、心脏、脾脏、肾脏称重并计算脏器系数,脏器系数指实验动物某脏器的重量与其体重之比值(单位为mg/g).
2.6 组织病理学分析
将小鼠肝、肾、脾等组织置于4%甲醛固定液中固定后,经脱水、石蜡包埋、切片(切片厚约4~5 μm)、H&E(伊红和苏木素染色)染色,在光学显微镜下观察并采集图片,分析小鼠的组织病理变化.
2.7 统计学分析

3 结果分析
3.1 行为特征
在急性和亚急性毒性试验中,所有小鼠均未出现死亡.在急性毒性试验给药后的前8 h,山姜水提物组部分小鼠出现舔足、舔毛、精神不振等行为,在8 h后均恢复正常.在亚急性毒性试验中,给药后的第10天,山姜水提物高剂量组的部分小鼠出现竖毛现象.
3.2 体重变化
在急性毒性试验中,给药后的7 d,山姜水提物组和对照组小鼠的体重均有逐渐增长趋势,如图1所示.在进行亚急性毒性试验的15 d中,对照组小鼠的体重随着时间的延长而逐渐增加,山姜水提物低剂量组和高剂量组小鼠的体重呈缓慢增长的趋势,增长幅度低于对照组,如图2所示.

图1 急性毒性试验7天内小鼠的体重变化Fig. 1 Weight of Mice in 7 Days of the Acute Toxicity Test
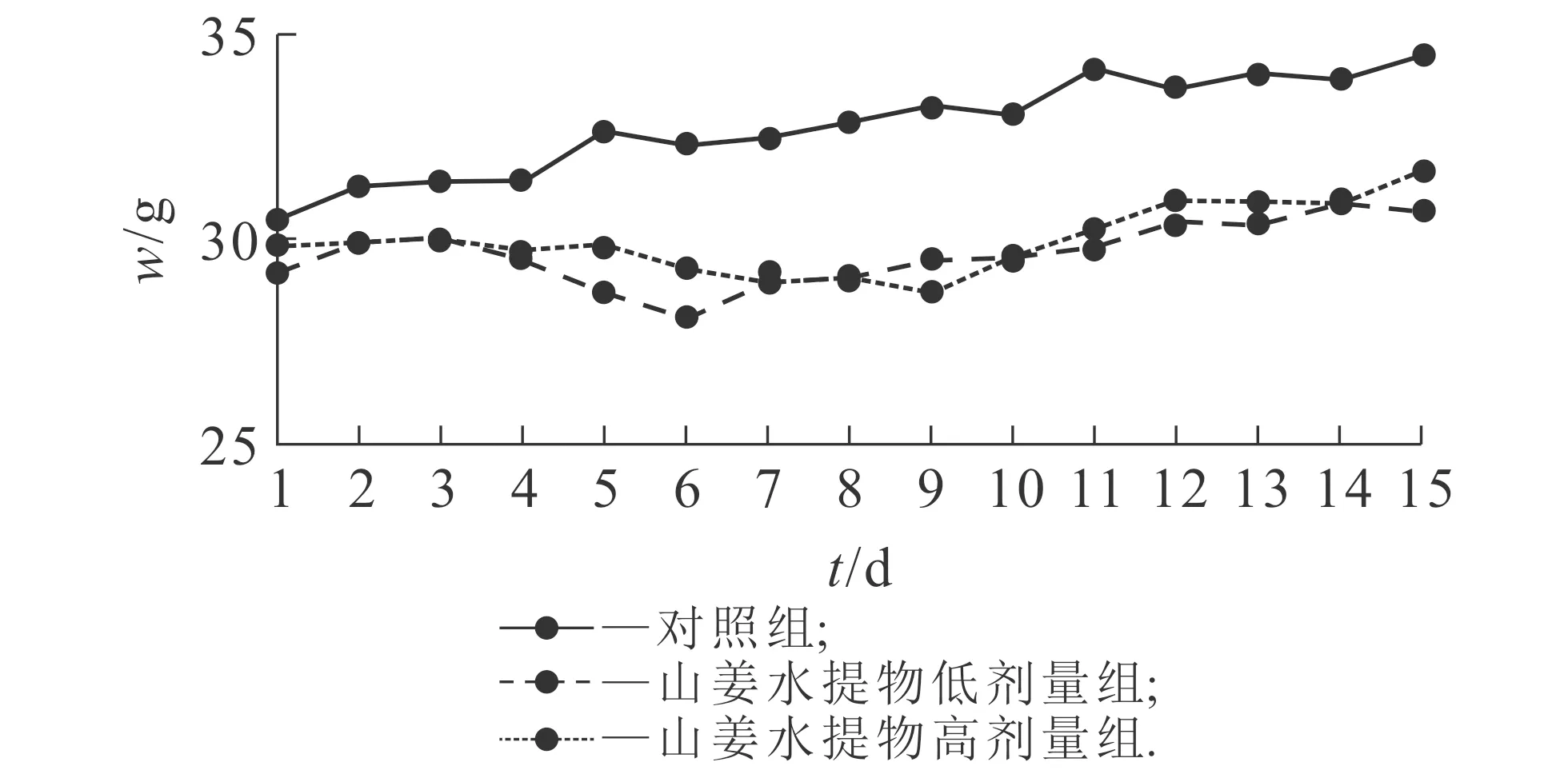
图2 亚急性毒性试验15天内小鼠的体重变化Fig. 2 Weight of Mice in 15 Days of the Subacute Toxicity Test
3.3 脏器系数
在急性毒性试验中,与对照组相比,山姜水提物组各器官的脏器系数差异无统计学意义(P>0.05),如表1所示.在亚急性毒性试验中,与对照组相比,山姜水提物高剂量组肝的脏器系数较高,差异具有统计学意义(P<0.05),山姜水提物低剂量组、高剂量组的心、肺、肾、脾脏器系数与对照组相比,差异均无统计学意义(P>0.05),如表2所示.
表1 急性毒性试验小鼠脏器系数

表2 亚急性毒性试验小鼠脏器系数
3.4 肝、肾功能生化指标
在急性毒性试验中,山姜水提物组的尿素氮、肌酐、谷丙转氨酶、谷草转氨酶指标与对照组相比,差异均无统计学意义(P>0.05),如表3所示.在亚急性毒性试验中,与对照组相比,山姜水提物高剂量组肌酐含量较低,差异具有统计学意义(P<0.05),山姜水提物高剂量组、低剂量组的尿素氮含量、谷丙转氨酶活力、谷草转氨酶活力与对照组相比,差异均无统计学意义(P>0.05),如表4所示.
表3 急性毒性试验小鼠肝、肾生化指标

表4 亚急性毒性试验小鼠肝、肾生化指标
3.5 组织病理学检查
肝组织H&E染色结果显示,对照组肝细胞索和肝血窦大致呈放射状排列,肝细胞圆润、饱满,肝板排列规则、整齐.与对照组相比,急性毒性试验中水提物组小鼠肝组织未见明显异常,见图3所示.

图3 急性毒性试验小鼠肝组织病理检查(×100)Fig. 3 Liver Histopathological Examination in Acute Toxicity Test
4 讨论
山姜在湘西土家族苗族自治州中广泛分布,其根茎在民间广泛用于治疗上呼吸道感染及一些慢性呼吸系统疾病的急性发作,但是其用药安全性尚未明确,仅有文献报道山姜果实的水煎液和热浸液无明显急性毒性和亚急性毒性[8].因此,本研究通过急性毒性及亚急性毒性试验对山姜根茎的用药安全性进行评价[9].急性毒性的常用评价方法包括LD50法、最大耐受剂量法、近似致死之剂量法、固定剂量法、上下法(阶梯法)[10]、累积剂量设计法[11]等.由于山姜在湘西地区的应用中认为毒性较小或无毒,因此本研究选择最大耐受剂量法对山姜根茎的用药安全性进行评价,为进一步评价其在人体中是否有慢性毒性,本研究进行了时长达15 d的亚急性毒性试验[12].
本研究结果发现,在急性和亚急性毒性试验中,给药后小鼠的精神状态和生活状态均表现良好,器官形态外观无病理性变化.在急性毒性试验中,山姜水提物给药组小鼠的脏器系数、尿素氮、肌酐含量、谷丙转氨酶活力、谷草转氨酶活力与对照组相比,均无明显差异,提示山姜根茎水提物无明显急性毒性.在亚急性毒性试验中,山姜水提物低剂量组和对照组相比,给药15 d后体重有差异,但其增长趋势基本一致,提示山姜水提物无明显毒性;山姜水提物高剂量组的肝系数与对照组相比较高,但小鼠的行为及状态均正常,且谷草转氨酶和谷丙转氨酶活力与对照组相比无明显差异,可能和体重较轻有关,因此认为山姜水提物没有明显的肝毒性;当肾脏功能受到损害,肾功能失代偿时血清肌酐水平会上升[13-14],而山姜水提物低剂量组、高剂量组的肌酐含量与对照组相比,均没有明显升高,提示山姜根茎水提物无明显肾毒性.
综上所述,山姜水提物的急性毒性和亚急性毒性不明显或较低,临床安全性上可视为较安全.本研究仅为初步安全性评价,尚未进行慢性毒性等试验研究,故山姜水提物的安全性仍有待进一步研究,以期为其临床应用和新药研发等增加理论依据.
