超高效液相色谱-三重四极杆质谱联用检测饮用水中N-亚硝胺类消毒副产物
2022-02-16古其会张菊梅郭伟鹏吴慧清张友雄韦献虎吴清平
孙 铭,古其会,张菊梅,郭伟鹏,吴慧清,张友雄,韦献虎,吴清平,*
(1.中国科学院广州化学研究所,广东 广州 510650;2.广东省科学院微生物研究所,华南应用微生物国家重点实验室,广东省微生物安全与健康重点实验室,广东 广州 510070;3.中国科学院大学,北京 100049)
亚硝胺具有“三致”毒性,是水中一类新型含氮消毒副产物,近年来以N-亚硝基二甲胺(N-nitrosodimethylamine,NDMA)为主的N-亚硝胺类消毒副产物在世界各地的水环境中(饮用水厂、污水处理厂等)频繁检测出[1-4]。饮用水作为食品饮料工业的重要原料,其安全性直接关系着食品饮料行业的健康发展。因此,检测饮用水中痕量N-亚硝胺,对评价饮用水水质,保证食品饮料水源的安全具有重要意义。
饮用水中N-亚硝胺的含量通常较低,因此在检测前需要进行浓缩以降低方法检出限,提高灵敏度,常用的方法主要有液液萃取(liquid-liquid extraction,LLE)法[5]、固相微萃取(solid phase microextraction,SPME)法[6]和固相萃取法[7-8]。其中,LLE需要大量有机溶剂,耗时费力。SPME虽然所需水样少,省时,但容易受到环境及操作条件的影响,而且对低挥发性的N-亚硝胺回收率和灵敏度较低,仅适用于废水中N-亚硝胺的检测[9]。而固相萃取能同时萃取多种不同性质低浓度的目标物质,可对大体积样品进行萃取,具有溶剂用量少,浓缩倍数高等优点[9]。此外,固相萃取还能克服LLE在复杂基质样品中易乳化的缺点[9]。
气相色谱-质谱联用[10-13]和气相色谱结合热能分析仪[14]已用于分析N-亚硝胺类物质,但主要用于分析挥发性和热稳定的N-亚硝胺[15-16]。采用带紫外荧光检测器的液相色谱和毛细管电泳方法检测N-亚硝胺也有报道,但灵敏度低,无法满足饮用水中痕量N-亚硝胺的检测需求[17]。已有文献报道[3,18-19]采用电喷雾电离源(electrospray ionization,ESI)的液相色谱-串联质谱方法能同时检测出饮用水中9种N-亚硝胺类消毒副产物,包括NDMA、亚硝基甲基乙胺(N-nitrosomethylethylamine,NMEA)、亚硝基二乙胺(N-nitrosodiethylamine,NDEA)、亚硝基吡咯烷(N-nitrosopyrrolidine,NPYR)、亚硝基吗啡(N-nitrosomorpholine,NMOR)、亚硝基二丙胺(N-nitrosodi-n-propylamine,NDPA)、亚硝基哌啶(N-nitrosopiperidine,NPIP)、亚硝基二丁胺(N-nitrosodi-n-butylamine,NDBA)、亚硝基二苯胺(N-nitrosodiphenylamine,NDPhA)。但N-亚硝胺中的NDMA、NMEA和NDEA分子质量较小,ESI对于这3种物质的检测灵敏度相比于其他6 种偏低,具有一定的局限性。利用大气压化学电离(atmospheric pressure chemical ionization,APCI)源对食品中小分子农药残留[20]和功能物质[21]的检测已取得显著效果,但在N-亚硝胺的液相色谱-质谱检测方法中鲜见采用APCI离子源进行分析[22]。
本实验采用固相萃取法对样品进行前处理,并考察流动相、洗脱剂及定容溶剂对9种N-亚硝胺类消毒副产物响应强度的影响。优化样品前处理及进样条件,采用APCI离子源,建立一种基于超高效液相色谱-三重四极杆质谱联用仪同时检测饮用水中9种N-亚硝胺的方法。本实验通过检测实际水样中的痕量N-亚硝胺,验证该方法的适用性,对于评价饮用水水质,进一步研究去除和控制饮用水中N-亚硝胺,保证食品饮料生产中饮用水安全具有重要意义。
1 材料与方法
1.1 材料与试剂
CNW椰壳活性炭固相萃取小柱(2 g/6 mL) 上海安谱实验科技股份有限公司;SB-C18RRHD色谱柱(2.1 mm×100 mm,1.8 μm) Agilent Technologies(上海)公司。
9种N-亚硝胺混标(2 000 mg/L甲醇溶液) 美国Supelco公司;NDMA-D6标准品(1 000 mg/L甲醇溶液)、NDPA-D14标准品(1 000 mg/L二氯甲烷溶液)美国O2si公司;二氯甲烷、甲醇、甲苯、乙腈、甲酸(均为色谱纯) Agilent Technologies(上海)公司;碳酸氢钠、乙酸铵、硫代硫酸钠、碳酸氢铵(均为分析纯)上海麦克林生化科技有限公司;高纯氮气(纯度>99.9%)广州市君多气体有限公司;水为Milli-Q超纯水。
1.2 仪器与设备
ExionLC AD /Triple Quad 5500+QTRAP超高效液相色谱-三重四极杆串联质谱仪 美国SCIEX公司;HSE-12D固相萃取装置(配真空泵) 天津市恒奥科技发展有限公司;MTN-2800D氮吹仪 天津奥特赛恩斯公司。
1.3 方法
1.3.1N-亚硝胺及内标标准溶液的配制
以甲醇为溶剂,采用购买的标准品梯度稀释得到9种N-亚硝胺及NDMA-D6的混合标准溶液,质量浓度依次为1、2、5、10、20、50、100 μg/L,另外,NDPA-D14作为定量内标,其质量浓度为20 μg/L。
1.3.2 实际水样的采集
取东江某水厂水源水及其供应区域内的管网水水样。针对管网水进行采集的过程中,将质量浓度为100 mg/L的硫代硫酸钠提前加入到棕色的采样瓶中,以脱去管网水中的余氯。采取的水样需在低温、避光条件下运回实验室,2 周内完成分析。
1.3.3 样品处理
采用固相萃取法对样本进行处理,在使用固相萃取小柱萃取之前,依次用6 mL二氯甲烷、12 mL甲醇和超纯水15 mL活化小柱。水样的pH值用碳酸氢钠将其调节至8.0左右,500 mL水样以3~5 mL/min的速率通过活化后的小柱。水样上样完后,在低压下抽60 min。最后,使用二氯甲烷3×5 mL完成洗脱,洗脱过程中的实际流速应控制在2~3 mL/min范围内,利用氮吹实现洗脱液的浓缩处理之后,向其中加入超纯水定容至0.5 mL,以备进样。
1.3.4 仪器检测
液相色谱条件:SB-C18RRHD色谱柱(2.1 mm×100 mm,1.8 μm);流动相由含有0.2%甲酸的10 mmol/L碳酸氢铵溶液(流动相A)和甲醇(流动相B)组成,流速0.4 mL/min,进样量20 μL,柱温40 ℃。流动相梯度洗脱程序:0~0.5 min,85% A、15% B;0.5~2.5 min,85%~5% A、15%~95% B;2.5~3.5 min,5% A、95% B;3.5~3.51 min,5%~85% A、95%~15% B;3.51~6.0 min,85% A、15% B。
质谱条件:采用APCI正离子多反应监测模式检测。气帘气压力30 psi;离子化电流3 μA;离子源温度350 ℃;喷雾气压力40 psi。
2 结果与分析
2.1 质谱条件的优化
采用高质量浓度(1 mg/L)的混标溶液,进行质谱条件的优化,在全扫模式下确定待测物的母离子和最优去簇电压,然后在子离子模式下确定定量和定性子离子及对应的最优碰撞能量。优化得到9种N-亚硝胺及回收率标准物质(NDMA-D6)和定量内标(NDPA-D14)的质谱参数,结果如表1所示。
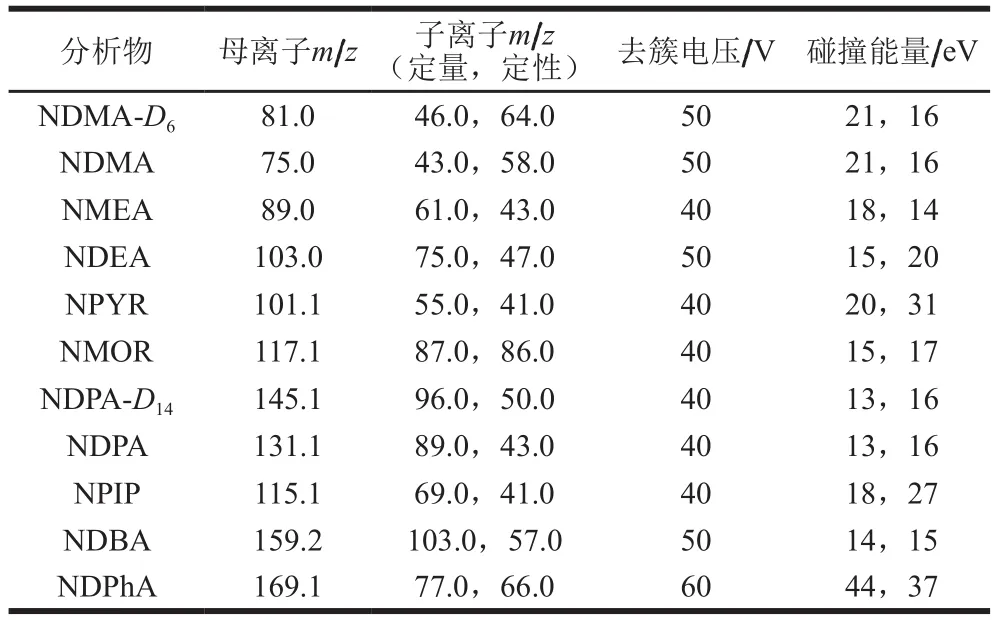
表1 9种N-亚硝胺及内标的质谱参数Table 1 Mass spectrometric parameters of nine N-nitrosamines and internal standard
2.2 流动相的选择
以含0.2%甲酸的10 mmol/L碳酸氢铵溶液和甲醇作为流动相时样品检测强度为100%,根据不同流动相条件下相对强度确定最佳流动相。如图1所示,当水-甲醇作为流动相时,NDMA、NMEA和NDEA的相对强度值小于50%,说明采用该流动相,NDMA、NMEA和NDEA的响应较差。同样,当采用0.2%甲酸-甲醇作为流动相时,NMEA、NPYR和NDEA的响应较差;采用含0.2%甲酸的10 mmol/L乙酸铵溶液和甲醇作为流动相时,NDMA、NMEA和NDBA的响应较差。因此,要保证9种N-亚硝胺都能够有较好的响应,在4 种流动相中甲醇和含有0.2%甲酸的10 mmol/L碳酸氢铵溶液作为流动相是最佳选择。
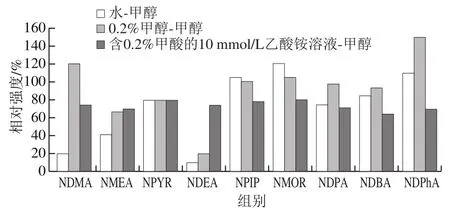
图1 流动相对9种N-亚硝胺相对强度的影响Fig. 1 Influence of mobile phase composition on relative intensities of nine nitrosamines
2.3 固相萃取材料的选择
已有报道[23]不经过浓缩预处理直接进样检测水中N-亚硝胺,但通常方法检出限为μg/L级别,而饮用水中N-亚硝胺质量浓度通常为ng/L级别,另外检测水源水时,直接进样会受到水体复杂基质的干扰,因此需要进行净化、浓缩后进样,才能满足实际饮用水的检测要求。固相萃取是常用于饮用水中N-亚硝胺的预浓缩方法,据文献[7,19,22]报道,相比其他填料(HLB、Ambersorb572)的固相萃取小柱,EPA521推荐的椰壳活性炭小柱保留效果较好,因此本实验选择椰壳活性炭作为固相萃取材料。
2.4 洗脱溶剂的选择
最终的洗脱溶剂应该充分结合被检测物质的实际回收率进行确定。实验分别使用二氯甲烷、甲醇和甲苯作为洗脱溶剂,测定其对9种N-亚硝胺的回收率影响,结果如图2所示。二氯甲烷对9种N-亚硝胺的回收率均较高,所以选择二氯甲烷作为本研究的洗脱剂。

图2 洗脱剂对9种N-亚硝胺回收率的影响Fig. 2 Influence of eluents on recoveries of nine nitrosamines
2.5 定容溶剂的选择
检测不同定容溶剂条件下9种N-亚硝胺的相对强度,结果如图3所示。当定容溶剂选择乙腈的情况下响应最差,甲醇和乙腈利于NDBA的响应,二氯甲烷利于NDPhA的响应,而超纯水作为定溶溶剂能够让其中绝大多数N-亚硝胺表现出较高的响应强度。因此,在本研究中选择超纯水作为最终定容溶剂。
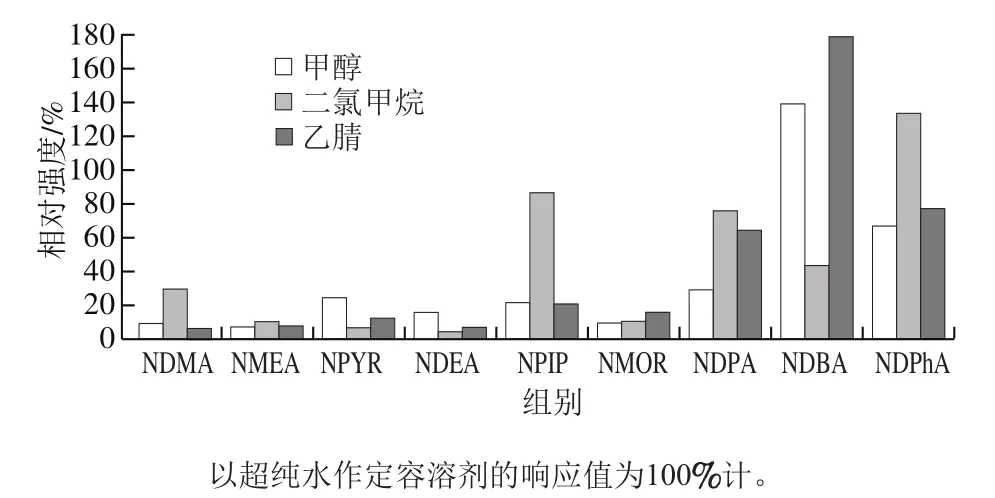
图3 定容溶剂对9种N-亚硝胺相对强度的影响Fig. 3 Influence of reconstitution solvents on relative intensities of nine nitrosamines
2.6 实验方法评价
2.6.1 标准曲线绘制
采用内标法定量,结果如表2所示,9种N-亚硝胺及NDMA-D6在0~100 ng/L质量浓度范围内表现出良好线性关系,并且其相关系数在0.996 9~0.999 5之间。根据3 倍信噪比对应的质量浓度确定检出限,在0.10~0.33 ng/L之间。相关报道[7,24]采用ESI离子源进行液相色谱-质谱检测水中9种N-亚硝胺时,对其中NDMA、NDEA和NMEA这些分子质量较小的N-亚硝胺检出限较低,通常为ng/L,而相关报道[22]采用APCI离子源进行液相色谱-质谱检测N-亚硝胺时,这些分子质量较小的N-亚硝胺检出限也为1 ng/L,本实验中NDMA、NDEA和NMEA的检出限降低到0.15~0.33 ng/L,低于1 ng/L,相比之前报道的灵敏度更高,利于检出水中更低含量的N-亚硝胺。本实验采用的超高效液相色谱-串联质谱检测方法,与之前报道的气相色谱-串联质谱[25]和液相色谱-串联质谱[26]相比,具有检测时间短的优点,可以在6 min内同时检测水中9种N-亚硝胺。
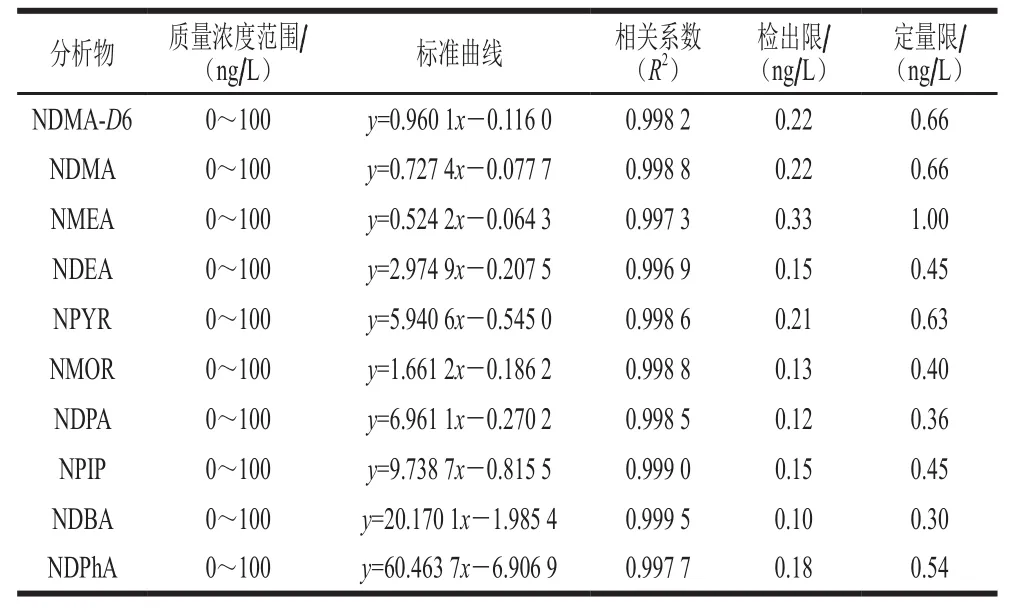
表2 9种N-亚硝胺的线性方程及其检出限和定量限Table 2 Linear equations and limits of detection and quantification of nine N-nitrosamines
2.6.2 回收率和精密度的测定
9种N-亚硝胺在源水和管网水中分别加标10 ng/L和50 ng/L时的回收率结果见表3。除在加标质量浓度为10 ng/L时,NDPhA的回收率在70%以下,其余回收率均在70%~130%范围内,满足EPA521的要求,无明显基质效应。相对标准偏差(relative standard deviation,RSD)均不大于10%,精密度良好。说明本方法的适用性较好,可以满足实际水体中N-亚硝胺的检测要求。
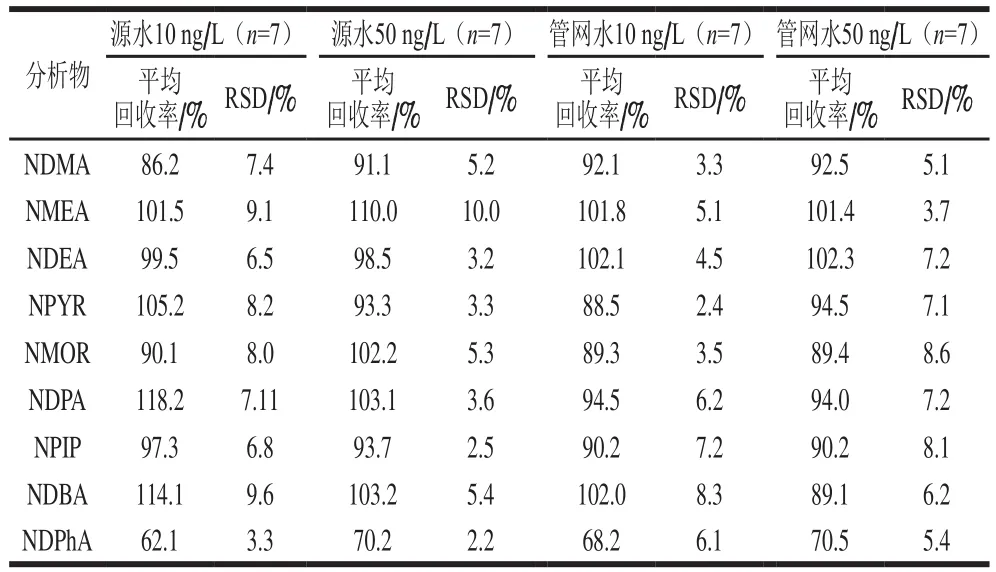
表3 9种N-亚硝胺的加标回收率及RSDTable 3 Recoveries and relative standard deviations of nine N-nitrosamines in spiked samples
2.7 饮用水的检测
为了验证本方法对实际饮用水中9种N-亚硝胺的有效性和适用性,选择珠江支流东江某水厂水源水(S1~S7)及其供水区域内管网水(T1~T7)进行污染调查,测定水样中9种N-亚硝胺类化合物含量,结果如表4所示,9种N-亚硝胺类消毒副产物在源水(S4、S5和S6)3个水样和管网水(T2、T3、T4和T6)4个水样,共7个水样中检测出N-亚硝胺。共有5 种N-亚硝胺被检出,分别为NDMA、NDEA、NMOR、NDPA和NDBA,其中NDMA的被检出频率最高,每个被检出的水样中都含有NDMA,其质量浓度为0.6~5.4 ng/L,这与相关全国性调查结果[27-29]类似。被检出的N-亚硝胺中NDBA的质量浓度最高,Chen Yingjie等[30]在针对长江中下游流域开展调查的过程中也得出了相类似的结论。之前大部分研究主要集中于N-亚硝胺中的NDMA[31-34],而忽视了除NDMA以外的N-亚硝胺的危害,根据调查的结果可知以后需对NDBA给予更多的关注。
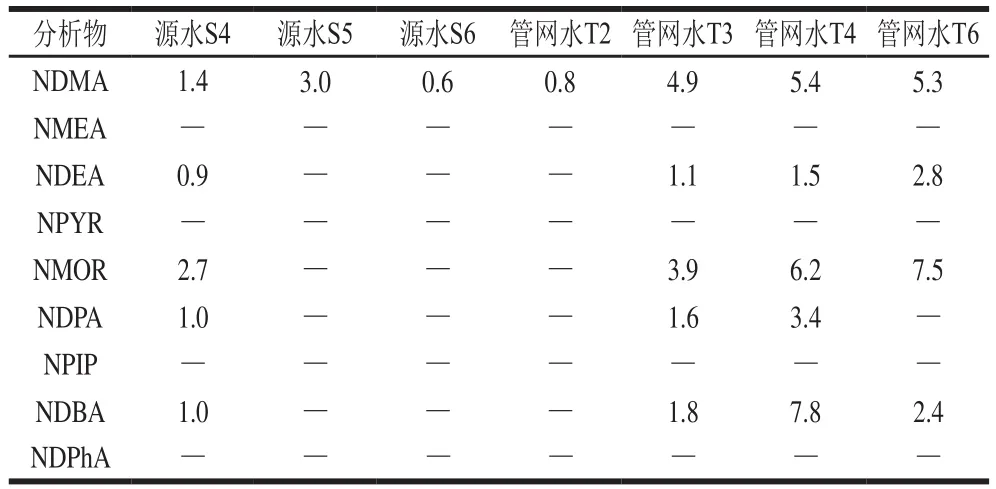
表4 实际水样检测结果Table 4 Results of determination of nine N-nitrosamines in actual water samples ng/L
3 结 论
本研究采用固相萃取法进行前处理,以APCI为离子源,建立水中9种N-亚硝胺的超高效液相色谱-串联质谱检测方法。与现有N-亚硝胺检测研究相比,本方法具有灵敏度高、检测速度快、适用性好的优点,能够满足饮用水中N-亚硝胺的检测需求。该方法的建立可以为系统性识别和评估食品饮料生产中N-亚硝胺的风险提供帮助。
