黄皮转录组测序及抗氧化相关基因的挖掘
2022-02-16刘照宇刘新婷白新宇曾教科
刘照宇,刘新婷,白新宇,李 雯,曾教科
(海南大学园艺学院,海南 海口 570228)
黄皮(Clausena lansium(Lour.) Skeels),属芸香科黄皮属,为原产于我国华南地区的特色水果,海南为主产区之一[1]。黄皮果实风味独特,具有较高的营养价值,可鲜食、加工以及药用,因而深得消费者喜爱[2-4]。黄皮前期的研究主要集中在种质资源和生理生化,包括采前品种的形态和理化性状、物候期、抗性、种质资源和育种等方面[5-7],采后的营养物质和生物活性功能[2,8-9],以及采后保鲜处理技术等[10-12]。而对黄皮果实分子层面的研究甚少,目前主要集中在一些基因的克隆及分子标记等方面[7,13-15]。
黄皮果实属于非呼吸跃变型,但果实在采后贮运过程中,生理代谢活动旺盛,导致果实成熟与衰老加速,品质劣变迅速。且黄皮果肉柔软多汁,果皮较薄,采后1~2 d即发生褐变,商品性下降。黄皮果实采后褐变主要是由多酚氧化酶(polyphenol oxidase,PPO)引起的酶促褐变,不同采后处理技术措施如低温[16]、热处理[17]和壳聚糖浸泡[18]等均可以在一定程度上提高黄皮果实超氧化物歧化酶(superoxide dismutase,SOD)、苯丙氨酸解氨酶(phenylalanine ammonialyase,PAL)、过氧化氢酶(catalase,CAT)和过氧化物酶(peroxidase,POD)等抗氧化酶活性,从而抑制PPO活性,减缓褐变的发生。本实验前期的研究结果也显示,采后热激(heat treatment,HT)和程序降温(low temperature conditioning,LTC)处理可以有效提高抗氧化酶SOD、PAL和POD等活性,从而抑制黄皮果实褐变,维持果实品质[11-12]。但是,对黄皮抗氧化酶编码基因的研究报道较少,研究进展缓慢,因此,有必要通过转录组学技术挖掘黄皮果实抗氧化酶编码基因。
转录组学可用于在mRNA水平上鉴定差异表达基因(differentially expressed genes,DEGs),从而解释园艺学科中一些理论和现象,果实采后成熟衰老过程中基因的变化可以通过转录组学分析进行研究。如Liu Xia等[19]利用转录组学研究了鲜枣果实采后表皮凹陷,筛选出1 210 个DEGs响应表皮凹陷,这些基因主要参与了碳水化合物代谢和苯丙烷途径等。Terol等[20]通过转录组学研究发现MADS-box转录因子参与调控柑橘果实早熟。Li Xin等[21]通过转录组学揭示了火龙果采后抗氧化机制的关键基因。而在黄皮果实转录组研究中,陆育生等[7]报道了利用黄皮转录组进行SSR挖掘和密码子偏好性分析,但对黄皮果实采后品质和抗氧化相关的转录组研究鲜见报道。
本实验采用转录组测序技术,对HT(50 ℃/30 s)、LTC(8 ℃/4 d)和对照(CK)(3 ℃)处理后3 ℃贮藏至第6天的黄皮果实进行测序,拟从转录组水平分析黄皮果实在不同处理技术下基因的表达差异,进而对DEGs进行基因本体论(Gene Ontology,GO)功能和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes,KEGG)富集分析,同时筛选出抗氧化相关的DEGs,旨在为今后黄皮果实褐变的调控研究和品质维持提供一定的理论基础。
1 材料与方法
1.1 材料与试剂
黄皮果实(“大鸡心”品种)采自海南省海口市永兴镇黄皮果园,在商业采收期采收,挑选大小、色泽、形状一致,无机械损伤及病虫害的果实,立即运回实验室进行处理。
氢氧化钠、酚酞、95%乙醇溶液、碳酸氢钠、硫代巴比妥酸、磷酸氢二钠、磷酸二氢钠、愈创木酚、核黄素、30%过氧化氢溶液、甲硫氨酸、氮蓝四唑、EDTA-Na2、福林-酚试剂、碳酸钠、没食子酸、DPPH、无水甲醇西陇化工股份有限公司。所有试剂均为国产分析纯。
1.2 仪器与设备
H1850R台式高速冷冻离心机 湘仪离心机仪器有限公司;紫外-可见分光光度计 北京普析通用仪器有限责任公司;2100生物分析仪 安捷伦科技有限公司。
1.3 方法
1.3.1 样品处理
本实验共分为3个处理:1)CK:果实直接低温3 ℃贮藏;2)HT:50 ℃热水浸泡30 s后转到3 ℃贮藏;3)LTC:果实在8 ℃预贮4 d后转到3 ℃贮藏。以采收当天为贮藏第0天,果实处理后贮藏至第8天,每2 d进行生理指标测定和冻样,每个处理3个生物学重复,每个重复10 个果实;另每个处理单独留取50 个果实,用于质量损失率及褐变指数的测定。
1.3.2 质量损失率与褐变指数测定
参考常文俊[12]的方法。
质量损失率采用称质量法,使用与0 d比较的相对质量损失表示,用式(1)计算:

果实褐变指数采用分级法测定。每个处理随机选取50 个黄皮果实进行褐变指数的观察。将黄皮褐变程度分为5个等级:1级果:褐变面积<1/4,2级果:1/4≤褐变面积<1/2,3级果:1/2≤褐变面积<3/4,4级果:褐变面积≥3/4,5级果为完全褐变的黄皮果实。

1.3.3 抗氧化酶与抗氧化活性测定
SOD活性使用氮蓝四唑(nitroblue tetrazolium,NBT)光还原法[22]进行测定。称取2.0 g黄皮果肉,加入5 mL磷酸缓冲液(0.1 mol/L,pH 7.8)冰浴研磨至匀浆后,4 ℃、12 000 r/min离心20 min,收集上清液待用。取0.1 mL上清液加入反应体系(50 mmol/L磷酸缓冲液,130 mmol/L甲硫氨酸溶液,750 μmol/L NBT溶液,100 μmol/L EDTA-Na2溶液,20 μmol/L核黄素溶液),摇匀,将试管置于4 000 lx白光条件下显色反应30 min,每15 min转管一次。以暗中对照管作空白(调零),在560 nm波长处测定反应液的吸光度,以每分钟NBT光还原抑制50%为1个酶活力单位,SOD活性用U/g表示。每个处理3个生物学重复。
CAT活性的测定采用紫外分光光度法[23]。称取2.0 g果肉,加入磷酸钠缓冲液(pH 7.0,含0.05%聚乙烯吡咯烷酮)中研磨至匀浆后,12 000 r/min离心20 min,收集上清液待用。取0.1 mL提取液,加入2.9 mL 10 mmol/L的H2O2溶液,在240 nm波长处测定3 min内吸光度的变化,以磷酸钠缓冲液为空白对照(调零),以每分钟吸光度减少0.01为1个酶活力单位,CAT活性用U/g表示。每个处理3个生物学重复。
POD活性的测定参考愈创木酚法[24]。称取2.0 g果肉,加入5 mL 0.1 mol/L乙酸缓冲液(pH 5.5,含1 mmol/L聚乙二醇、4%交联聚乙烯吡咯烷酮和1% TritonX-100)冰浴研磨至匀浆后,在4 ℃、12 000 r/min离心20 min,收集上清液待用。取0.2 mL提取液,加入3 mL愈创木酚和0.2 mL H2O2溶液,在470 nm波长处测定1 min内吸光度的变化,以蒸馏水代替提取液为空白对照(调零),以每分钟变化0.01为1个酶活力单位,POD活性用U/g表示。每个处理3个生物学重复。
抗氧化活性使用1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)自由基清除能力测定方法[25]。称取2.0 g果肉,加入少量石英砂和5 mL 1%盐酸-甲醇溶液冰浴研磨至匀浆,后定容至25 mL,4 ℃避光静置20 min,收集上清液。取0.1 mL提取液,加入2.9 mL 10 μmol/L的DPPH溶液,避光静置30 min,测定517 nm波长处的吸光度为As,以超纯水代替提取液作为对照,测定吸光度Ac,以无水乙醇代替DPPH作为空白对照,测定吸光度为Ao,DPPH自由基清除率按式(3)计算:
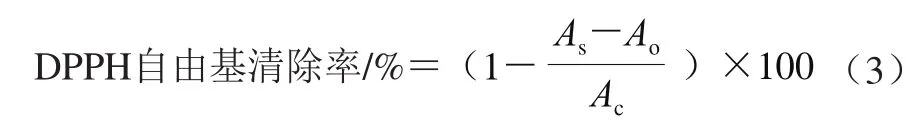
1.3.4 RNA提取与文库建立
根据褐变指数、抗氧化酶和抗氧化活性等结果分析,从贮藏第6天开始,HT和LTC处理促进抗氧化活性的提高。因此,选择贮藏第0天(编号0 d)和第6天(编号CK-6 d、HT-6 d、LTC-6 d)的黄皮果实进行转录组测序,每个样品3个生物学重复。采用RNA prep Pure植物总RNA提取试剂盒(天根生化科技有限公司)提取果实RNA,利用琼脂糖凝胶电泳、Nanodrop微量紫外分光光度计和2100生物分析仪检测RNA样品的浓度、纯度和完整性。样品检测合格后,由广州赛哲生物科技股份有限公司进行cDNA文库构建,并对构建好的文库用Illumina HiSeqTM进行转录组测序。
1.3.5 转录组测序数据分析
1.3.5.1 序列组装与功能注释
使用Trinity 2.2.0对所得过滤后的转录组reads数据进行拼接为contigs,将contigs连接得到scaffold,筛选掉含N片段得到Unigene库。使用BLASTX将所有组装的Unigene序列与Nr(http://www.ncbi.nlm.nih.gov,NCBI non-redundant protein sequences)、Swiss-Prot protein database、KEGG(http://www.genome.jp/kegg)、直系同源群集(Clusters of Orthologous Group,COG)/KOG(http://www.ncbi.nlm.nih.gov/COG)等数据库中已知序列进行比对(E-value<10-5),得到具有较高相似性的蛋白序列,从而得到Unigene对应的蛋白功能注释信息。
1.3.5.2 DEGs筛选及聚类分析
使用RSEM(RNA-Seq by Expectation-Maximization)软件做定量分析,基因表达量使用FPKM(fragments per kilobase of exon per million mappedfragments)表示[26]。然后使用edgeR软件(v3.14.0)筛选DEGs,筛选条件为错误发现率(false discovery rate,FDR)<0.05且|log2FC|>1。其中FDR通过对差异显著性P值进行校正得到;差异倍数(fold change,FC)表示所对比的样品间FPKM比值,log2FC为正值表明基因上调,反之则为下调。
聚类分析用于判断DEGs在不同处理条件下的表达模式。以不同处理DEGs的FPKM值为表达水平,做层次聚类分析,不同颜色的区域代表不同的聚类分组信息,同组内的基因表达模式相近,可能具有相似的功能或参与相同的生物学过程。
1.3.5.3 GO富集分析和通路富集分析
根据Unigene的Nr注释,使用BLAST2GO软件获取Unigene的GO信息,使用WEGO进行分类统计。通路显著性富集分析以KEGG通路为单位,应用超几何检验,找出DEGs相对于所有有注释基因显著富集的通路。以KEGG通路为单位,使用KOBAS进行通路富集分析。使用Pfam数据库对序列进行对比,确定基因类型,若Pfam无法预测,则使用基因功能确定。
1.4 数据处理
利用Excel 2007和SPSS 16.0等软件对实验数据进行统计分析,采用ggplot2包及pheatmap包作图。使用R语言进行相关性分析,并使用ggcorrplot作图。
2 结果与分析
2.1 HT和LTC处理对黄皮果实质量损失与褐变的影响
由图1可知,黄皮的质量损失率和褐变指数随贮藏时间延长整体呈上升趋势,LTC处理可以显著降低黄皮贮藏期间的质量损失率,而HT处理与CK相比差异不显著(图1A)。与CK相比,LTC处理也可以显著降低黄皮果实褐变指数,而HT处理的黄皮果实在贮藏第6天后才有显著差异(图1B),因此,LTC处理是一种有效的抑制黄皮果实失水和褐变的调控措施。这与枇杷[27]、梨[28]、桃[29]等其他水果上的研究结果基本一致,LTC处理可有效减少果实采后失水,延缓褐变,从而延长贮藏寿命。

图1 HT和LTC处理对黄皮果实质量损失(A)与褐变(B)的影响Fig. 1 Effects of HT and LTC treatment on mass loss (A) and browning (B) of wampee fruit
2.2 HT和LTC处理对黄皮果实抗氧化酶和抗氧化活性的影响
研究表明,黄皮果实采后衰老主要由褐变引起,而褐变主要由酚类物质的氧化导致[12],因此,通过采后处理提高抗氧化能力(抑制酚类氧化)是一种有效延缓黄皮果实褐变的措施。由图2可知,随着贮藏时间的延长,黄皮果实抗氧化酶活性均有不同程度的升高。CK组果实SOD和POD活性在贮藏第6天达到峰值,之后开始下降,至贮藏第8天时,明显低于HT和LTC处理组果实。CK组果实CAT活性和DPPH自由基清除率则在贮藏第4天达到峰值,至贮藏第6天开始,显著低于HT和LTC处理组果实。说明HT和LTC处理可显著推迟抗氧化酶和抗氧化活性高峰的出现,维持黄皮果实贮藏中后期较高的抗氧化性能,从而延缓褐变的进程,这与周开兵[17]和常文俊[11]等的研究结果类似,HT或LTC处理可以提高黄皮果实抗氧化酶活性,增强自由基清除能力,从而延长黄皮贮藏或货架寿命。类似的结果也在黄瓜和荔枝上得到证实,Wang Bin等[30]研究表明,贮前冷驯化(类似LTC)处理,可有效增强黄瓜抗氧化酶活性和基因表达,并且抗氧化酶及基因的变化在被诱导激活前有一个转变点,表明足够有效的抗氧化酶是低温贮藏所必需。Zhang Zhengke等[31]研究也发现,苹果多酚处理显著推迟荔枝果实SOD和POD活性高峰的出现,从而延缓贮藏中期褐变的发生。
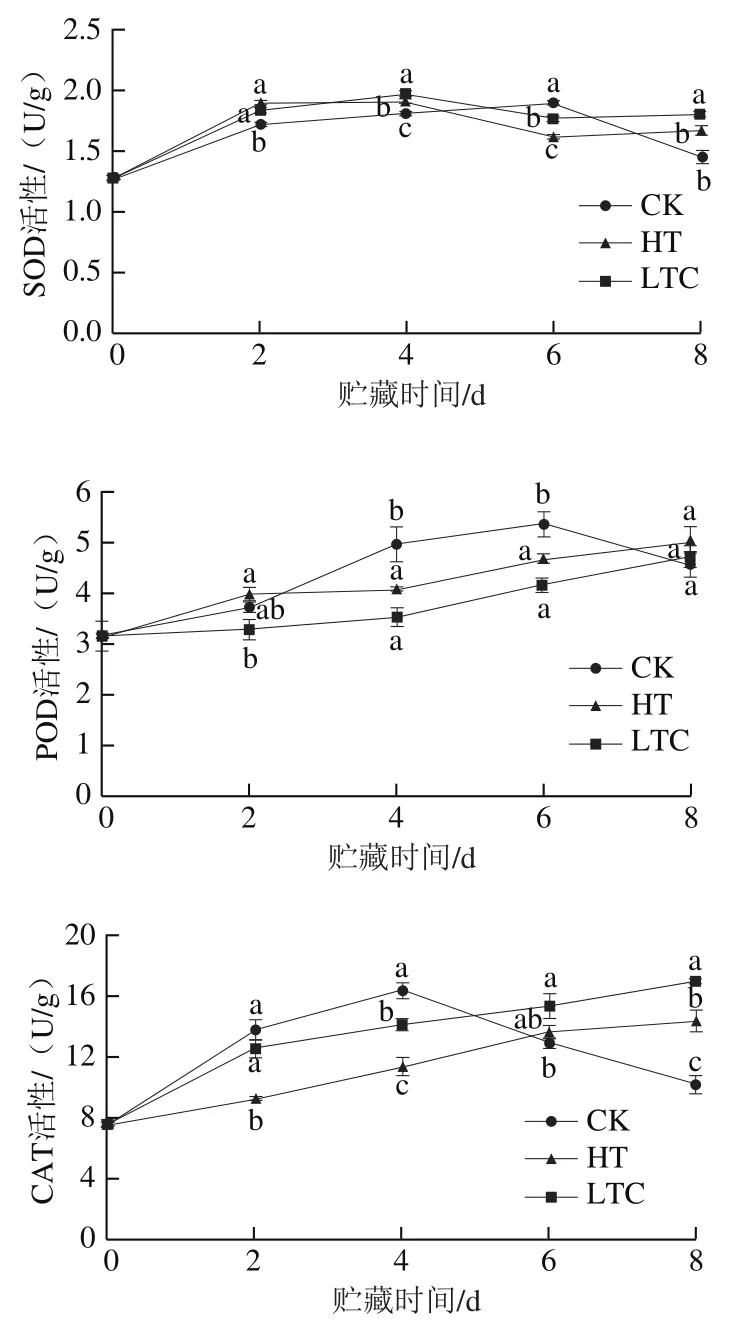
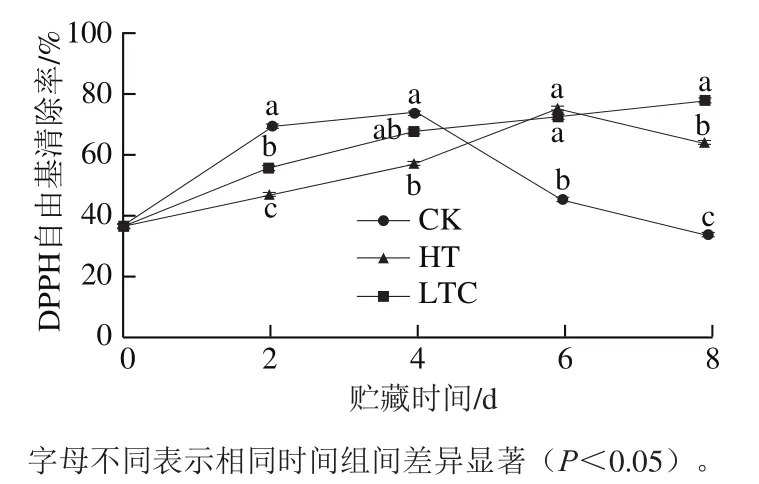
图2 HT和LTC处理对黄皮果实抗氧化酶和抗氧化活性的影响Fig. 2 Effects of HT and LTC treatment on antioxidant enzyme activities and antioxidant activity in wampee fruit during storage
2.3 RNA样品质量检测
根据测序公司要求,对提取的RNA样品进行浓度、纯度和完整性检测。如图3所示,所有RNA样品的OD260nm/OD280nm值在1.8~2.1之间,RNA完整值高于6.5,28S/18S核糖体亚基比率大于1。样品检测符合测序公司要求,可进行cDNA文库构建及转录组测序。
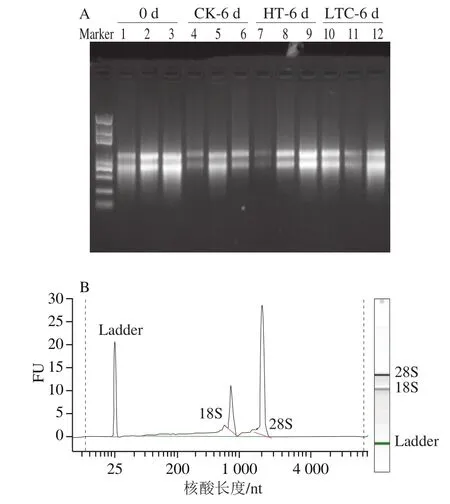
图3 琼脂糖凝胶电泳(A)和生物分析仪(B)检测RNA样品质量Fig. 3 Evaluation of RNA quality by agarose gel electrophoresis (A)and Agilent 2100 bioanalyzer (B)
2.4 转录组测序数据组装及分析
黄皮转录组测序共获得348 795 114 条原始reads,平均每个文库29 066 260 条;筛选过滤后获得345 649 476 条clean reads,占原始reads中99.1%,平均每个文库28 804 123 条,每个文库都产生超过3 G的clean bases,Q20的比例都超过96%,Q30都超过90%,说明测序质量较好。通过Trinity进行de novo组装后,从12个文库中共得到35 421个转录本,N50为1 744 bp,平均长度为1 208 bp,GC占比41.14%;获得27 353 条Unigene,N50为1 731 bp,平均长度1 138 bp,GC占比41.33%。其中在CK、HT和LTC中均表达的Unigene有20 219 个。
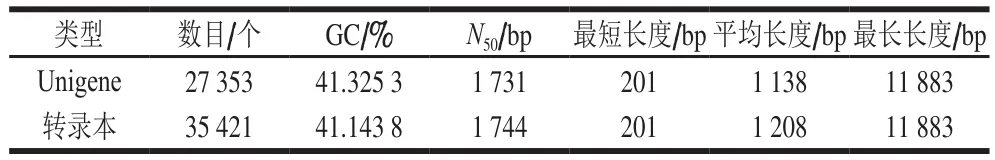
表1 黄皮转录组组装信息Table 1 Statistics of transcriptome assembly information of wampee
2.5 Unigene功能注释及分析
将得到的Unigene与Nr、Swiss-prot protein database、KEGG、COG/KOG等数据库中已知序列进行比较,获取Unigene注释信息。将四大数据库注释的Unigene通过Venn图分析不同Unigene与数据库之间的关系。分析得出,不同数据库都注释到的Unigene数为6 533 条,占注释Unigene总数的23.9%(图4A)。21 696 条Unigene被至少一个数据库成功注释,占全部Unigene的79.32%。Nr数据库比对注释获得的Unigene数最多,有21 658 条,占了Unigene总数的34%。其中有15 841 条Unigene比对到Swissport数据库。用于KEGG途径和KOG分析的分别有8 044 条和13 097 条Unigene(图4B)。转录本注释比例均高于Unigene,说明大部分基因得以注释(图4C)。37.95%的Unigene(10 381)与脐橙(Citrus sinensis)基因序列相似,其次是可可(6.59%,Theobroma cacao,1 802)和土瓶草(5.15%,Cephalotus follicularis,1 408)(图4D)。可注释基因绝大部分来自于同属芸香科的脐橙和同为热带植物的可可,注释结果可靠性较高。
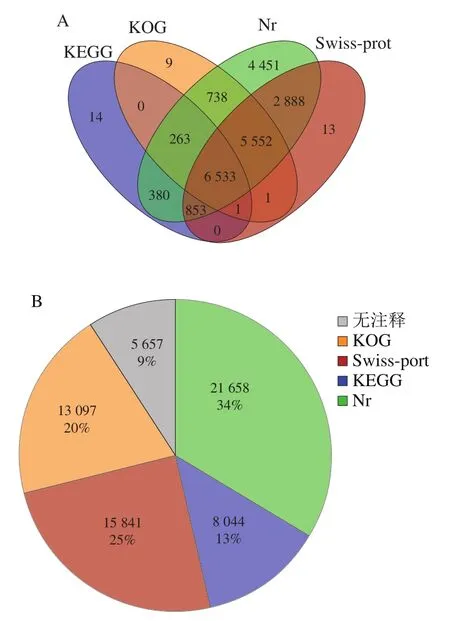
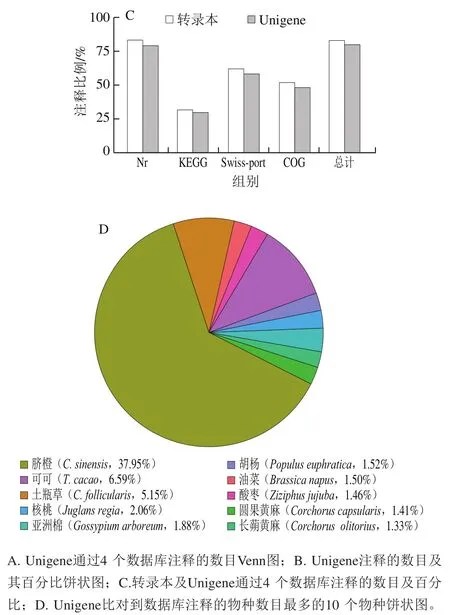
图4 转录组数据功能注释与分析Fig. 4 Functional annotation of RNA-Seq data for each database
2.6 DEGs筛选结果
为筛选出DEGs,将CK-0 d vs CK-6 d、CK-6 d vs HT-6 d、CK-6 d vs LTC-6 d转录组数据分别进行比较。由图5可知,CK-0 d vs CK-6 d,共筛选出9 342个DEGs,其中CK-6 d组相对于CK-0 d组下调表达基因3 800 个,占总差异表达40.7%,上调表达基因5 542个,占总差异表达59.3%。CK-6 d vs HT-6 d,共筛选出1 631个DEGs,其中HT-6 d下调表达基因754个,占总差异表达46.2%,上调表达基因877个,占总差异表达53.8%。CK-6 d vs LTC-6 d,共筛选出5 404个DEGs,其中LTC-6 d下调表达基因3 097个,占总差异表达57.3%,上调表达基因2 307个,占总差异表达42.7%。
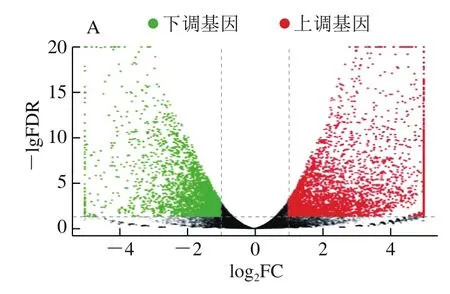
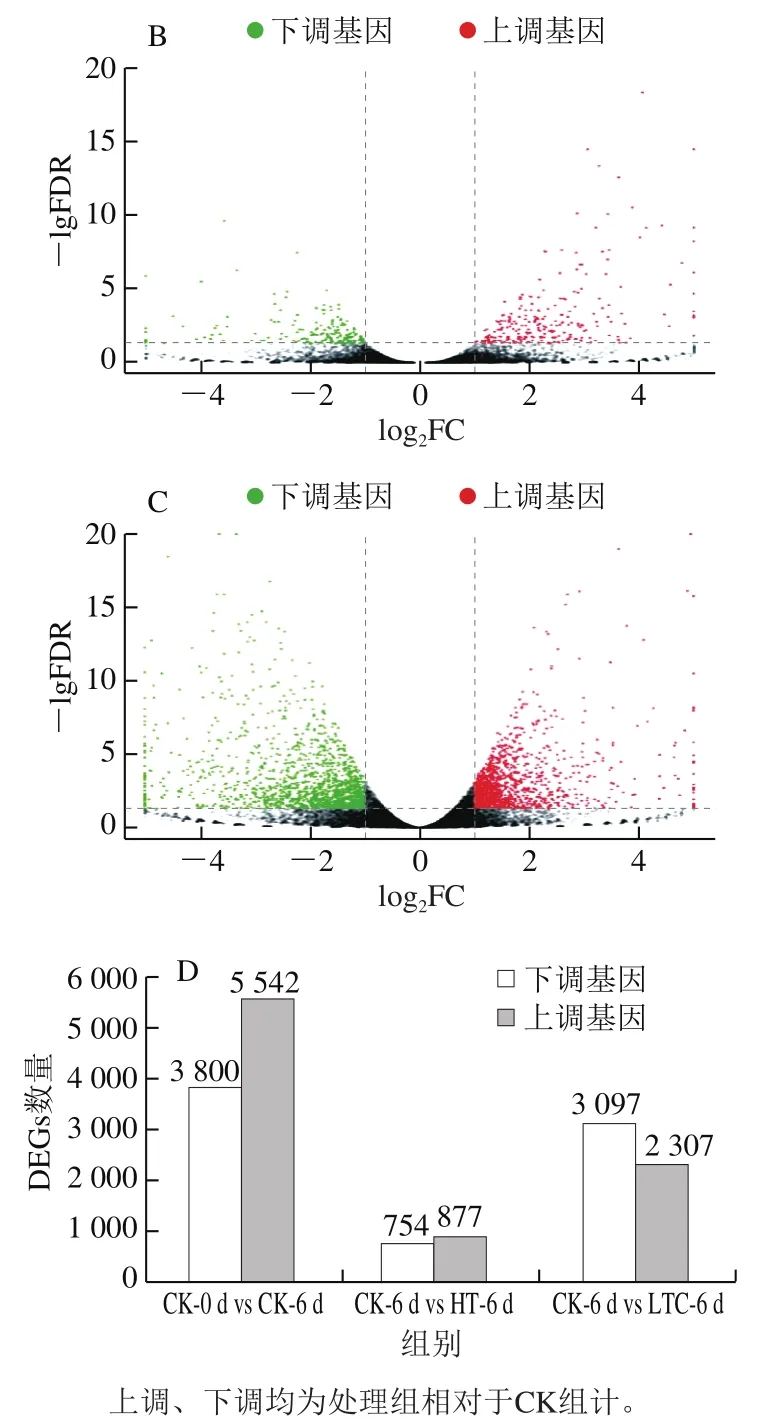
图5 CK-0 d vs CK-6 d(A)、CK-6 d vs HT-6 d(B)、CK-6 d vs LTC-6 d(C)对比DEGs火山图和DEGs数量(D)Fig. 5 Volcano plots of DEGs in control group on day 0 versus day 6 (A),control group on day 6 versus HT group on day 6 (B), control group on day 6 versus LTC group on day 6 (C), and barplot of DEGs number (D)
2.7 DEGs GO富集分析
对不同处理的黄皮果实产生的DEGs进行GO富集分析。由图6可知,对CK-0 d vs CK-6 d、CK-6 d vs HT-6 d、CK-6 d vs LTC-6 d进行显著富集,发现3 组比较中DEGs在分子功能、生物过程和细胞组成三大功能类别均有分布。3 组比较产生的DEGs在GO富集分析中呈现一定共性,在生物过程类别中,DEGs主要富集在代谢过程、细胞过程、单细胞体过程;在细胞组分中,DEGs主要富集在细胞、细胞膜、细胞器;在分子功能中,DEGs主要富集在催化活性、结合。DEGs在代谢过程、细胞器、催化活性等的功能分类,说明HT、LTC处理改变了黄皮果实内部的代谢和酶的催化功能。
2.8 DEGs通路显著性富集分析
对3 组比较产生的DEGs继续进行通路显著性富集分析,CK-0 d vs CK-6 d共有1 392个基因被注释到126 条KEGG代谢通路中;CK-6 d vs HT-6 d组有208个基因被注释到86 条KEGG代谢通路中;CK-6 d vs LTC-6 d组有747个基因被注释到122 条KEGG代谢通路中。如表2所示,3 组比较中都显著富集的代谢通路有信号转导、糖代谢和次生代谢产物生物合成等,这些途径大多与黄皮果实采后生理代谢相关。并且,苯丙素生物合成、黄酮类化合物的生物合成和植物激素信号转导等途径与黄皮果实抗氧化物质代谢相关,可能参与了黄皮果实采后氧化褐变调控。

表2 黄皮褐变相关通路(P<0.05)Table 2 Pathways related to the browning process of wampee fruit (P < 0.05)
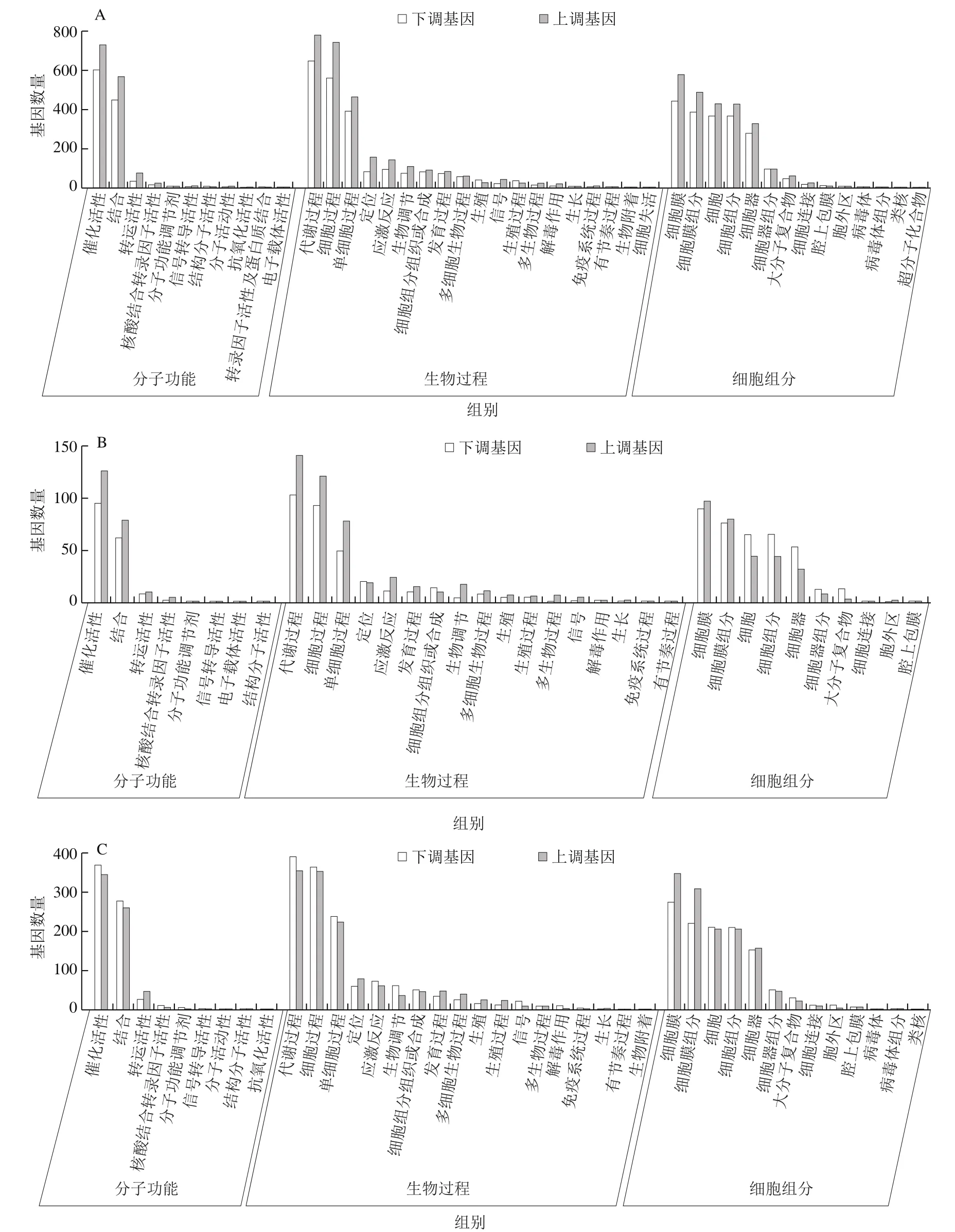
图6 CK-0 d vs CK-6 d(A)、CK-6 d vs HT-6 d(B)和CK-6 d vs LTC-6 d(C)中DEGs的GO富集结果Fig. 6 GO enrichment of DEGs in control group on day 0 versus day 6 (A), control group on day 6 versus HT group on day 6 (B), and control group on day 6 versus LTC group on day 6 (C)
2.9 抗氧化相关基因筛选与差异表达
PAL、SOD、CAT、POD、APX、GR、GPX和GST等为常见的抗氧化酶编码基因,在抑制果实褐变、品质劣变等方面起着重要的作用[32-35]。为了进一步分析在不同处理条件下诱导差异表达的抗氧化酶编码基因,在转录组数据中筛选出了76个抗氧化相关DEGs(图7),其中,CK-0 d vs CK-6 d比较有62个抗氧化相关基因,CK-6 d相对于CK-0 d下调基因17个,上调基因45个;CK-6 d vs HT-6 d比较有7个抗氧化相关基因,HT-6 d下调基因4个,上调基因3个;CK-6 d vs LTC-6 d比较有31个抗氧化相关基因,LTC-6 d下调基因24个,上调基因7个;HT-6 d vs LTC-6 d比较有34个抗氧化相关基因,LTC-6 d下调基因26个,上调基因8个。在4 组对比中可以发现,抗氧化基因在0 d和6 d中、不同处理中均存在差异表达。不同的抗氧化基因可能受不同处理诱导而参与黄皮果实品质劣变过程。

图7 4 组对比抗氧化性相关DEGs数目Fig. 7 Number of up-regulated and down-regulated genes associated with antioxidant activity
利用基因表达量热图,进一步分析这76个抗氧化相关基因的差异表达模式(图8A)。结果显示,第I、II类基因均在黄皮贮藏过程中下调表达,说明这两类基因可能与黄皮果实采后正常衰老过程有关。与CK相比,HT和LTC处理均显著抑制了第IV类基因(1个PAL基因、4个POD基因、1个GPX基因、7个GST基因)表达的上升,并与黄皮果实贮藏前期抗氧化酶活性的变化趋势一致;相关性分析表明,第IV类基因与抗氧化活性(DPPH自由基清除率)呈负相关或相关性较小,而与褐变指数正相关(图8B),说明第IV类基因可能通过降低贮藏前期抗氧化活性强度,从而维持贮藏中后期较高的总抗氧化活性,达到延缓褐变的效果。HT处理显著诱导第V类基因(1个CAT基因、1个POD基因、3个GST基因、1个APX基因)的上调表达,LTC处理显著诱导第VII(3个POD基因、2个SOD基因、1个GST基因)和X类基因(2个POD基因、2个APX基因、1个GST基因、1个GPX基因)的上调表达,相关性分析表明,第VII类基因与DPPH自由基清除率正相关或相关性不显著,而与褐变指数负相关或相关性不显著(图8B),说明这一类基因可能不是控制褐变的关键基因;第V、X类基因均与DPPH自由基清除率和褐变指数正相关(图8B),说明这两类基因可能在黄皮果实中后期发挥作用,参与褐变的抑制。

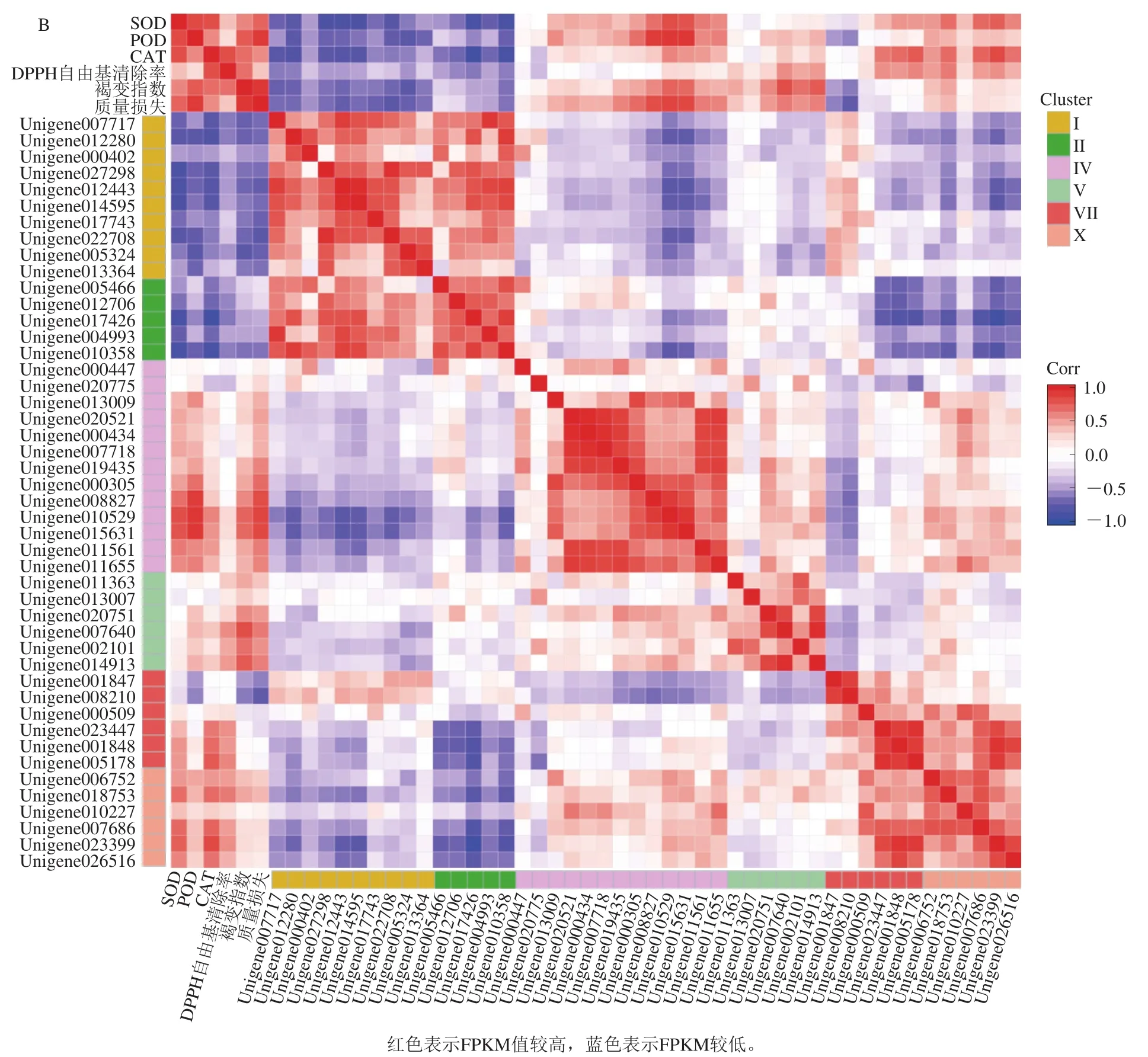
图8 黄皮果实抗氧化相关DEGs表达量热图(A)及其与抗氧化和褐变相关性分析(B)Fig. 8 Heatmap analysis of antioxidation-related DEGs (A) and their correlation with antioxidant activity and browning (B) in wampee fruit
HT和LTC处理对果实抗氧化酶活性及相关基因诱导的效果与其他果实报道类似,Huan Chen等[36]研究表明,HT处理可上调SOD、CAT、APX等抗氧化相关基因表达,延缓桃果实采后低温贮藏过程中的褐变。Li Xia等[37]研究表明,LTC处理可通过持续诱导抗氧化系统相关酶活性,从而延缓红薯褐变的发生。说明提高抗氧化活性是延缓果实褐变发生的重要途径,相关研究报道,冷驯化[30]、乙醇[38]、UV-C[39]、苹果多酚[31]和褪黑素[40]等处理均可通过增强SOD、POD、CAT等酶和抗氧化活性,诱导相关基因的表达,从而延缓果实褐变的发生。
3 结 论
本实验采用HT(50 ℃/30 s)、LTC(8 ℃/4 d)和CK(3 ℃)处理黄皮果实并3 ℃贮藏,发现LTC处理能有效抑制黄皮果实失水和褐变,HT和LTC处理可以显著推迟黄皮果实抗氧化酶和抗氧化活性高峰的出现,增强自由基清除能力,从而延长贮藏或货架寿命。对第0天和第6天的黄皮果实RNA进行测序分析,共得到35 421个转录本;并在CK-6 d vs HT-6 d和CK-6 d vs LTC-6 d中分别发现1 631个和5 404个DEGs。GO富集分析结果显示,这些DEG主要集中在生物过程中的代谢过程、分子过程。KEGG通路富集分析这些DEGs主要集中于苯丙素生物合成、黄酮类化合物的生物合成和植物激素信号转导途径等。从黄皮转录组数据中筛选得到76个抗氧化酶相关编码基因,基因表达量热图和相关性分析结果表明,这76个基因的表达模式可以聚为10 类。HT和LTC处理通过抑制第IV类基因表达的上升,降低黄皮果实贮藏前期抗氧化活性强度,从而维持贮藏后期较高的总抗氧化活性延缓褐变的发生。HT和LTC处理分别通过诱导第V类和第X类基因的表达,增强贮藏后期抗氧化活性,从而达到延缓褐变发生。因此,HT和LTC分别通过不同的途径提高黄皮果实贮藏过程中的抗氧化能力,其中第IV、V、X类基因可能为抑制黄皮褐变的关键基因。本研究为黄皮的品种选育和品种改良等提供理论基础。
