酸性蛋白酶对酸肉发酵过程中菌群结构和风味品质的影响
2022-02-16李文杰白艳红米瑞芳熊苏玥王守伟
李文杰,白艳红,*,陈 曦*,米瑞芳,熊苏玥,王守伟
(1.郑州轻工业大学食品与生物工程学院,河南 郑州 450001;2.中国肉类食品综合研究中心,北京 100068)
传统酸肉以猪肉为原料,采用自然发酵工艺生产,是侗族、苗族、布依族等少数民族的特色发酵肉制品,具有风味独特和营养丰富等特点[1]。传统酸肉通常采用自然接种的方式进行发酵,生产所采取的工艺、环境条件和地区差异可以筛选和富集不同类型和代谢特征的微生物群落,从而产生多种多样的风味和功能组分。传统酸肉中普遍存在的优势细菌包括乳杆菌属、片球菌属、葡萄球菌属和微球菌属等,真菌则以酵母居多,包括汉逊酵母属、毕赤酵母属等[2]。酸肉发酵过程中,微生物和内源酶促使肌肉蛋白和脂肪发生降解,进而产生酯类、醇类、酸类、游离氨基酸、抗氧化肽等多种风味物质和营养物质[3-4]。
采用传统自然发酵方法生产酸肉,发酵时间长,产品质量不稳定。发酵肉制品的风味和营养品质与肌肉蛋白分解和转化密切相关,利用外源添加的蛋白酶加速肌肉蛋白分解转化,可在不损失营养风味的前提下缩短发酵肉制品的生产周期。目前外源蛋白酶在发酵香肠中的应用研究报道较多。例如,酸性蛋白酶、风味蛋白酶和脂肪酶的添加可将发酵香肠的生产周期缩短50%~60%[5];酸性蛋白酶、风味蛋白酶和酯酶的添加可以改善发酵香肠的质地、弹性和黏聚性,并提高产品的风味感官品质[6];酸性蛋白酶的添加还可提高羊肉发酵香肠的红度值,改善产品色泽及感官风味品质[7]。另外,中性蛋白酶和真菌蛋白酶的应用可促进具有抗氧化活性的小肽等化合物产生,从而提高发酵香肠提取物的抗氧化活性[8]。然而,目前尚无外源蛋白酶在酸肉生产中的应用研究报道。
因此,为阐明外源蛋白酶对酸肉发酵过程中菌群结构变化、理化特性和感官风味品质的影响,本研究通过高通量测序分析酸性蛋白酶对酸肉发酵过程中细菌和真菌群落结构的影响,同时利用气相色谱-质谱等方法分析酸性蛋白酶对酸肉中挥发性风味物质、游离氨基酸等重要理化指标的影响,并对微生物和挥发性风味物质之间的相关性进行分析。本研究结果可为酶法发酵酸肉工艺提供参考依据和数据支撑。
1 材料与方法
1.1 材料与试剂
猪五花肉(肥瘦比3∶7) 北京中瑞食品有限公司;红曲米 福建古田县天鲜农产品有限公司;食盐、葡萄糖 市售;食品用酸性蛋白酶(50 000 U/g)安琪酵母股份有限公司。
细菌基因组DNA提取试剂盒 天根生化科技(北京)有限公司;真菌基因组DNA提取试剂盒 德国Qiagen公司;C5~C20系列正构烷烃标准溶液 美国Sigma公司;茚三酮显色液、氨基酸混合标样 日本和光纯药工业株式会社;氦气(>99.999%) 北京氦普北方气体工业有限公司。
1.2 仪器与设备
TG-Wax MS毛细管色谱柱(30 m×0.25 mm,0.25 μm)、1310气相色谱-TSQ 8000三重四极杆质谱联用仪 美国Thermo Scientific公司;57330-U手动进样器、50/30 μm聚二乙烯苯/碳分子筛/聚二甲基硅氧烷萃取针 美国Supelco公司;L-8900全自动氨基酸分析仪日本日立公司。
1.3 方法
1.3.1 酸肉的制作
原料肉预处理(切成3 cm×5 cm×0.5 cm的薄片)→加入8%红曲米、5%食盐、1%葡萄糖和不同比例的酸性蛋白酶混匀→搅拌均匀→装坛、密封→25 ℃发酵[9]
3个实验组:CG(对照组,不添加酸性蛋白酶)、E1(酸性蛋白酶25 U/g)和E2(酸性蛋白酶250 U/g)。每个实验组酸肉总质量均为6 kg(每坛0.5 kg,共12 坛)。
1.3.2 酸肉的微生物、pH值、游离氨基酸和挥发性风味物质测定
酸肉发酵时间共计21 d。除0 d样品直接取样外,发酵7、14、21 d每个实验组随机取3 坛样品进行微生物群落、pH值、游离氨基酸和挥发性风味物质测定。
1.3.2.1 微生物群落检测
每个实验组取同一时间样品3 份混匀,分别称取混合样品25 g,加入225 mL无菌生理盐水,拍打均质后4 ℃振荡30 min,静置10 min后取上清液离心收集沉淀。参考细菌基因组提取试剂盒说明书步骤提取样品细菌群落总DNA;参考真菌基因组提取试剂盒说明书步骤提取样品真菌群落总DNA。DNA样本经1%的琼脂糖电泳检测后,送至北京诺禾致源科技股份有限公司,分别采用341F和806R引物扩增细菌16S rRNA V3~V4区、ITS5-1737F和ITS2-2043R引物扩增真菌ITS1区。高通量测序采用基于Illumina HiSeq技术平台的双端测序法。测序数据经过处理后[10-11],利用Uparse软件以一致性97%作为标准划分操作分类单元(operational taxonomic units,OTUs),采用Silva数据库进行比对[12],利用QIIME软件计算α多样性指数。
1.3.2.2 pH值测定
参照GB 5009.237—2016《食品pH值的测定》方法。
1.3.2.3 游离氨基酸测定
参考张苏平等[13]的方法测定游离氨基酸含量,上机测定前经0.22 μm过滤器过滤。
1.3.2.4 挥发性风味物质测定
参照Montanari等[14]的方法并略做修改。称取5 g酸肉,切碎后放于15 mL顶空瓶底部,加入3-辛醇(0.48 mg/mL)1 μL作为内标。将老化好的萃取针插入顶空瓶中,通过手柄推出石英纤维头,使其暴露在顶空气体中。将顶空瓶置于50 ℃恒温水浴中萃取30 min后,将石英纤维头推回针头内并拔出,然后插入进样口解吸5 min。
色谱条件:TG-Wax MS毛细管柱(30 m×0.25 mm,0.25 μm);载气为高纯氦气,氦气流速1.0 mL/min;进样口温度230 ℃。升温程序:起始温度40 ℃,保持3 min;以10 ℃/min升至50 ℃;再以4 ℃/min升至120 ℃;最后以12 ℃/min升至230 ℃,保持5 min。
质谱条件:离子源温度280 ℃,电离方式为电子电离,电子能量70 eV;全扫描模式采集信号,扫描质量范围35~400 u。
定性与定量分析:检索NIST 11数据库,结合C5~C20系列正构烷烃混标计算保留指数(retention index,RI),对挥发性组分进行定性分析,利用内标3-辛醇计算挥发性化合物的含量。根据定量结果和文献中报道的阈值[15],计算得到香气活性值(odor activity value,OAV)。
1.3.3 感官评定
参考冉春霞等[16]的方法对成熟酸肉进行感官评定。由10 名发酵肉研究人员(男女各5 名)组成评价小组,按表1评分标准进行。

表1 酸肉感官评分标准Table 1 Criteria for sensory evaluation of sour meat
1.4 数据处理
2 结果与分析
2.1 酸性蛋白酶对酸肉发酵过程中细菌群落的影响
2.1.1 细菌群落测序数据质量和OTU分析
酸肉样品所获得的细菌序列条数平均值为78 391 条。如图1所示,所有样品的稀释曲线都进入平台期,说明测序深度基本覆盖样品中所有细菌,符合分析要求。

图1 酸肉样品细菌稀释曲线(A)和OTU数分布(B)Fig. 1 Rarefaction curves for bacteria (A) and distribution of bacterial OTUs in sour meat samples (B)
按照97%相似度对所有序列进行聚类分析,共获得686个OTU,涵盖9 门241 属。其中CG-0 d样品的OTU数量最高,其他样品的OTU数量相对较低,可见酸肉发酵过程中细菌群落组成发生了较大变化。
2.1.2 细菌群落α多样性分析
对不同样品在97%一致性阈值下的细菌群落α多样性进行统计(表2),所有样品的覆盖率均大于0.99,说明测序结果可信。其中CG-0 d样品的Simpson指数和Chao1指数最高,这与Lü Jing等[18]对酸肉的研究结果类似,即0 d样品的细菌多样性在所有样品中最高。这可能是由于发酵过程中乳杆菌等细菌逐渐占据优势地位,从而降低了样品中细菌丰富度。整个发酵过程中,其他样品的细菌多样性呈波动趋势。

表2 酸肉样品中细菌群落α多样性Table 2 α-Diversity indexes of bacterial community in sour meat samples
2.1.3 细菌群落丰度分析
如图2A所示,除0 d样品,厚壁菌门(Firmicutes)是酸肉发酵过程中的优势细菌门(95.38%~99.90%),这与其他研究报道一致[18-19]。在0 d样品中,拟杆菌门(Bacteroidetes)是主要优势菌门(40.61%),原因在于酸肉中添加了红曲米。红曲米是以稻米为原料经红曲菌发酵而成,含有多种功能成分,包括红曲色素、洛伐他汀、γ-氨基丁酸等[20]。为改善酸肉色泽和营养品质,本研究在酸肉中添加了红曲米,而拟杆菌门是红曲米中的优势细菌[21]。
如图2B所示,对于CG组酸肉,除0 d样品,整个发酵过程中排名前3的优势细菌菌属为芽孢杆菌(Bacillus)、葡萄球菌(Staphylococcus)和乳杆菌(Lactobacillus)。发酵7 d,CG组优势细菌为芽孢杆菌(50.46%)和葡萄球菌(44.91%);发酵14 d,乳杆菌成为优势细菌(60.40%);发酵结束时(21 d),优势菌仍为乳杆菌(57.6%),这与之前的研究报道一致[2,22-23]。酸肉自然发酵前期,芽孢杆菌和葡萄球菌等细菌生长迅速,将环境氧气消耗殆尽,之后厌氧和兼性厌氧乳杆菌成为优势菌,促使环境pH值急剧下降;随着pH值的下降,不耐酸的葡萄球菌和芽孢杆菌生长被抑制[22-23],部分乳酸菌还能产生细菌素,进一步抑制葡萄球菌和芽孢杆菌生长[24];发酵中期至结束,乳杆菌通常成为酸肉中的优势细菌属[19,25-26]。
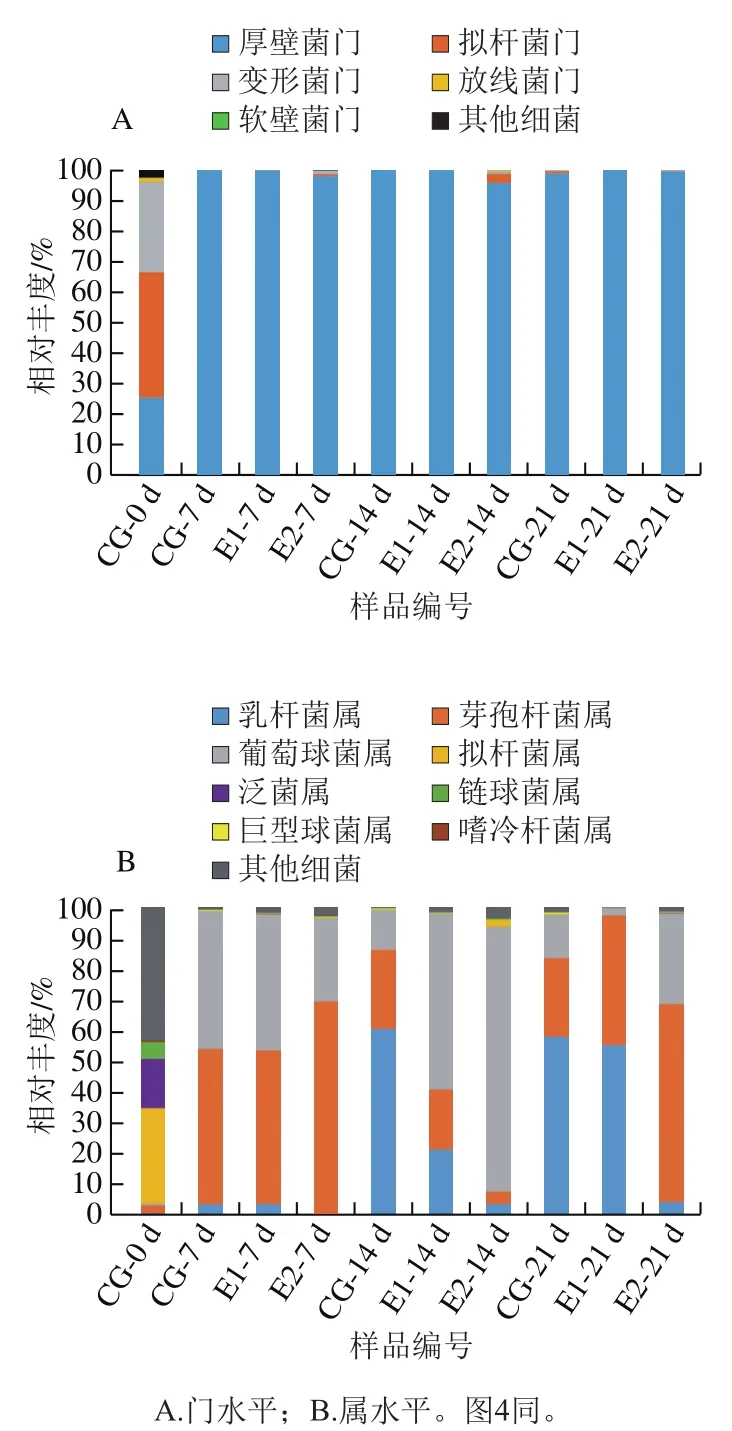
图2 酸性蛋白酶对酸肉发酵过程中细菌群落的影响Fig. 2 Effect of acidic protease on bacterial community in sour meatduring fermentation
蛋白酶的添加影响了酸肉发酵过程中乳杆菌、芽孢杆菌和葡萄球菌的相对丰度。发酵7 d,与CG组类似,E1和E2组酸肉中优势细菌为芽孢杆菌(49.97%、68.30%)和葡萄球菌(44.37%、27.07%);发酵14 d,与CG组不同,E1和E2组中葡萄球菌成为优势菌属(57.36%、86.21%),乳杆菌相对丰度仅为20.90%和3.17%;发酵结束时(21 d),E1组与CG组类似,其优势细菌属为乳杆菌,但E2组中乳杆菌丰度仅为3.90%,其优势细菌为芽孢杆菌(64.55%)。因此,发酵中期至结束(14~21 d),随着酶添加量的增加,乳杆菌相对丰度呈下降趋势。原因可能是蛋白酶加快了肌肉蛋白的降解速率,产生了小肽、游离氨基酸和胺类等碱性物质[27],提高了pH值,促进了芽孢杆菌和葡萄球菌的生长繁殖。阿尔祖古丽·阿卜杜外力等[28]研究发现,蛋白酶的添加可促进干腌羊火腿中葡萄球菌属的生长;李文亚等[29]研究发现,蛋白酶的添加可促进虾酱中芽孢杆菌的生长,与本研究结果一致。推测由于蛋白酶促进了芽孢杆菌和葡萄球菌相对丰度的上升,因此乳杆菌相对丰度有所下降。
2.2 酸性蛋白酶对酸肉发酵过程中真菌群落的影响
2.2.1 酸性真菌群落测序数据质量和OTU分析
酸肉样品所获得的真菌序列条数平均值为80 108 条。如图3A所示,所有样品的稀释曲线均进入平台期,说明测序深度基本覆盖样品中所有真菌,符合分析要求。
按照97%相似度对所有序列进行聚类分析,共获得773个OTU,涵盖8 门143 属。由图3B可知,整个发酵过程中酸肉样本的真菌OTU数量变化较小。

图3 酸肉样品真菌稀释曲线(A)和OTU数分布(B)Fig. 3 Rarefaction curves for fungi (A) and distribution of fungal OTUs (B) in sour meat samples
2.2.2 真菌群落α多样性分析
对不同样品在97%一致性阈值下真菌群落的α多样性进行统计(表3),所有样品的覆盖率均大于0.99,说明测序结果可信。与细菌群落相比,酸肉发酵过程中真菌群落的Simpson指数和Chao1指数变化较小,原因在于红曲米的添加使红曲菌成为优势菌,导致发酵过程中真菌组成变化较小。

表3 酸肉样品中真菌群落α多样性分析Table 3 α-Diversity indexes of fungal community in sour meat samples
2.2.3 真菌群落丰度分析
酸肉发酵过程中,门水平上排名前3的真菌分别为子囊菌门(Ascomycota)、毛霉菌门(Mucoromycota)和担子菌门(Basidiomycota)(图4A),其中子囊菌门是包含红曲菌的菌门。如图4B所示,属水平上排名前3的真菌分别为红曲属(Monascus)、毛霉属(Mucor)和洛德酵母属(Lodderomyces)。发酵过程中CG组酸肉真菌组成变化较大,发酵0 d优势真菌为红曲属,原因在于添加了红曲米;发酵7 d为酵母(洛德酵母属和红酵母属占比48.76%),发酵14 d为红曲属(55.86%),发酵结束时(21 d)为毛霉属(66.23%)。传统酸肉发酵过程中的真菌主要为酵母[2]。因此,红曲米的添加显著影响了酸肉自然发酵过程中的真菌群落结构。

图4 酸性蛋白酶对酸肉发酵过程中真菌群落的影响Fig. 4 Effect of acidic protease on fungal community in sour meat during fermentation
酸性蛋白酶的添加显著降低了酸肉的真菌丰富度。与CG组相比,添加酸性蛋白酶的酸肉中真菌组成变化较小,优势真菌均为红曲属(78.76%~97.94%)。目前尚无蛋白酶影响肉制品中红曲属生长的研究报道。推测蛋白酶的添加促进了小肽、游离氨基酸等碱性物质产生,提高了酸肉pH值,从而促进了红曲属生长,如刘巧琳等[30]发现相对较高的pH值有利于红曲属的生长。
2.3 酸性蛋白酶对酸肉发酵过程中理化指标的影响
2.3.1 酸性蛋白酶对pH值的影响
发酵过程中,所有酸肉的pH值均呈先略升高后显著下降的趋势(图5)。发酵7 d,所有酸肉pH值无显著差异;发酵结束时(21 d),E2组酸肉pH值显著高于其他实验组(P<0.05)。对优势菌属和pH值进行Spearman相关性分析,结果表明乳杆菌和pH值呈显著负相关(P<0.05),这可能是由于乳杆菌可显著降低酸肉的pH值[9]。发酵结束时,E2组乳杆菌丰度最低,因此其pH值最高。
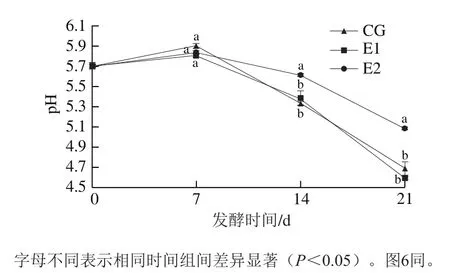
图5 酸性蛋白酶对酸肉发酵过程中pH值的影响Fig. 5 Effect of acidic protease on pH of sour meat during fermentation
2.3.2 酸性蛋白酶对游离氨基酸的影响
如图6A所示,酸性蛋白酶的添加影响了酸肉发酵过程中游离氨基酸总量。整个发酵过程中,所有酸肉的游离氨基酸总量均呈上升趋势。蛋白酶加速了肌肉蛋白水解,促进了游离氨基酸总量的增加,这与文献[31]报道一致。游离氨基酸可作为风味前体物质,被乳酸菌、葡萄球菌等微生物转化为醇、醛、酸等风味物质[32]。发酵结束后(21 d),所有实验组酸肉的游离氨基酸总量差异显著(P<0.05),氨基酸总量随蛋白酶添加量的增加而增加。如图6B所示,整个发酵过程中,所有酸肉的必需氨基酸总量呈上升趋势。发酵结束时(21 d),酸肉必需氨基酸总量也随蛋白酶添加量的增加而增加。必需氨基酸对人体维持生命至关重要,因此蛋白酶通过促进游离氨基酸的释放,提高了酸肉的营养价值。
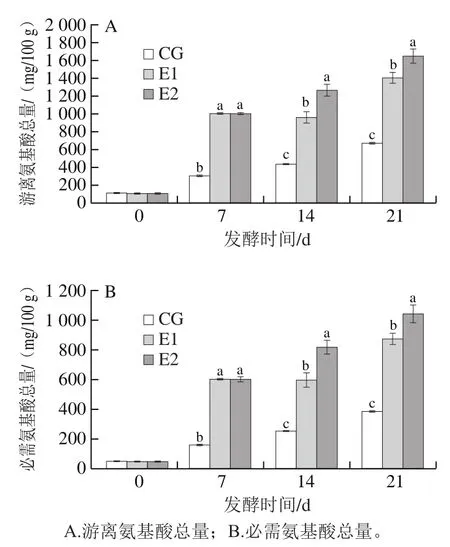
图6 酸性蛋白酶对酸肉发酵过程中游离氨基酸含量的影响Fig. 6 Effect of acidic protease on free amino acid contents in sour meat during fermentation
2.4 酸性蛋白酶对酸肉发酵过程中挥发性风味物质的影响
酸性蛋白酶的添加提高了酸肉中挥发性风味物质的种类和含量。如表4所示,所有酸肉中共检出54 种挥发性风味物质,包括酸类8 种、醇类12 种、醛类7 种、酯类13种、酮类6 种、含硫/含氮类2 种和芳香族类6 种。其中CG-0 d组挥发性风味物质种类最少(23种);E1-21d、E2-21 d组的挥发性风味物质最多,分别为41 种和39种。成熟酸肉挥发性风味物质总量随蛋白酶添加量的增加而增加,E1-21 d、E2-21 d组酸肉中挥发性风味物质总量分别为CG-21 d组酸肉的3.17 倍和3.97 倍。蛋白酶的添加促进了酸肉发酵过程中醇类的产生。与发酵7、14、21 d的CG组相比,发酵7、14、21 d的E1和E2组酸肉中乙醇、苯乙醇、戊醇、1-辛烯-3-醇等醇类含量有所提高,其中苯乙醇含量的增加是因为蛋白酶的添加促进了酸肉的氨基酸代谢,乙醇含量的增加可能是微生物代谢消耗酸肉中添加的葡萄糖,促进了碳水化合物的分解[33]。整个发酵过程中,E1和E2组的乙酸含量均较CG组显著提高(P<0.05)。成熟酸肉(21 d)中3-甲基丁酸含量随着蛋白酶添加量的增加呈上升趋势,可能是由于蛋白酶促进游离氨基酸产生,进而内源酶和微生物代谢氨基酸产生3-甲基丁酸[34]。

表4 酸肉发酵过程中挥发性风味物质含量Table 4 Contents of volatile compounds in sour meat during fermentation μg/kg
酯类物质种类数随着发酵时间的延长而增加,如L-乳酸乙酯、乙酸乙酯、丁酸乙酯和庚酸乙酯仅在成熟酸肉(21 d)中检测到。发酵结束后,仅在E1和E2组中检测出乙酸乙酯、丁酸乙酯和庚酸乙酯。此外,E1和E2组成熟酸肉中3-甲基丁酸乙酯含量也较CG组显著提高(P<0.05),这可能由于蛋白酶促进了部分醇类和酸类物质形成,醇和酸发生酯化反应促进酯类产生[35]。酯类尤其是乙酯类物质通常能赋予发酵肉果香味、奶油香味等良好风味[36]。
蛋白酶的添加促进了发酵过程中酮类物质产生。整个发酵过程中E2组的3-羟基-2-丁酮显著高于CG组(P<0.05)。发酵结束后,仅在加酶组中检测到3-戊烯-2-酮和2,4-戊二酮。另外,蛋白酶也促进了苯甲醛等醛类物质含量的提高。与本研究结果类似,封莉[37]发现在香肠中添加蛋白酶可促进酮类物质的产生,Yang Jing等[38]发现酸鲊鱼中添加蛋白酶可将苯甲醛含量提高2.16 倍。
2.5 酸肉中优势微生物与关键挥发性风味物质的相关性分析
通过OAV可以比较各种挥发性物质的呈香能力,OAV大则表明该物质对酸肉的风味贡献较大,是酸肉的关键风味物质。如表5、图7所示,酸肉中OAV大于1(即OAV对数值大于0)的关键风味物质共有17 种,分别为1-辛烯-3-醇、3-羟基-2-丁酮、3-戊烯-2-酮、3-甲基丁酸、丁酸乙酯、癸酸乙酯、乙酸乙酯、庚酸乙酯、己酸乙酯、辛酸乙酯、2-甲基丁酸乙酯、3-甲基丁酸乙酯、己醛、

图7 酸肉发酵过程中挥发性风味物质OAV热图Fig. 7 Heatmap for the odor activity values of volatile compounds in sour meat during fermentation

表5 酸肉发酵过程中的挥发性风味物质Table 5 Volatile flavor compounds in sour meat during fermentation
苯乙醛、2,4-癸二烯醛、反-2,4-癸二烯醛和反-2-辛烯醛。这些物质可赋予酸肉蘑菇香、青香、甜香、奶香味等,从而提升酸肉的风味品质[19]。
对酸肉中平均相对丰度大于1%的微生物和关键风味物质之间进行Spearman相关性分析,如图8所示,与关键风味物质呈显著相关的优势菌属为乳杆菌属、芽孢杆菌属和葡萄球菌属。乳杆菌属与1-辛烯-3-醇呈显著负相关(P<0.05),这可能是由于酸肉中自然接种的部分乳杆菌可以抑制脂质氧化,从而抑制了1-辛烯-3-醇产生,具体原因有待进一步研究。芽孢杆菌属与1-辛烯-3-醇呈显著正相关(P<0.05),这可能是由于芽孢杆菌有利于发酵肉中这些物质的形成,例如黄雨霞等[39]研究发现,接种芽孢杆菌L-H7后,发酵香肠中1-辛烯-3-醇相对含量由未检测到增加到1.71%。葡萄球菌与3-羟基-2-丁酮呈显著正相关(P<0.05)。这可能是由于葡萄球菌的蛋白酶和脂肪酶活性有利于发酵肉制品中醇和酮类挥发性风味物质的形成[32]。红曲菌等真菌与关键风味物质之间无显著相关性。

图8 酸肉中平均相对丰度大于1%的微生物和关键风味物质的相关性Fig. 8 Correlation between microorganisms with an average relative abundance greater than 1% in sour meat and key flavor substances
2.6 酸性蛋白酶对成熟酸肉感官品质的影响
酸性蛋白酶的添加提高了酸肉的总体感官品质。如表6所示,E1、E2组的气味、滋味和总体可接受性评分显著高于CG组(P<0.05),这是由于蛋白酶的添加促进了蛋白质的降解,提高了酸肉中醇、酯、醛等挥发性风味物质的种类和含量,赋予了酸肉更浓郁的发酵香味。加酶组中,E2组的总体可接受性评分显著高于E1组(P<0.05),说明适量添加蛋白酶(250 U/g)有助于提高酸肉的感官品质。
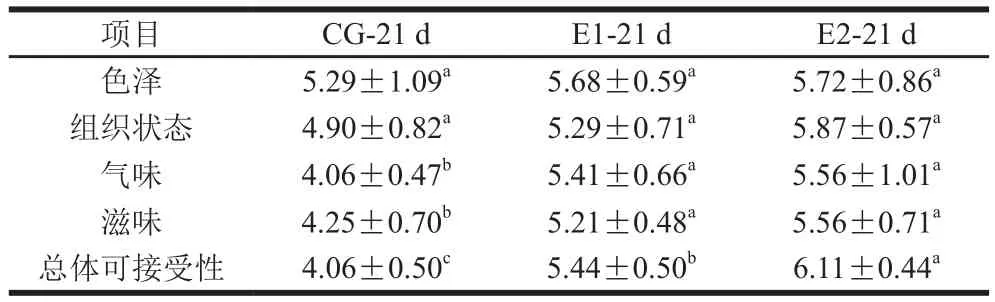
表6 酸性蛋白酶对成熟酸肉感官品质的影响Table 6 Effect of acidic protease on the sensory quality of mature sour meat
3 结 论
添加蛋白酶的酸肉在微生物群落、游离氨基酸含量、挥发性风味和感官品质等方面都具有较大的差异。蛋白酶的添加提高了发酵过程中芽孢杆菌和葡萄球菌的相对丰度,降低了乳杆菌的相对丰度,并降低了真菌丰富度。蛋白酶促进了酸肉游离氨基酸总量和必需氨基酸含量的提高,有利于提升酸肉的风味和营养品质。在所有酸肉样品中共检测到54 种挥发性风味物质,蛋白酶的添加提高了成熟酸肉中挥发性风味物质的种类和含量,尤其是醇类、酸类、酯类和醛类物质。适当添加蛋白酶还可提高酸肉感官品质。目前,尚无外源蛋白酶在酸肉中应用的研究报道。本研究通过对酸肉微生物群落、游离氨基酸、感官风味品质进行分析,判断出较为适宜的蛋白酶添加量,可为酸肉生产提供一定的参考。
