一种黑曲霉α-L-阿拉伯呋喃糖苷酶克隆表达、性质分析和果汁澄清效果
2022-02-16肖文熙李利君谭万森林燕玲李清彪
彭 程,肖文熙,倪 辉,3,李利君,3,谭万森,林燕玲,李清彪,3,*
(1.集美大学食品与生物工程学院,福建 厦门 361021;2.集美大学港口与环境工程学院,福建 厦门 361021;3.福建省食品微生物与酶工程重点实验室,厦门市食品生物工程技术研究中心,福建 厦门 361021)
新鲜果实经过压榨得到新鲜果汁能较完整地保留水果原有风味、营养物质和生物活性,且口感更好,深受消费者青睐[1]。其中,柑橘汁色泽优美、营养丰富、芳香宜人,是世界上最受欢迎、贸易量最大的果汁产品,大约占据2/3的世界果汁市场[2]。由于水果中富含大量的果胶、纤维素、半纤维素和淀粉等物质,从而造成果汁生产中果浆黏度高、出汁率低、难以澄清等问题,其中果汁澄清困难严重影响了果汁饮料的生产[3]。目前,工业生产中常通过热处理、冷冻、吸附、膜分离及添加剂等物理化学方法提高果汁饮料澄清度,但这些方法存在成本高、操作复杂、二次污染等不足。相比这些方法,酶法澄清工艺具有操作简单、反应条件温和、效率高、营养成分损失少等优点[2]。相关研究表明,果胶酶、纤维素酶、木聚糖酶等聚糖水解酶对果汁澄清具有显著效果[4-6]。
α-L-阿拉伯呋喃糖苷酶催化含阿拉伯糖的聚合物中以α-(1,2)、α-(1,3)或α-(1,5)连接的阿拉伯呋喃糖基的水解[7-8],该酶的主要功能是协同其他水解酶水解半纤维素等大分子物质。在CAZy数据库中,归属为GH2、GH3、GH43、GH51、GH54、GH62和GH155家族[9-10]。目前可利用α-L-阿拉伯呋喃糖苷酶生产具有抗血糖作用的L-阿拉伯糖[11-12],改善葡萄酒的风味[13-14],澄清果汁[15]和增强动物饲料的消化[16];同时该酶还可作为面包的天然改良剂[17]以及应用于纸浆和造纸工业中[18]。目前,α-L-阿拉伯呋喃糖苷酶的优良酶资源还不够丰富,因此,挖掘该酶资源是当前热点研究领域。
曲霉属真菌是重要的碳水化合物活性酶来源,具有高分泌蛋白能力[19-20]。此外,黑曲霉(Aspergillus niger)作为公认为安全(Generally Recognized as Safe,GRAS)的微生物被广泛用作食品行业酶制剂的生产菌株[21]。本实验室前期对察氏培养基、柚皮粉培养基以及茶梗培养基发酵制备的黑曲霉胞外酶液进行差异定量蛋白组学分析,得到差异蛋白α-L-阿拉伯呋喃糖苷酶的基因序列。对该α-L-阿拉伯呋喃糖苷酶进行生物信息学分析,并将其异源表达、纯化,探究此重组酶的酶学性质及在柑橘果汁澄清中的应用潜力,以期为探究α-L-阿拉伯呋喃糖苷酶的其他应用提供材料和参考,同时也丰富α-L-阿拉伯呋喃糖苷酶的资源。
1 材料与方法
1.1 材料与试剂
1.1.1 材料、菌株与质粒
柚子购自福建厦门大润发超市。
Escherichia coliDH5α、Pichia pastorisSMD1168、含pPIC9K载体的E. coliDH5α均由实验室保藏;含目的基因α-L-阿拉伯呋喃糖苷酶(AB)pUC57-AB-Kan质粒的E. coliDH5α购自金唯智生物科技(苏州)有限公司。
1.1.2 试剂
PrimeSTAR HS DNA Polymerase、TaqDNA聚合酶、高效感受态细胞制备试剂盒、T4 DNA连接酶、限制性内切酶NotI、限制性内切酶AvrII TaKaRa(大连)有限公司;限制性内切酶PmeI New England Biolabs公司;Easy II Protein Quantitative Kit、EasyTaqMix北京全式金生物技术有限公司;质粒小提试剂盒、DNA纯化回收试剂盒 天根生化科技(北京)有限公司;对硝基苯基-α-L-阿拉伯呋喃糖苷(p-nitrophenyl-α-L-arabinofuranoside,pNPA) 上海源叶生物有限公司;对硝基苯基-β-D-吡喃葡萄糖苷(p-nitrophenyl-β-D-glucopyranoside,pNPG)、对硝基苯基-β-D-木吡喃葡萄糖苷(p-nitrophenyl-β-D-xylopyranoside,pNPX)、对硝基苯基-α-D-甘露糖苷(p-nitrophenyl-α-D-mannoside,pNPM) 美国Sigma-Aldrich公司;其余试剂均为分析纯。
1.2 仪器与设备
Biometra T Advanced基因扩增仪 德国耶拿有限公司;DK-8D数显恒温水浴锅 常州国华电器有限公司;FE20 pH计 瑞士Mettler Toledo公司;SW-CJ-2FD双人单面超净工作台 苏州净化设备有限公司;Centrifuge 5417R小型高速冷冻离心机 德国Eppendorf有限公司;K10金属浴 杭州奥盛有限公司;GEAI 600凝胶成像仪 美国GE公司;1652100电穿孔仪 美国Bio-Rad公司;Avanti J-26S XP立式高速冷冻离心机 美国Beckman公司;Epoch 2T酶标仪 美国伯腾仪器有限公司;YXQ-LS-30SH立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂。
1.3 方法
1.3.1AB基因的重组质粒构建
利用SignalP 4.0 Server在线软件分析AB基因序列,获得信号肽位置,并在后续构建重组质粒时去除信号肽。DNAMAN软件对基因序列进行分析,选择合适的酶切位点AvrII和NotI,并设计引物(AB-F:CGCCCTAGGGTTTCCTTGAAGGTTTCCAC;AB-R:ATTTGCGGCCGCGTTCGCTGCCAGGACAG),划线部分为酶切位点。引物和DNA测序均由铂尚生物技术(上海)有限公司完成。
以pUC57-AB-Kan重组质粒为模板,在PrimeSTAR HS DNA Polymerase的作用下,以AB-F和AB-R为引物进行聚合酶链式反应(polymerase chain reaction,PCR)扩增,扩增程序为:95 ℃预变性4 min;94 ℃变性1 min;55 ℃退火1 min;72 ℃延伸2.5 min,进行30 次循环;72 ℃终延伸10 min;4 ℃,保存。反应结束后采用0.8%的琼脂糖凝胶电泳检测PCR产物,并参照天根DNA纯化回收试剂盒说明书纯化回收PCR产物。将回收的PCR产物经T4 DNA连接酶连接至经相同酶切处理过的pPIC9K质粒上,并转化至E. coliDH5α感受态细胞中,菌液PCR筛选阳性克隆子后进行测序。将测序正确的重组质粒命名为pPIC9K-AB。
利用UniProt的BLAST程序(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行氨基酸序列的同源性搜索。利用MEGA 6.0的邻接法(Neighbor-joining,NJ)构建系统发育树。利用SignalP 4.0(http://www.cbs.dtu.dk/services/SignalP-4.0/)预测信号肽。利用ExPASy的ProtParam工具(https://web.expasy.org/protparam/)预测蛋白质的理化性质。利用TMHMM Server v.2.0(http://www.cbs.dtu.dk/services/TMHMM/)分析蛋白质的跨膜区。利用SOPMA(https://npsa-prabi.ibcp.fr/cgi-bin/npsa_automat.pl?page=npsa_sopma.html)预测蛋白二级结构。利用SWISS-MODEL(https://www.swissmodel.expasy.org/interactive)进行蛋白质结构的三维模建。利用SAVES服务器(http://services.mbi.ucla.edu/SAVES/)对同源建模的结果进行残基角度检验。
1.3.2 重组α-L-阿拉伯呋喃糖苷酶的诱导表达、纯化及质谱鉴定
参照质粒小提试剂盒提取重组质粒pPIC9K-AB。取30 μL经PmeI酶(1 μg)线性化的重组质粒电转至P. pastorisSMD1168感受态细胞,经基础葡萄糖(minimal dextrose,MD)平板初步筛选后,在遗传霉素G418终质量浓度为2.5 mg/mL的酵母浸出粉胨葡萄糖(yeast extract peptone dextrose,YPD)平板上筛选多拷贝转化子。挑取多个转化子于YPD试管中培养,再进行破壁PCR选择正确的转化子。
以1%接种量将菌液接种至100 mL缓冲甘油复合(buffered glycerol-complex,BMGY)液体培养基中,30 ℃、200 r/min恒温培养至OD600nm为3。弃静置3 h后的菌液上清液,再用缓冲甲醇复合(buffered methanolcomplex,BMMY)液体培养基重悬菌体,于30 ℃、200 r/min恒温培养。每隔24 h添加0.5%(V/V)的甲醇作为碳源诱导菌体表达,诱导7 d后于4 ℃、4 000 r/min离心20 min,收集上清液,即为粗酶液。
phenyl疏水性层析:使用抽滤后的5 柱体积(column volume,CV)超纯水清洗经phenyl(GE)填充柱,再用含2 mol/L硫酸铵的0.01 mol/L pH 6.5乙酸钠缓冲液平衡柱子备用;将平衡好的填料与经2 mol/L硫酸铵溶液浓缩的粗酶液搅拌混匀约3 h,使目的蛋白与填料充分结合。通过5 CV 0.01 mol/L pH 6.5乙酸钠缓冲液冲洗与phenyl填料结合的目的蛋白,合并有酶活力的组分。Q Sepharose HP阴离子交换层析:使用AKTAprime plus蛋白纯化仪,参照配套的阴离子交换层析原则及方法说明书进行操作。将phenyl疏水性层析得到的酶液经透析、浓缩后上样。用pH 6.5 0.02 mol/L磷酸盐缓冲液进行柱洗涤,1 mol/L氯化钠溶液以1 mL/min流速进行线性洗脱(0%~60%),合并有酶活力的组分。Superdex 200 Increase 10/300 GL层析:将经Q Sepharose HP阴离子交换层析得到的酶液上样至预先经pH 6.5 0.02 mol/L磷酸盐缓冲液平衡的Superdex 200 Increase 10/300 GL层析柱,用相同缓冲液以0.4 mL/min流速洗脱目的蛋白,合并有酶活力的组分。
蛋白浓度的测定:根据全式金生物的EasyII Protein Quantitative Kit说明书配制工作液,以牛血清白蛋白溶液为标准溶液,测定样品蛋白浓度。重组蛋白分子质量通过十二烷基硫酸钠-聚丙烯酰胺凝胶电泳(sodium dodecyl sulfate-polyacrylamide gel electrophoresis,SDSPAGE)测定。
质谱鉴定:重组蛋白的鉴定是使用蛋白质内切酶胰蛋白酶对蛋白质多肽样品进行酶解,液相色谱-串联质谱(liquid chromatography-tandem mass spectrometry,LCMS/MS)(nanoLC-QE)法对酶解后的样品进行鉴定。再通过MASCOT等质谱匹配软件对LC-MS/MS数据进行分析,获得目标蛋白质分子的定性分析。
1.3.3 温度对重组α-L-阿拉伯呋喃糖苷酶活力的影响
在pH 5.0的条件下,分别测定温度40~80 ℃时的酶活力,以测得的最高酶活力为100%,并计算其他温度下的相对酶活力。为探究该酶的温度稳定性,将适量酶液在65 ℃恒温水浴4 h,每隔30 min取样,以及在70 ℃恒温水浴30 min,每隔5 min取样,均于最适条件下测定其残余酶活力,以未处理酶活力为100%,分别计算处理不同时间后相对酶活力。
1.3.4 pH值对重组α-L-阿拉伯呋喃糖苷酶活力的影响
用50 mmol/L乙酸-乙酸钠缓冲液(pH 3.0~6.0)、磷酸二氢钠-磷酸氢二钠缓冲液(pH 6.0~8.0)配制不同pH值的2 mmol/LpNPA溶液。在最适反应温度下测定酶活力,以最高酶活力为100%。通过测定酶液在不同pH值条件下4 ℃放置24 h后的残余酶活力研究pH值稳定性,以未处理酶活力为100%。
1.3.5 重组α-L-阿拉伯呋喃糖苷酶的底物特异性及动力学常数
通过测定重组α-L-阿拉伯呋喃糖苷酶在最适条件下对2 mmol/L不同底物(pNPA、pNPX、pNPG、pNPM)或0.2%不同底物(山毛榉木木聚糖、玉米芯木聚糖、甘蔗渣木聚糖)的活力,研究该酶的底物特异性。
测定重组α-L-阿拉伯呋喃糖苷酶在65 ℃于50 mmol/L pH 5.0乙酸钠缓冲液中对不同浓度(1~6 mmol/L)pNPA溶液的活力。同时测定蛋白浓度,利用Lineweaver-Burk法计算获得Km值和Vmax值。
1.3.6 金属离子、抑制剂和表面活性剂对重组α-L-阿拉伯呋喃糖苷酶活力的影响
通过测定酶在4 ℃被1 mmol/L或10 mmol/L的不同金属离子(Na+、K+、Ca2+、Mg2+、Ba2+、Cu2+、Mn2+、Cd2+、Al3+、Fe3+和Zn2+)处理24 h后的残余酶活力,研究金属离子对酶活力的影响,以未被金属离子处理的酶活力为100%。
在酶液中分别添加终浓度为1 mmol/L或10 mmol/L抑制剂(EDTA、CTAB、Urea)和1%或10%(m/m)表面活性剂(SDS、Tween-20、Tween-80、Triton X-100),于4 ℃处理24 h后,测定酶的残余活力,以未添加抑制剂或去垢剂的酶活力为100%,研究抑制剂和去垢剂对酶活力的影响。
1.3.7 重组α-L-阿拉伯呋喃糖苷酶对单糖耐受性及对柑橘汁的影响
通过先将单糖(L-阿拉伯糖、D-木糖)添加到最终浓度为0~2 mol/L的测定混合物中,于最适条件下测定酶活力,研究该酶对单糖的耐受性。
将去皮、去籽处理后的白柚经榨汁机处理获得果汁。经3 500 r/min离心30 min后的上清液用于酶实验[22]。然后,将10 mL样品用0~30 U/mL酶液于50 ℃孵育1 h后,于沸水中加热5 min使酶失活。将处理过的汁液以35 000 r/min离心10 min后,再通过分光光度计测定其在660 nm波长处透光率,以相对于蒸馏水的透光率百分比表示,所有实验均一式3 份[23]。
1.3.8 重组α-L-阿拉伯呋喃糖苷酶活力的测定
配制0.1 mol/L对硝基苯酚(p-nitrophenol,pNP)母液和0.05 mol/L乙酸钠缓冲液(pH 5.0),稀释成一系列浓度的pNP溶液。标准曲线反应体系:0.1 mol/LpNP(0~3.5 μL)与pH 5.0 0.05 mol/L乙酸钠缓冲液(100~96.5 μL)的混合液于50 ℃温育15 min后,立即加入100 μL 1 mol/L Na2CO3溶液,于410 nm波长处吸光度,绘制吸光度与pNP浓度曲线。酶活力测定:以pNPA为底物,取25 μL酶液、50 μL 0.05 mol/L pH 5.0乙酸钠缓冲液与25 μL 2 mmol/LpNPA溶液混匀,于50 ℃温育15 min后,立即加入100 μL 1 mol/L Na2CO3溶液终止反应,于410 nm波长处读取吸光度。
1.4 数据分析与统计
所有实验均重复3 次。使用Excel 2010、Origin 9.1进行数据处理与分析,制作相关图表。
2 结果与分析
2.1 AB基因的重组质粒构建及克隆表达
经PCR扩增目的基因的0.8%琼脂糖凝胶电泳结果如图1A所示。PCR产物在2 000 bp附近出现特异性条带。连接产物转化后所挑取的转化子进行菌落PCR鉴定,其1%琼脂糖凝胶电泳结果如图1B所示,菌落1和5的PCR产物条带单一,且分子质量在2 000~3 000 bp之间,符合预期结果。提取菌落1和5的重组质粒委托铂尚生物技术(上海)有限公司进行测序,测序结果显示,菌落1的目的片段正确插入载体中,表明已成功构建重组质粒pPIC9K-AB。
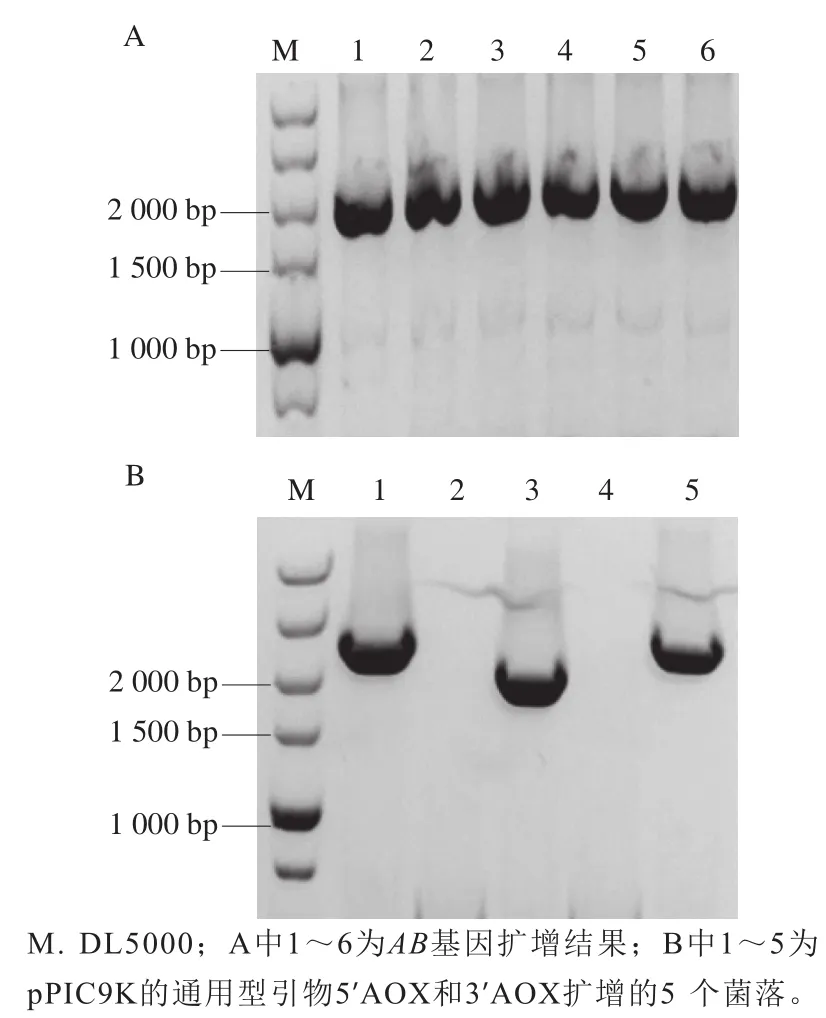
图1 AB基因扩增结果(A)及pPIC9K-AB菌液PCR鉴定结果(B)Fig. 1 Amplification of α-L-arabinofuranoside gene (A) and PCR identification of pPIC9K-AB (B)
用UniProt数据库BLAST对相似性较高的前25 条氨基酸序列建立进化树,结果如图2所示。该酶(A0A100ITZ9)属于GH51,其氨基酸序列与来自Aspergillus kawachii(Q8NK90)、A. awamori(Q96X54)、A. niger(P42254.1)、A. sclerotioniger(A0A317XE43)、A. terreus(Q0CTV2)、A. ruber(A0A017S9M9)的α-L-阿拉伯呋喃糖苷酶分别具有99.5%、99.3%、97.3%、88.7%、78.1%、76.3%的相似性。
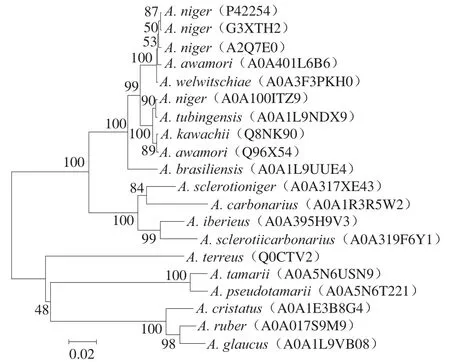
图2 重组α-L-阿拉伯呋喃糖苷酶系统进化分析Fig. 2 Neighbor-joining tree of recombinant α-L-arabinofuranoside
利用SMART数据库的信号肽预测工具SignalP 4.0预测信号肽,剪切位点位于第25位和第26位之间,在其N端有25个氨基酸为信号肽序列。利用ExPASy的ProtParam工具分析该蛋白序列的理化性质,结果如下:该蛋白序列共包含628个氨基酸,分子式为C3043H4542N762O980S13,理论分子质量约为67.896 kDa,理论等电点为4.09。预测在酵母体内半衰期大于20 h,不稳定系数为25.59,为稳定蛋白。脂肪族氨基酸指数为77.98。总平均亲水指数为-0.183,说明该蛋白是亲水性蛋白。
α-L-阿拉伯呋喃糖苷酶的跨膜区预测结果(图3A)显示该蛋白不含跨膜区,是一种可溶性蛋白,适于分泌型表达。如图3B所示,该酶的二级结构以无规卷曲和β-折叠居多,其中氨基酸序列中α-螺旋占总二级结构的21.18%;β-折叠占24.52%,β-转角占5.73%,无规卷曲占48.75%。利用SWISS-MODEL对α-L-阿拉伯呋喃糖苷酶进行同源建模,结果如图3C所示。本研究的α-L-阿拉伯呋喃糖苷酶序列与来源于Meripilus giganteus的α-L-阿拉伯呋喃糖苷酶(PDB登录号6ZQ0)同源性为39.93%,故以它为模板进行同源建模。对所得蛋白质三级结构建模结果进行Verify3D评价,80%以上的氨基酸序列满足特定的评分标准得到分数,说明建模结果可靠。从结果可以看到蛋白质序列的得分比最小值为90.0%,说明该α-L-阿拉伯呋喃糖苷酶的蛋白质序列的建模结果良好。建模结果(图3C)表明该酶具有51家族水解酶家族特有的(α/β)8折叠桶(TIM桶)结构,并且在桶的中心含有活性位点与活性空腔,以便于阿拉伯糖苷酶识别并结合底物。同时建模结果还表明该酶的桶状结构与β-三明治结构域紧密结合,桶的C端与N端处于同一β-折叠结构域中,因此判断其具有良好的耐热性。
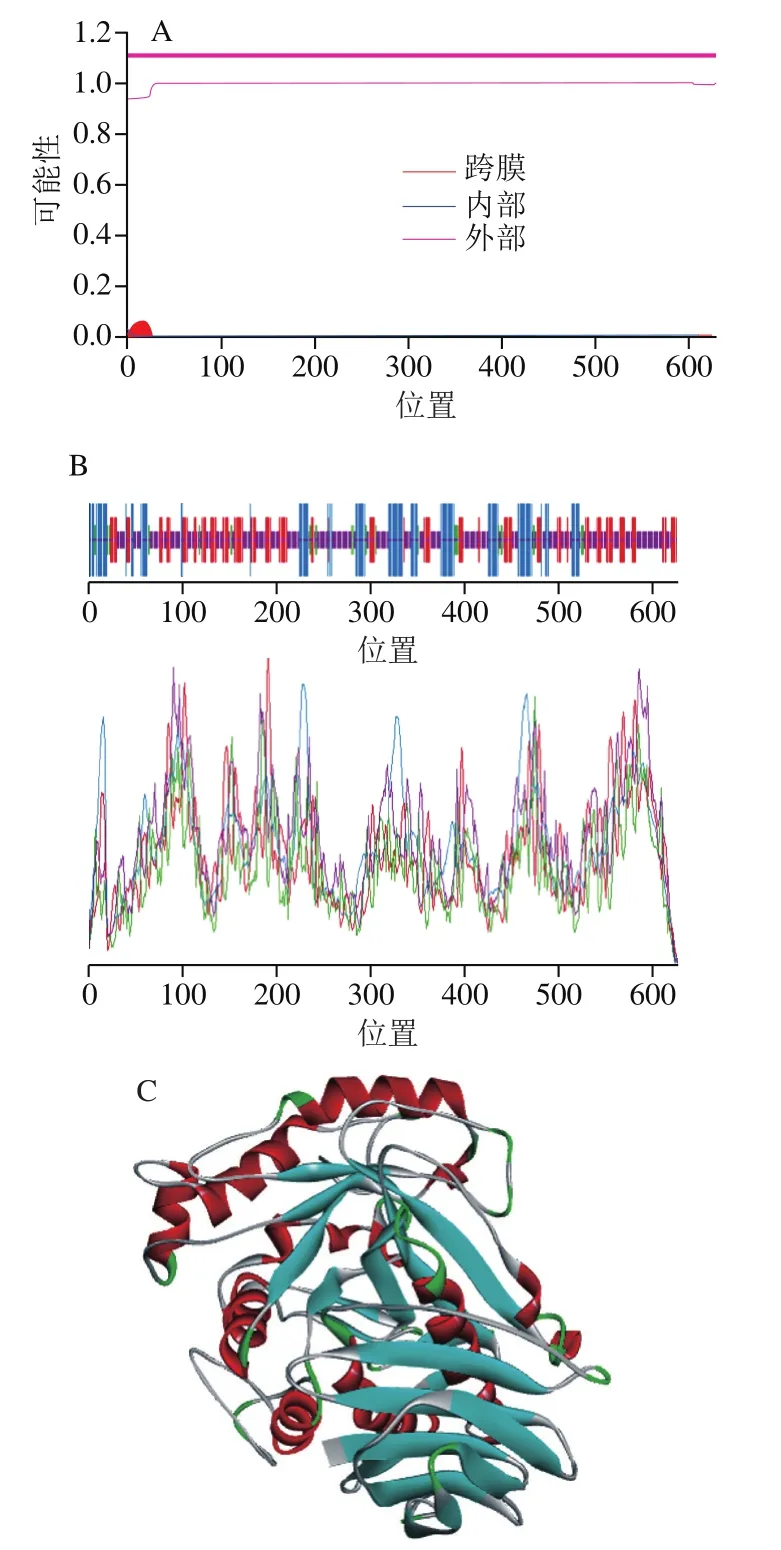
图3 α-L-阿拉伯呋喃糖苷酶跨膜区分析(A)、二级结构预测(B)、三级结构预测(C)Fig. 3 Prediction of transmembrane helices (A), secondary structure (B),and tertiary structure (C) of α-L-arabinofuranoside
2.2 重组α-L-阿拉伯呋喃糖苷酶的诱导表达、纯化及质谱鉴定
重组质粒pPIC9K-AB电转化至P. pastorisSMD1168感受态细胞后,破壁PCR鉴定结果如图4A所示,条带数量、大小均符合预期。PCR产物委托铂尚生物技术(上海)有限公司进行测序,测序结果表明已成功构建重组菌株。
利用BMGY和BMMY培养基对重组菌株发酵培养,发酵7 d后的培养液,即为粗酶液。通过phenyl疏水柱、Q Sepharose HP阴离子交换柱、Superdex 200 Increase 10/300 GL凝胶过滤柱对重组α-L-阿拉伯呋喃糖苷酶进行纯化,Superdex 200 Increase 10/300 GL凝胶过滤柱纯化层析如图4B所示,呈现单一峰形。如图4C所示,SDSPAGE凝胶上呈现单一条带。由纯化过程参数(表1)可看出,最后得到该重组蛋白的纯化倍数为5.13倍,比活力达到55.73 U/mg。从SDS-PAGE(图4C)切出相应的条带,并将进行胰蛋白酶水解的产物进行质谱分析。通过LC-MS/MS鉴定分离的重组的α-L-阿拉伯呋喃糖苷酶(图4D)。再通过MASCOT等质谱匹配软件对LC-MS/MS数据进行分析(FPGGNNLEGNSAENR、LANYGSETQDLSVSIPGTSTGK、GSVSEAVFmIGFER、SVPYFIGEYSR、ENGLKPQLANVLADMK、GDYSGDITVR),获得目标蛋白质多肽分子的定性鉴定信息。该重组蛋白鉴定为α-L-阿拉伯呋喃糖苷酶A(A. niger),UniProt数据库登录号为A0A100ITZ9。
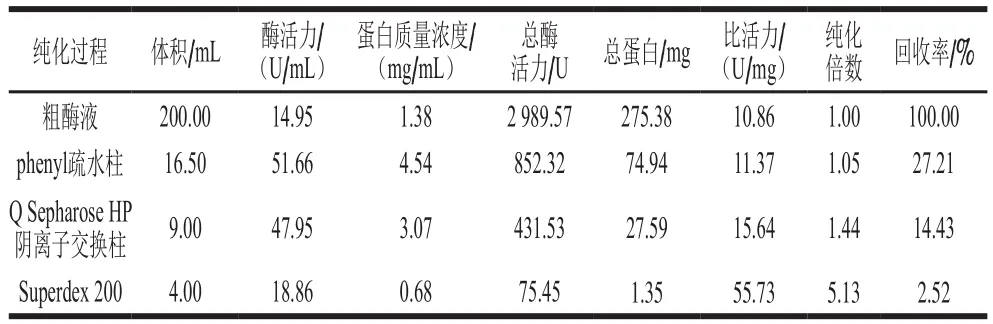
表1 α-L-阿拉伯呋喃糖苷酶的纯化过程参数Table 1 Summary of the purification steps of α-L-arabinofuranoside
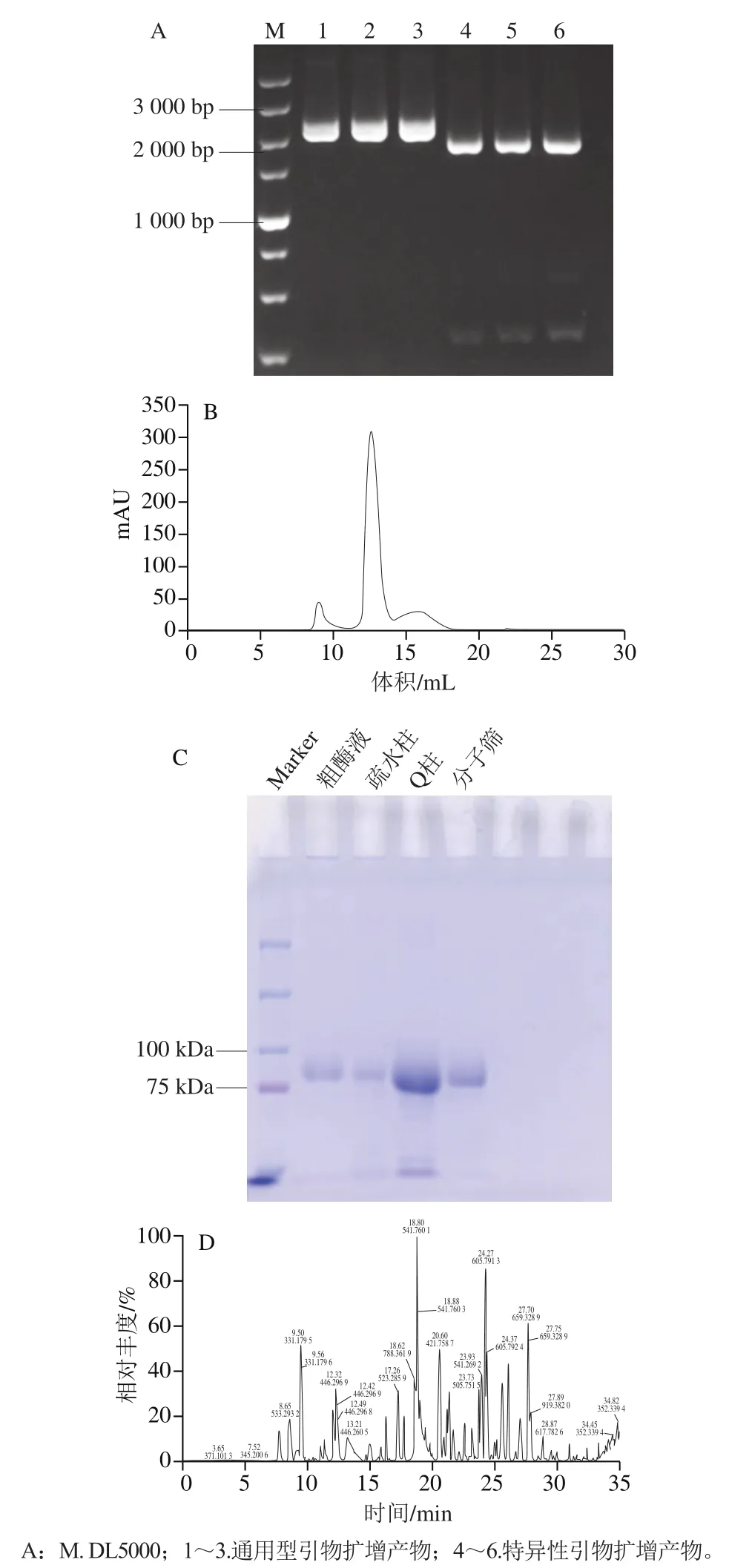
图4 pPIC9K-AB的破壁PCR鉴定结果(A)、凝胶过滤纯化(B)、SDS-PAGE分析(C)和LC-MS/MS鉴定结果(D)Fig. 4 PCR pattern of pPIC9K-AB with broken cell walls (A),gel filtration chromatogram (B), SDS-PAGE pattern (C) and LC-MS/MS chromatogram (D)
2.3 温度对重组α-L-阿拉伯呋喃糖苷酶活力的影响
如图5A所示,重组α-L-阿拉伯呋喃糖苷酶在40~80 ℃范围内均有活性,最适反应温度为65 ℃。如图5B所示,重组α-L-阿拉伯呋喃糖苷酶在65 ℃处理90 min后,仍能保持60%以上的酶活力,在70 ℃处理10 min,酶活力仅有65%左右。相关研究报道,来源于Pseudopedobacter saltans、Bifidobacterium longumB667、B. breveK-110、Ruminiclostridium josui、Clostridium thermocellum的α-L-阿拉伯呋喃糖苷酶的最适温度分别为50、45、45、45、50 ℃[9,24-27]。解西柱等[28]研究的来源于A. niger的α-L-阿拉伯呋喃糖苷酶Anabf A最适温度为50 ℃,其在60 ℃孵育30 min后,酶活力完全丧失。与相关文献报道的同类酶相比,本研究发现的耐热酶最适温度更高,热稳定性也更好,更有利于工业应用。该酶耐热性的原因可能与其紧密的结构相关,该酶桶状结构与β-三明治结构域紧密结合(图3C),桶的C端与N端处于同一β-折叠结构域中,因此其具有良好的耐热性。
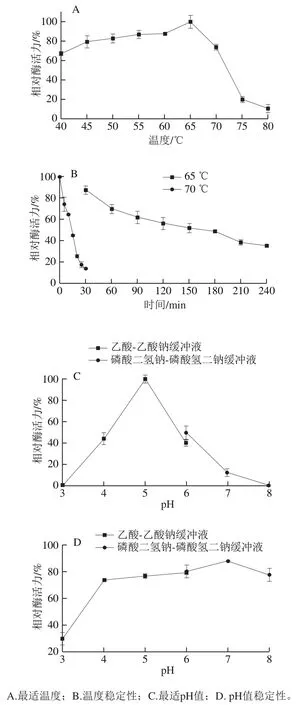
图5 温度和pH值对重组α-L-阿拉伯呋喃糖苷酶的影响Fig. 5 Effects of temperature and pH on recombinant α-L-arabinofuranoside activity
2.4 pH值对重组α-L-阿拉伯呋喃糖苷酶活力的影响
如图5C所示,随着pH值的升高,酶活力呈先上升后下降的趋势,在乙酸钠缓冲体系中活力较高,在pH 5.0时α-L-阿拉伯呋喃糖苷酶活力最高。如图5D可知,α-L-阿拉伯呋喃糖苷酶在pH 3.0~8.0范围内处理24 h后均保持一定的活力,且较窄的pH值范围(pH 4.0~8.0)条件下放置24 h后仍保持约70%的酶活力。该结果表明该重组α-L-阿拉伯呋喃糖苷酶在弱酸性和中性范围内具有良好的pH值稳定性;这与真菌来源的酶通常最佳pH值在酸性范围内[29]的规律相符合。由于大多数果汁天然pH值为酸性,所以该重组酶在果蔬汁加工行业中存在一定的应用潜力[30]。
2.5 重组α-L-阿拉伯呋喃糖苷酶的底物特异性及动力学常数
重组α-L-阿拉伯呋喃糖苷酶对pNPA有一定的水解活性,对pNPG、pNPX、pNPM等人工底物以及山毛榉木木聚糖、玉米芯木聚糖和甘蔗渣木聚糖等天然聚糖类底物没有活性(数据未显示)。通过测定重组α-L-阿拉伯呋喃糖苷酶在不同浓度pNPA(1~6 mmol/L)活力,计算得到的初始反应速率,利用Lineweavere-Burk法计算获得酶促反应参数Km值和Vmax值分别为2.31 mmol/L和625 μmol/(mL·min)。来源于A. nigerND-1的α-L-阿拉伯呋喃糖苷酶的Km为5.36 mmol/L[19],与之相比,本研究中的重组α-L-阿拉伯呋喃糖苷酶的Km值更低,表明该酶与底物的亲和力更大,可以作为工业应用的理想选择。
2.6 金属离子、抑制剂和表面活性剂对重组α-L-阿拉伯呋喃糖苷酶活力的影响
金属离子的存在可能多方面的影响酶活力,通过测定重组α-L-阿拉伯呋喃糖苷酶被不同金属离子处理后残留的酶活力探究金属离子对其影响,结果如图6A所示。1 mmol/L的金属离子K+对α-L-阿拉伯呋喃糖苷酶有轻微促进作用,其酶活力提高了11%。该结果表明,K+离子可用作该酶的活化剂,可用于进一步的研究和开发。而1 mmol/L的Cu2+、Al3+却能明显抑制该酶活力性,其酶活力均低于50%。与Hu Yanbo等[31]研究的Al3+能抑制来源于Paenibacillus polymyxaKF-1的α-L-阿拉伯呋喃糖苷酶活力的结论一致。1 mmol/L的Mn2+、Ca2+、Cd2+、Fe3+、Na+、Mg2+和Ba2+对重组酶活力也有不同程度的抑制作用,来源于Bacillus stearothermophilusT-6的α-L-阿拉伯呋喃糖苷酶被1 mmol/L的Mn2+处理后,其酶活力显著提高[15],与Yuan Ye等[32]的研究Mn2+是某些糖苷酶的酶增强剂结果相反,这也表明不同来源蛋白酶性质有所差异。10 mmol/L的Cu2+、Cd2+、Al3+、Fe3+和Zn2+对该酶有抑制作用,酶活力均小于50%,其中Cu2+几乎能完全抑制酶活力。与Patel等[33]研究Cu2+可催化自身半胱氨酸分子的氧化而导致分子内或分子间二硫键或亚磺酸的形成,进而导致酶活力减弱结果一致。
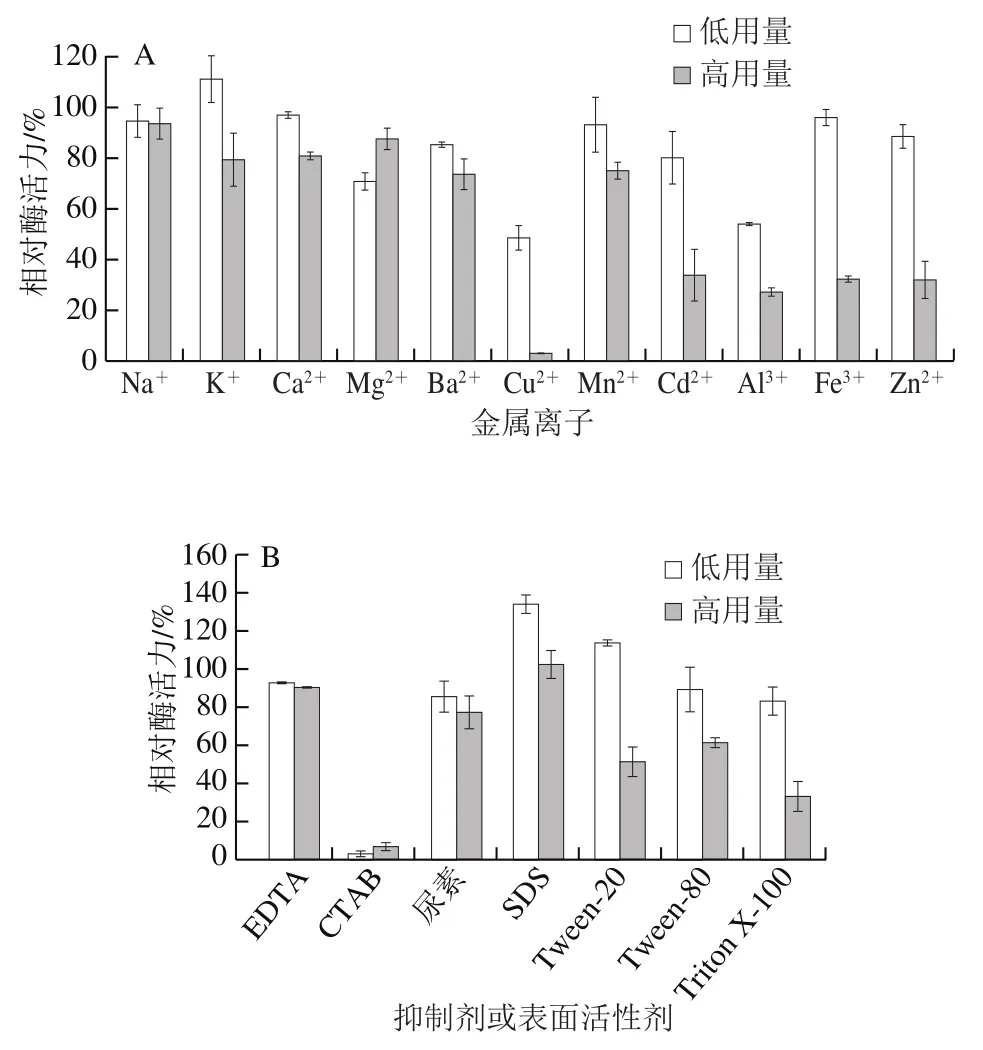
图6 金属离子(A)、抑制剂和表面活性剂(B)对重组α-L-阿拉伯呋喃糖苷酶活力的影响Fig. 6 Effects of metal ions (A), inhibitors and surfactants (B) on the activity of recombinant α-L-arabinofuranoside
探究抑制剂和表面活性剂对酶活力的影响,结果如图6B所示。由于EDTA的添加对酶活力没有显著影响,这一结果表明酶的活性不需要金属离子辅助[34]。重组α-L-阿拉伯呋喃糖苷酶的CTAB耐受能力较差,1 mmol/L的CTAB能使α-L-阿拉伯呋喃糖苷酶基本失活,尿素对α-L-阿拉伯呋喃糖苷酶活力有轻微抑制作用,而SDS对α-L-阿拉伯呋喃糖苷酶活力有轻微促进作用。低用量Tween-20能轻微促进酶活力,而1%的Tween-80、Triton X-100存在时,α-L-阿拉伯呋喃糖苷酶活力仅有80%以上,但高浓度条件下均抑制α-L-阿拉伯呋喃糖苷酶活力。
2.7 重组α-L-阿拉伯呋喃糖苷酶对单糖耐受性及对柑橘汁的影响
α-L-阿拉伯呋喃糖苷酶作用底物时,产物之一为L-阿拉伯糖,L-阿拉伯糖可能是α-L-阿拉伯呋喃糖苷酶的抑制剂;酶反应环境里也通常伴随大量的D-木糖存在,也会抑制其活性,因此探究重组α-L-阿拉伯呋喃糖苷酶在不同浓度(0~2 000 mmol/L)L-阿拉伯糖、D-木糖存在下的酶活力情况,结果如图7A所示。低浓度(<400 mmol/L)时,L-阿拉伯糖的存在对重组α-L-阿拉伯呋喃糖苷酶活力有轻微促进作用。随着浓度进一步升高,L-阿拉伯糖存在对重组α-L-阿拉伯呋喃糖苷酶活力产生抑制作用,在1 000 mmol/L的浓度下,L-阿拉伯糖的抑制百分比为24.2%,比Hu Yanbo等[31]研究来源于Paenibacillus polymyxaKF-1的α-L-阿拉伯呋喃糖苷酶(500 mmol/L,26.1%)的抑制效果更小。0~2 000 mmol/L的D-木糖存在时,重组α-L-阿拉伯呋喃糖苷酶活力不但没有受到抑制,反而有所提高,最高提高了32.76%(900 mmol/L),这可能如Florindo等[35]所述,糖和多元醇都在蛋白质核心中的疏水残基之间产生强相互作用使其刚性和稳定性整体有所提高,从而导致其水解活性的显著提高。与来源于Cellulosimicrobium aquatileLyp51的CaAraf51相比[10],该酶对较高浓度的阿拉伯糖和木糖具有更好的耐受性。表明该酶不易受到酶促反应产物的反馈抑制,在半纤维素水解应用中具有强大的潜力。
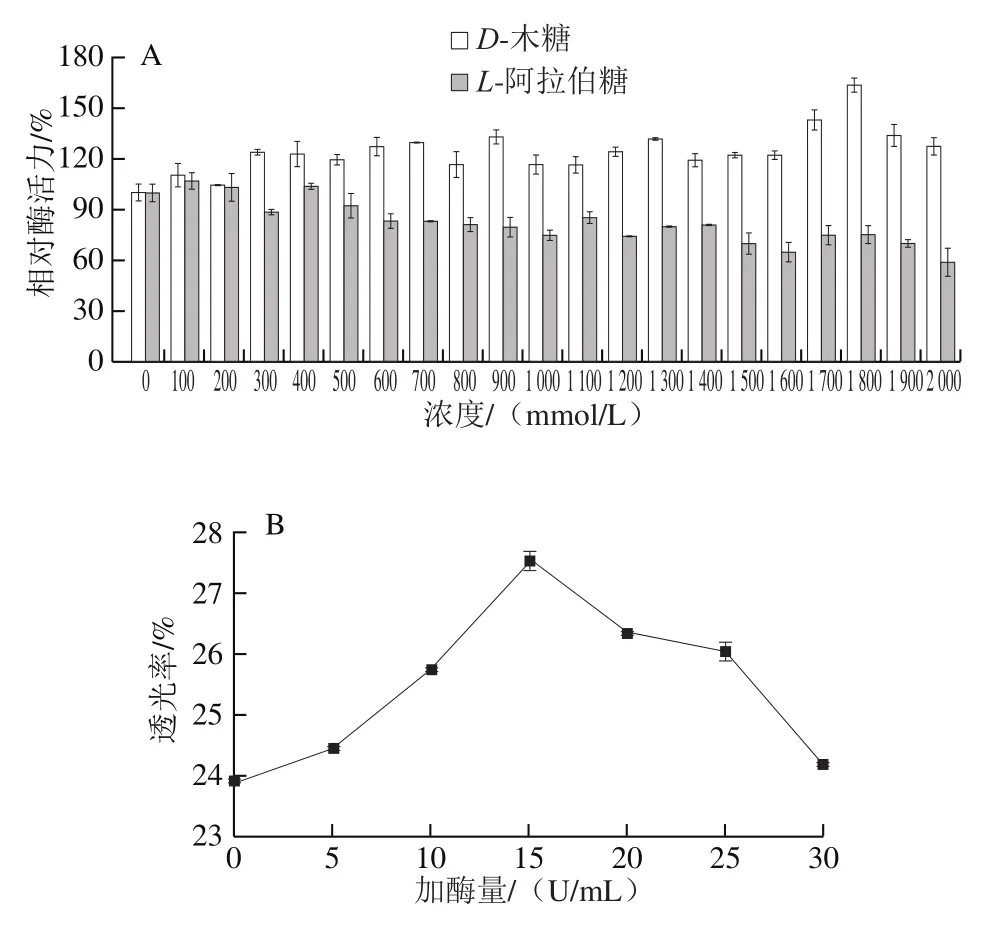
图7 单糖对重组α-L-阿拉伯呋喃糖苷酶活力的影响(A)及重组α-L-阿拉伯呋喃糖苷酶对柚子汁的影响(B)Fig. 7 Effect of monosaccharides on the activity of recombinant α-L-arabinofuranoside (A) and effect of recombinant α-L-arabinofuranoside on clarifying grapefruit juice (B)
果汁的浊度和黏度归因于多糖的存在,例如纤维素、半纤维素、淀粉、果胶和结合的木质素等[5]。酶促工艺广泛用于果汁的提取和澄清中,它不仅降低了果汁的黏度,还为果汁提供了更高的澄清度、更浓郁的香气和色彩[36]。α-L-阿拉伯呋喃糖苷酶是外切酶,可从主链木聚糖上除去侧链部分的L-阿拉伯呋喃糖基,并增强其他酶(如木聚糖酶和β-木糖苷酶)的作用[37]。为了探究重组α-L-阿拉伯呋喃糖是否可以用于酶促果汁澄清时的聚糖酶的复合酶,通过添加0~30 U/mL的重组α-L-阿拉伯呋喃糖苷酶处理柚子汁,结果如图7B所示,重组α-L-阿拉伯呋喃糖对柚子汁有澄清作用,加酶量为15 U/mL时,效果最好,其澄清度提高了15.18%,但随着加酶量的增加,透光率却下降。与高佳等[38]研究的果胶酶处理酸樱桃果浆的结果一致。相关学者对此的解释是使用的酶本质为蛋白质,蛋白过量会使果汁产生一定程度的浑浊,从而使果汁的透光率下降[39]。陈伟等[40]研究了重组嗜热甘露聚糖酶对柿子汁、苹果汁、桃汁和葡萄汁的澄清度分别提高了31.8%、7%、4%和4%。高佳等[38]研究了商业果胶酶在最优条件下对酸樱桃果浆的澄清度提高了13.13%。与此相比该酶对柚子汁的澄清效果显著,可作为酶促果汁澄清时聚糖酶的复合酶使用。说明本研究中表达的重组α-L-阿拉伯呋喃糖具有显著的果汁澄清效果,可作为果汁澄清新型酶进一步加以研究,后期可探究该酶协同聚糖酶(如果胶酶、纤维素酶、木聚糖酶等)对果汁的澄清。
3 结 论
对A. niger的AB基因(UniProt:A0A100ITZ9)进行克隆并在毕赤酵母中进行异源表达后得到大小为85 kDa的重组蛋白。通过疏水柱、阴离子交换柱、分子筛等对重组蛋白进行纯化后,其比活力为55.73 U/mg。最适反应温度和pH值分别为65 ℃和5.0,在pH 4.0~8.0稳定性较好。金属离子K+对酶活力有促进作用,而Cu2+对酶活有明显的抑制作用;以4-硝基苯基-α-L-阿拉伯呋喃糖苷为底物时测得该酶的Km值和Vmax值分别为2.31 mmol/L和625 μmol/(mL·min);加酶量为15 U/mL时,对柚子汁的澄清效果最好,其澄清度提高了15.18%。本研究不仅丰富了现有的α-L-阿拉伯呋喃糖苷酶资源库,同时为后续探究α-L-阿拉伯呋喃糖苷酶的应用提供了重要的理论参考。
