逍遥散对抑郁大鼠海马CA1区PI3K/AKT信号通路的调节作用研究
2022-02-15周雪明尹雅静常卓柳晨玥邓贺梁碧月谭曾德隋方宇
周雪明,尹雅静,常卓,柳晨玥,邓贺,梁碧月,谭曾德,隋方宇*
(1.黑龙江中医药大学,黑龙江 哈尔滨 150040;2.北京中医药大学,北京 100029;3.中国中医科学院中药研究所,北京 100700;4.黑龙江中医药大学附属第一医院,黑龙江 哈尔滨 150040)
抑郁症是临床常见的精神疾病之一,主要表现为长期情绪低落和快感缺失等症状,根据世界卫生组织的最新统计数字,每年有近80万抑郁症患者死于自杀,抑郁症已经成为世界第三大疾病负担,并预测2030年将成为世界第一大疾病负担[1]。基于藏象理论中“肝主疏泄,调畅情志”的观点,中医学多从“肝”论治情志疾病,包括抑郁症。逍遥散始载于《太平惠民和剂局方》,具有疏肝健脾之效,对情志疾病的治疗具有显著疗效。课题组前期研究发现逍遥散能降低抑郁症大鼠海马组织中的谷氨酸水平,而谷氨酸是介导大部分中枢神经兴奋性的传导中枢[2]。N-甲基-D-天门冬氨酸(N-methyl-D-aspartate,NMDA)是一类离子型谷氨酸受体,研究表明NMDA受体所触发的信号通路中,磷脂酰肌醇3-激酶/蛋白激酶B(phosphoinositide 3-kinase/protein kinase B,PI3K/Akt)信号通路在介导突触可塑性、参与神经发生、损伤后修复等过程发挥重要作用[3]。本研究选用慢性不可预知温和应激(chronic unpredictable mild stress,CUMS)法诱导建立抑郁大鼠模型,探讨逍遥散对谷氨酸和PI3K/Akt信号通路的调节作用。
1 材料
1.1 动物
实验用SD雄性大鼠100只,体质量(200±20)g,于北京中医药大学SPF级动物实验室进行饲养,温度(20±1)℃,相对湿度(60±10)%,每日12 h光/暗周期,自由摄食饮水,适应性喂养1周后开始进行实验。实验动物均购于北京维通利华实验动物技术有限公司,动物合格证号SCXK(京)2016-0038。本实验已通过北京中医药大学动物伦理委员会批准(BUCM-4-2017051015-2015)。
1.2 药物
逍遥散由柴胡、白芍、当归、炒白术、茯苓、炙甘草、薄荷、生姜组成,按照药物比例5∶5∶5∶5∶5∶4∶1∶5进行配比调制。药物饮片购自北京同仁堂(毫州)饮片有限责任公司,由九芝堂股份有限公司按照《中国药典2015年版》的流程进行制备,放入4 ℃冰箱备用;盐酸氟西汀分散片(百忧解,法国Lilly公司,批号9492AA)。
1.3 试剂
1.4 仪器
酶标仪(Biotek,型号Epoch2);实时荧光定量PCR仪(Bio-Red,型号CFX96);梯度PCR仪(Bio-Red,型号T100);大鼠脑切片模具(Zivic Instrument,BSRAS001-1);凝胶成像仪(Bio-Red)等。
2 方法
2.1 动物分组、造模及给药
将100只雄性大鼠适应性饲养7 d,称量后剔除体质量增长速度缓慢、过快的大鼠,旷场实验后剔除过于安静、活跃的大鼠,余下大鼠按照体质量进行标号,根据随机数字表法分为正常组、模型组、逍遥散组和氟西汀组。除正常组外的各组进行CUMS抑郁大鼠模型的制备:①24 h禁水,②24 h禁食,③45 ℃热烘5 min,④24 h潮湿垫料,⑤45°笼具倾斜17 h,⑥17 h白噪声,⑦24 h昼夜颠倒,⑧1 min夹尾,⑨3 h行为限制。上述刺激方式随机于21 d内每日选取1种,并连续2 d内不采用相同的刺激方式。每日观察大鼠的活动、进食情况、对刺激的应激反应,为造模成功标准提供参考。造模成功后,不同组别予以不同给药方案灌胃:逍遥散组(逍遥散生药2.224 g·kg-1d-1)、氟西汀组(氟西汀生药2 mg·kg-1·d-1)、模型组(与逍遥散组等体积双蒸水)、正常组(与逍遥散组等体积双蒸水)灌胃。连续3周灌胃后(给药过程中仍进行CUMS刺激,操作方法与上述造模方法相同),通过体质量检测、行为学检测(糖水偏嗜实验、旷场实验)对各组大鼠进行评估。
2.2 糖水偏嗜实验(SFT)
于造模前一天、造模成功后和给药结束后进行SFT。实验开始前72 h对大鼠进行适应性训练。第1日每笼放置2个外观、体积相同并均装有1%的蔗糖水的水瓶,第2日将其中一瓶糖水换为等体积双蒸水。禁食、水24 h后给予每只大鼠相同外观、体积的1%蔗糖水和双蒸水,1 h后取走水瓶并称重。根据公式“糖水偏嗜率(%)=糖水摄入量/(糖水摄入量+普通水摄入量)×100%”计算各组大鼠的糖水偏嗜率,可反映大鼠快感缺失的程度。
2.3 旷场实验(OFT)
于造模成功后、给药结束后进行OFT。将大鼠放置于一个正上方带有高清摄像头,体积为100 cm×100 cm×50 cm的黑色敞箱中,摄像头可拍摄大鼠在旷场箱中自由探索5 min的轨迹视频。每只大鼠探索结束后,用75%的乙醇清洗底部和四周。实验结束后,视频用Etho Vision 3.0软件分析计算大鼠在中央区停留时间和总的运动距离,可评估大鼠的行为活动。
2.4 体质量检测
于实验第0天(实验前),实验1周、2周、3周(造模成功后)、4周、5周、6周(给药结束后)分别对各组大鼠进行称体质量并记录。
2.5 摄食量测定
于实验开始后,监测各组每日、每周(连续6周)的摄食量。每日摄食量=给予食量-剩余食量,每周摄食量=每周给予摄食量-每周剩余食量。
2.6 酶联免疫吸附法(ELISA)检测海马组织中NE、5-HT水平
行为学检测结束后处死各组大鼠,留取海马组织。将海马组织块清洗后加入PBS,使用超声破碎仪将海马组织匀浆,匀浆液离心(5 000 r/min,5 min)后留取上清液进行检测。NE 稀释为400、200、100、50、25 pg/mL,5-HT稀释为240、120、60、30、15 pg/mL。余步骤按照ELISA试剂盒说明书进行操作。
根据相关参数绘制枯水期煤电机组需求曲线,其中横轴代表非强制容量,纵轴代表非强制容量价格。根据相关参数确定A、B两个点,然后A点与X轴平行画一条线,B点与纵轴平行画一条线,连接A、B即得出可靠性备用需求曲线如图4所示。其中目标容量水平在A点。其中A点为当年枯水期煤电必开机组的容量和固定成本,B点为可用机组的容量和可用机组的维持成本。
2.7 比色法检测大鼠海马CA1区谷氨酸浓度
行为学检测结束后处死各组大鼠,冰面取脑后用成年大鼠脑切片模具将脑组织切片(厚度1.0 mm),在解剖显微镜下取海马CA1区组织,冻存于-80 ℃低温冰箱中。取15 mg海马CA1区组织加入PBS,超声裂解样本后离心(14 000 r/min,10 min)取上清液,冻存于-80 ℃低温冰箱中待测。配制600 μL 2.5 mmol/L谷氨酸预混合溶液Premix,稀释后转移至透明底的96孔板孔中。每孔加入不同工作液后,记OD值检测,最后根据公式计算谷氨酸实际浓度。
2.8 实时定量PCR法(RT-qPCR)检测NR2B、PI3K的mRNA水平
取适量海马CA1区组织加入Trizol研磨后提取总 RNA,测定RNA浓度及纯度后合成cDNA。以反应条件95 ℃预变性10 min,95 ℃变性15 s,60 ℃退火60 s,40个循环进行RT-PCR检测,所得CT值采用2-ΔΔCT法进行计算。PCR引物由生工生物工程(上海)股份有限公司合成,见表1。
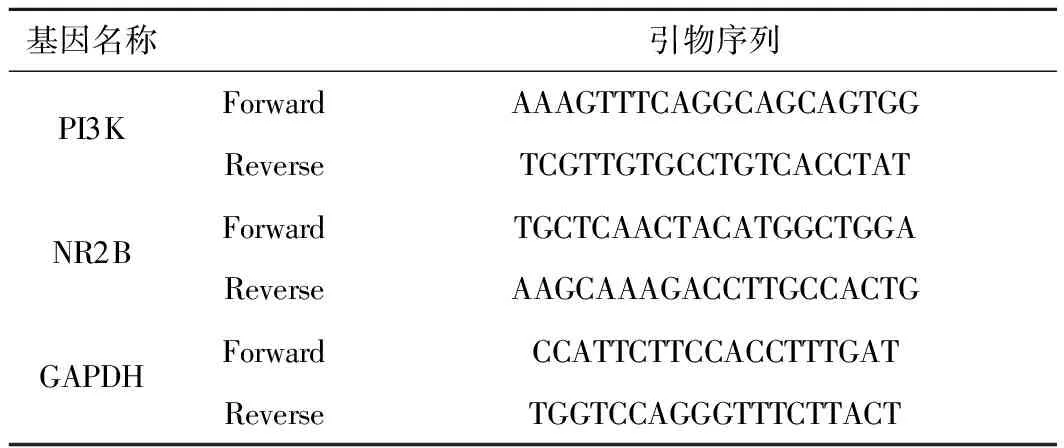
表1 RT-PCR引物序列
2.9 蛋白免疫印迹法(Western blot)测定NR2B、PI3K、P-AKT、Akt的蛋白表达
取100 mg海马CA1区组织加500 μL RIPA蛋白裂解液,用超声破碎匀浆后离心(12 000 r/min,15 min)取上清液待测。以12 000 r/min的转速4 ℃离心15 min。留取总蛋白后根据BCA法检测总蛋白的浓度,计算蛋白的上样量。SDS-PAGE电泳,转膜放入5% BSA的平皿中,室温封闭2h。转移至用5%脱脂奶粉稀释的一抗PI3K(1∶3 000)、Akt(1∶1 000)、P-AKT(1∶4 000)、NR2B(1∶1 000)和β-actin(1∶5 000)多克隆抗体中,4 ℃过夜孵育。TBST清洗3次后将膜加入辣根酶标记的山羊抗兔的二抗(1∶5 000),室温2 h孵育。TBST洗3次,TBS洗1次。在ChemiDoc MP Imaging System成像仪中用高灵敏度化学发光显色试剂盒进行化学发光反应并拍照保存。用Image J 2.0软件进行各条带灰度值分析,目标蛋白的相对含量以目标蛋白/β-actin蛋白灰度值的比值作为统计实验数据。
2.10 统计学分析

3 实验结果
3.1 逍遥散改善抑郁模型大鼠抑郁行为
3.1.1 旷场实验
6周CUMS造模和给药后各组大鼠OFT实验运动轨迹发生改变,见图1。6周CUMS造模改变了大鼠在旷场实验的中央区停留时间和运动总距离,见表2。模型组与正常组比较中央区停留时间减少,有统计学差异(P<0.05)。逍遥散组、氟西汀组大鼠在中央区停留时间多于模型组,和模型组比较均有统计学意义(P<0.05)。模型组大鼠运动总距离短于正常组,和正常组比较有统计学意义(P<0.05)。逍遥散组、氟西汀组大鼠在中央区停留时间多于模型组,与模型组比较均有统计学意义(P<0.05)。
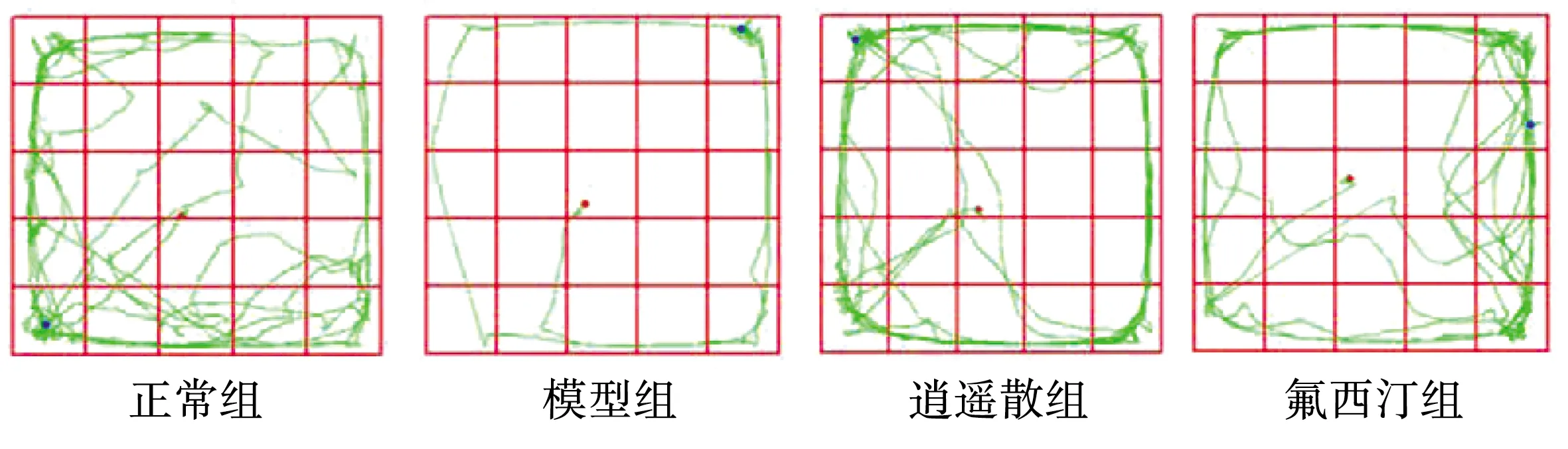
图1 各组大鼠OFT实验运动轨迹图
表2 各组大鼠中央区停留时间和运动总距离
3.1.2 糖水消耗实验
第0、21和41日进行了SPT,见表3。4组大鼠的基线蔗糖偏好率没有显著差异。CUMS造模3周后,模型组、逍遥散组、氟西汀组的大鼠蔗糖偏好率明显低于正常组,各组与正常组比较均有统计学意义(P<0.05)。给药3周后,糖水消耗实验发现模型组大鼠蔗糖偏好率低于正常组,与正常组比较有统计学意义(P<0.05)。经过逍遥散、氟西汀3周的治疗后,逍遥散组、氟西汀组大鼠的糖水消耗量高于模型组(P<0.05)。

表3 各组大鼠0、3、6周糖水消耗试验中糖水偏好
3.2 逍遥散增加抑郁模型大鼠的体质量和摄食量
3.2.1 大鼠摄食量监测结果
实验初,各组间大鼠摄食量比较没有统计学意义(P>0.05)。模型组大鼠第3周到第6周的摄食量均少于正常组,与正常组比较有统计学差异(P<0.05)。而逍遥散组、氟西汀组大鼠摄食量在造模前3周,与模型组比较没有统计学差异(P>0.05)。药物干预3周后,逍遥散组、氟西汀组大鼠摄食量较模型组增加,各组与模型组比较均有统计学意义(P<0.05)。见表4。
表4 各组大鼠摄食量变化
3.2.2 大鼠体质量监测结果
实验初,4组大鼠体质量比较没有统计学意义(P>0.05),但整个应激期,各组接受CUMS大鼠的体质量均受到了影响,见表5。各组模型大鼠体质量从第1周开始即低于正常组,与正常组比较有统计学意义(P<0.05)。而治疗3周后逍遥散组、氟西汀组大鼠体质量与模型组比较均有明显升高,与模型组比较有统计学意义(P<0.05)。
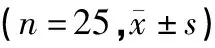
表5 各组大鼠体质量变化
3.3 逍遥散对大鼠海马5-HT和NE水平的作用
模型组大鼠海马组织5-HT和NE的水平较正常组下降(P<0.05),经逍遥散、氟西汀治疗了3周后,显著逆转了上述变化(P<0.05)。见表6。
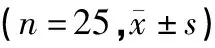
表6 各组大鼠海马5-HT、NE表达情况
3.4 逍遥散对大鼠海马CA1区谷氨酸水平的作用
各组接受CUMS造模的大鼠海马CA1区谷氨酸水平均有不同程度的升高,各组与正常组比较均有统计学意义(P<0.05)。逍遥散、氟西汀组谷氨酸水平较模型组降低,显著逆转了上述变化(P<0.05)。与正常组相比,模型组大鼠海马CA1区谷氨酸水平升高(P<0.05)。见表7。

表7 各组大鼠海马CA1区谷氨酸水平
3.5 逍遥散对抑郁模型大鼠海马CA1区NR2B表达的影响
RT-qPCR检测NR2BmRNA水平。模型组大鼠海马CA1区NR2B水平均低于正常组(P<0.05)。而逍遥散、氟西汀治疗3周后,大鼠海马CA1区NR2B水平与模型组比较显著升高(P<0.05)。见表8。
Western blot检测NR2B相对表达量。模型组大鼠海马CA1区NR2B的阳性表达低于正常组(P<0.05)。经过逍遥散、氟西汀治疗3周后,抑郁模型大鼠海马CA1区NR2B阳性表达显著升高(P<0.05)。见表8和图2。

表8 各组大鼠海马CA1区NR2B的表达

图2 NR2B蛋白表达
3.6 逍遥散对抑郁模型大鼠海马CA1区PI3K/AKT通路的影响
3.6.1 逍遥散对抑郁模型大鼠海马CA1区PI3K表达的影响
RT-qPCR检测大鼠海马CA1区PI3KmRNA水平。实验结果显示模型组、大鼠海马CA1区PI3KmRNA水平低于正常组(P<0.05)。经过逍遥散、氟西汀治疗3周后,大鼠海马CA1区的PI3K水平明显增高,与模型组比较均有统计学意义(P<0.05)。见表9。
Western blot检测大鼠海马CA1区PI3K蛋白相对表达量。模型组大鼠海马CA1区PI3K的表达低于正常组(P<0.05)。逍遥散、氟西汀治疗3周后,抑郁模型大鼠海马CA1区PI3K表达明显增加(P<0.05)。见表9和图3。
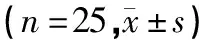
表9 各组大鼠海马CA1区PI3K的基因和蛋白表达水平

图3 PI3K蛋白表达
3.6.2 逍遥散对抑郁模型大鼠海马CA1区P-AKT表达的作用
Western Blot检测结果显示大鼠海马CA1区P-AKT/Akt比值在模型组低于正常组(P<0.05)。逍遥散、氟西汀治疗3周后,抑郁模型大鼠海马P-AKT/Akt比值表达明显增加(P<0.05)。见表10和图4。

表10 各组大鼠海马CA1区P-AKT/Akt的相对表达情况

图4 P-AKT/Akt 蛋白表达
4 讨论
抑郁症属于中医“郁证”范畴,其症状表现与中医学中癫狂、百合病、邪哭、脏躁、惊悸、奔豚气等病症的证候表现均有符合,长期以来也是中医学治疗的优势病种之一。中医学对抑郁症的治疗多从“肝”论治,其理论基础源于藏象理论中的“肝主疏泄”,其中“疏泄情志”是其重要的体现。而情志不畅反之又会使“肝失疏泄”,进一步引起“肝郁乘脾”,从而出现肝郁脾虚的证候,故对于抑郁症的治疗应在“疏肝”的基础上,酌以“健脾”。逍遥散是从古至今治疗“郁症”的常用基础方药,全方由柴胡、当归、白芍、白术、茯苓、薄荷、甘草和生姜组成,以疏肝为主,兼以健脾养血,共奏疏肝解郁之功效。现代医学研究也不断地证明其在抑郁症治疗方面的显著疗效[4-6],本课题组在前期研究中也证实了逍遥散的体内干预可显著降低汉密尔顿抑郁量表(HAMD)及抑郁症患者自评抑郁量表(SDS)得分[7],本研究则在此基础上采用国际公认的CUMS方法构建抑郁症动物模型[8],进一步对逍遥散治疗抑郁症的作用机制进行了深入探究。
抑郁症的发生与神经系统疾病密切相关,通过参与脑内神经突触可塑性保护、恢复神经营养因子及神经递质功能等可能是探索抗抑郁治疗效应机制的重要方向[9]。在所有的脑区中,海马CA1区对认知和空间学习至关重要[10],是参与记忆和情绪信息处理的关键脑区,对应激反应敏感且易损伤,且研究证实抑郁症患者的海马CA1区会出现损伤及退化,而这种损伤也更易引起神经系统疾病的发生,从而加重抑郁症状[11]。谷氨酸是介导大多数中枢兴奋性神经传导的递质,脑内神经元中谷氨酸的合成、代谢和再摄取异常时介导的兴奋性毒性会造成脑内神经元损伤,与抑郁症的发生密切相关[12-13]。NR2B作为NMDA家族中的一员,也是一种谷氨酸受体,对调控突触可塑性和记忆功能具有重要作用[14],NR2B的异常降低被证实与抑郁症的发生密切相关[15],而经过抗抑郁治疗后NR2B也得到了显著提高[16]。根据本研究结果,抑郁症大鼠的海马CAI区谷氨酸水平显著高于正常大鼠(P<0.05),而NR2B则出现了明显的降低(P<0.05),进一步证实了与NR2B减少相关的谷氨酸积累可能是抑郁症发生的重要机制,这也与Dong Jun等[17]人的研究结果相符合。通过进一步的研究发现,NR2B的改变会影响其下游的PI3K/Akt信号通路,参与了大部分的神经元死亡事件[18]。PI3K/Akt是近年来在抑郁症领域研究的重要信号通路,对于该信号通路的调控可通过抑制神经元凋亡从而发挥抗抑郁作用,如二环类抗抑郁药物文法拉辛通过作用于PI3K/Akt通路,可显著改善大鼠的抑郁行为[19]。本研究结果中,抑郁症大鼠海马中PI3K、p-AKT的mRNA和蛋白表达较正常大鼠均有不同程度的降低(P<0.05),提示该条信号通路受到抑制,而这也与其上游NR2B的异常降低相关。经过逍遥散体内干预后,抑郁症大鼠海马中NR2B、PI3K、p-AKT的水平均显著提高(P<0.05),且谷氨酸水平也出现了明显降低(P<0.05),这说明逍遥散可能通过干预NR2B调节PI3K/Akt信号通路,从而改善谷氨酸升高引起的兴奋性毒性,最终发挥抗抑郁的作用。
综上所述,逍遥散可改善抑郁样行为从而发挥抗抑郁作用,其机制可能与活化PI3K/Akt信号通路,进一步发挥神经保护作用而实现的,但关于该方发挥主要抗抑郁作用的药物以及全方的内在抗抑郁机制还有待进一步研究。
