蛇床子催眠活性组分对PCPA失眠大鼠松果体细胞凋亡和相关Bcl-2/Bax蛋白表达的影响
2022-02-15郭晋良杨钤王若瑜宋美卿贾力莉牛艳艳仝立国冯玛莉
郭晋良,杨钤,王若瑜,宋美卿,贾力莉,牛艳艳,仝立国,冯玛莉
(山西省中医药研究院,山西 太原 030012)
松果体(Pineal gland,PG)被认为是昼夜节律的神经内分泌转换器,以高度昼夜节律的方式产生褪黑激素(Melatonin,MT),传播昼夜节律的信息[1]。褪黑素作为松果体的主要分泌产物,除了具有镇静、调整生物钟外,还有强大的清除氧自由基和抗氧化功能、保护膜脂质、线粒体免受氧化损伤,维持神经胶质细胞功能等作用[2-3]。当松果体结构功能损伤后,会影响褪黑素分泌引发一系列生理紊乱。目前研究认为,松果体组织结构损伤与细胞凋亡关系密切,细胞凋亡导致细胞可控性自我灭亡,当细胞开始受损或不再被机体需要时,会发生凋亡或称程序性细胞死亡,为机体生理过程[4],因此松果体细胞凋亡可能是导致松果体组织发生不可逆损伤的重要原因,而细胞凋亡由多种凋亡基因调控,其中对Bcl-2、Bax的研究调控线粒体凋亡途径的重要蛋白[5]。
前期研究发现PCPA制备失眠大鼠导致松果体细胞排列、细胞结构改变,具有显著催眠作用的蛇床子催眠活性组分对PCPA失眠大鼠致松果体结功能损伤具有改善作用[6-7]。本研究在前期基础上,观测CHC对松果体组织细胞凋亡密切相关的Bcl-2、Bax蛋白表达的影响,基于线粒体介导的细胞凋亡途径,探讨CHC改善PCPA失眠大鼠松果体损伤作用靶点,以期从蛇床子催眠活性成分中发现保护松果体有效成分及其机制。
1 材料
1.1 动物
SPF级SD大鼠,雄性,4~6月龄,购买自北京华阜康生物技术有限公司,实验动物许可证号:SCXK(京)2019-0008,合格证号:110322011006905,置恒定温度(22~24 ℃)与湿度(40%~50%)的实验环境中,自由饮水、摄食饲料。
1.2 药品与试剂
CHC制备:蛇床子600 g粉碎成粗粉,加95%的乙醇加热回流提取,滤过,干燥,浸膏,通过D101大孔吸附树脂柱层析,30%~95%浓度乙醇梯度洗脱,收集60%乙醇洗脱液,减压浓缩干燥,得20.5 g,每克折合蛇床子29 g,使用时以2 %吐温80配制成不同浓度的混悬液;褪黑素(北京Solarbio公司,批号:917D021)。Annexin V-FITC/PI 细胞凋亡检测试剂盒(凯基生物公司,批号:20190730);TUNEL试剂盒(碧云天,批号:011420200717);Bcl-2多克隆抗体(abcam公司,批号:CR249198-76);Bax多克隆抗体(CST公司,批号:9662S)。
1.3 仪器
Navios 10流式细胞仪(美国 Beckman Coulter 公司);Heated自动染色机(美国Thermo Fisher公司);Shandon Clearvue自动封片机(美国Thermo Fisher公司);BX51+DPT2+IPE万能显微镜荧光成像系统(日本Olympus公司)。
2 方法
2.1 模型制备与分组
大鼠适应性喂养7 d,随机分为空白对照组、模型对照组、MT阳性对照(10 mg/kg)组、CHC高、中、低剂量(60、30、15 mg/kg)组,每组10只。参考PCPA混悬液配制方法[3]改良如下:用时以2%吐温-80配制碳酸盐(碳酸钠/碳酸氢钠)缓冲液(pH 10.1),配成4.5% PCPA混悬液。除空白对照组给予等量含2%吐温的碳酸盐缓冲液,其余各组大鼠腹腔注射PCPA混悬液0.45 g/kg,每天1次,连续2 d。造模各组大鼠昼夜节律消失,出现皮毛枯槁战栗且易脱落等外观改变,直立、洗脸、走动等次数变多,兴奋性增高,易惊吓,易激惹,易攻击撕咬,表明模型复制成功。各给药组灌胃给药,空白对照组、模型对照组灌胃等体积2%吐温-80,每天1次,连续7 d。
2.2 指标检测
2.2.1 记录体质量
在造模前、造模后灌胃前、灌胃后3个时间节点称量各组大鼠体质量。
2.2.2 松果体组织病理学观察
末次给药30 min后,剖取松果体,10%甲醛溶液固定,石蜡包埋HE染色,显微镜下观察组织形态学变化。
2.2.3 TUNEL凋亡指数检测
取松果体组织切片,经脱蜡、脱水后,采用TUNEL法检测细胞凋亡,具体操作按试剂盒说明书进行。高倍镜(×400)显微镜观察细胞核呈棕褐色为阳性细胞,计算松果体细胞凋亡指数,以凋亡指数反映各组松果体凋亡的情况,凋亡指数(Allgroups’apoptosisindex,AI)=视野内凋亡细胞个数/视野内所有松果体细胞个数。
2.2.4 流式细胞术检测松果体凋亡
同上法剖取松果体,PBS(pH7.2、0.01 mol/L)清洗,加入0.25%胰蛋白酶,37 ℃、20 min,加胎牛血清终止消化,过滤,去除结缔组织,1 000 r/min离心5 min,弃上清,用Binding缓冲液调细胞悬液至细胞浓度为5×106/mL,取细胞悬液100 μL,加AnnexinV-FITC及Propidium Iodide各5 μL,避光孵育15 min,加Binding缓冲液0.5 mL,上机检测。
2.2.5 免疫组化检测凋亡蛋白Bax、Bcl-2表达
按中杉金桥兔二步法检测试剂盒说明书操作,Bcl-2、Bax稀释度分别为1∶200及1∶100,DAB显色,阳性表达细胞被染成棕黄色,显微镜观察并拍片。用Image pro plus 6.0进行分析,以积分吸光度和阳性染色面积比值表示蛋白的相对表达量。
2.3 统计学分析
3 结果
3.1 体质量变化
体质量变化:对造模前、造模后给药前、给药后3个时间节点的大鼠体质量进行分析,与空白对照组比较,造模前各组大鼠体质量并没有差别、较稳定,具有可比性;腹腔注射PCPA混悬液后造模各组大鼠体质量呈下降趋势,模型对照组显著低于空白对照组(P<0.01);给药后模型对照组显著低于空白对照组(P<0.01),CHC高、CHC中剂量组显著高于模型对照组(P<0.01,P<0.05),给药各组的体质量均数介于PCPA模型与空白对照组之间,见表1。
表1 各组大鼠体质量变化情况
3.2 各组大鼠病理组织学变化
空白对照组松果体细胞排列紧密,细胞核呈圆形,可见明显的核仁并有较深的着色,胞质由于弱嗜碱性而染色较浅,胞膜完整;胶质细胞呈梭形或星形少数,形态规则,核仁清晰,整体无明显细胞损伤表现。模型对照组的松果体细胞数目明显减少,细胞界限模糊,细胞体积萎缩变小,排列紊乱疏松,无明显规律,胞质内存在较多大小不一的脂滴,空泡变性明显增多,细胞核固缩向周边移动,出现少量凋亡小体,胶质细胞减少。MT组松果体细胞紊乱排列,数目减少,空泡变性增多,细胞界限模糊不清。CHC高、CHC中剂量组的松果体细胞排列轻度紊乱,核固缩,CHC高剂量组的松果体细胞形态恢复效果最好。CHC低剂量组与模型对照组无明显差别,见图1。
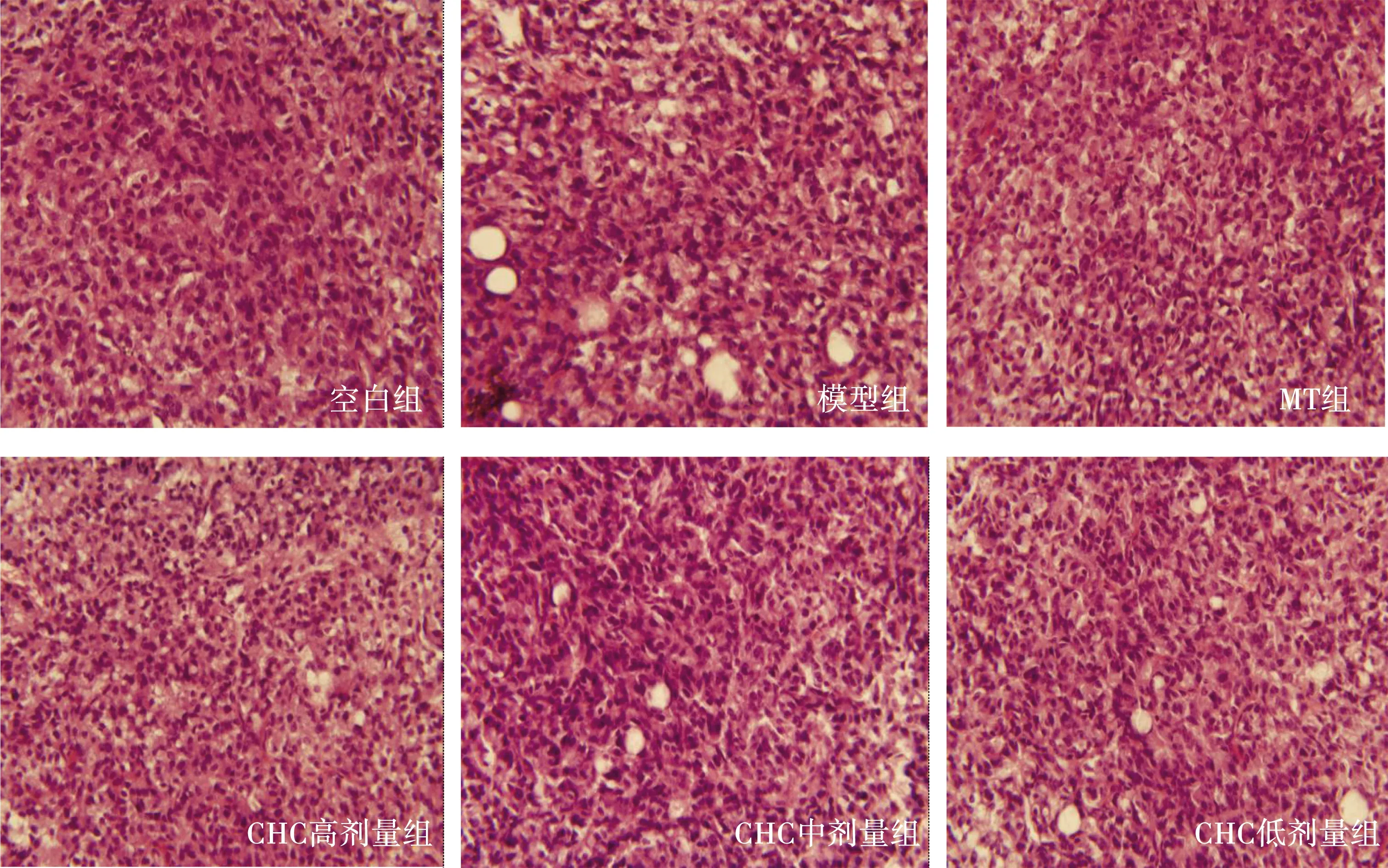
图1 各组大鼠松果体病理组织学变化(HE,×400)
3.3 各组大鼠松果体细胞凋亡情况
3.3.1 TUNEL松果体AI指数
模型对照组AI指数显著高于空白对照(P<0.01);MT组、CHC高、中剂量组AI指数显著低于模型对照组(P<0.01),见表2。
3.3.2 各组大鼠松果体早期凋亡率
模型对照组大鼠松果体细胞早期凋亡率显著高于空白对照组(P<0.05);CHC高剂量组早期凋亡率显著低于模型对照组(P<0.05),见表2。
表2 各组大鼠松果体凋亡指数、早期凋亡率的比较
3.4 各组大鼠对松果体Bax、Bcl-2表达的影响
与空白对照组比较,模型对照组Bcl-2阳性表达明显下降(P<0.05),与模型组比较,MT组、CHC高、中剂量组Bcl-2蛋白表达升高(P<0.01,P<0.05);与空白对照组比较,模型对照组Bax阳性表达显著升高(P<0.01),与模型组比较,MT组、CHC高、中剂量组Bax蛋白表达明显下降(P<0.05,P<0.01),见表3。

表3 各组大鼠松果体Bcl-2、Bax表达情况
4 讨论
PCPA是一种作用于5-HT生物合成中的色氨酸羟化酶的不可逆抑制剂,阻断5-HT合成,常用于建立大鼠失眠模型,为制备失眠模型的经典方法[8]。课题组前期在模型评价时光镜、电镜下观察松果体组织出现明显病理改变,证实腹腔注射PCPA损伤大鼠松果体结构,本实验以2%吐温-80增加PCPA溶解,为PCPA制备失眠造模提供更有效的方法。腹腔注射PCPA混悬液诱发大鼠松果体损伤及凋亡的机制尚不清楚,未见PCPA化学毒性、神经毒性或损伤组织细胞的相关报道。文献提示长期清醒状态下大脑更易受氧化应激的影响,由于脑组织不饱和脂肪酸及蛋白质含量较高,代谢旺更易氧化和产生自由基,细胞、组织更易受损[9-11],PCPA注射后大鼠持续清醒状态可能是松果体受到损伤的一部分原因。本次实验病理切片显示,PCPA造模组细胞周围间隙增宽,细胞数目减少且形态不完整,胞体变小,胞核变形不规则,空泡变性增多,CHC中、高剂量组大鼠松果体细胞数量、排列规则、形态均接近正常大鼠,再次验证腹腔注射PCPA对松果体结构功能造成一定的破坏,CHC可不同程度改善松果体损伤。
目前在PCPA大鼠模型中关于体质量变化的相关统计,结果基本一致,相关实验证明大鼠注射PCPA后体质量延缓增长或降低,但有关体质量减低的明显差异节点不同。有部分实验研究提示PCPA注射2 d后体质量迅速下降,与空白对照组比较差异十分显著[12-13]。本次结果显示,造模前各组大鼠体质量与空白对照组比较无差别,各组大鼠的体质量相对稳定,具有可比性;腹腔注射PCPA 2 d对大鼠体质量产生影响,造模后大鼠体质量明显下降,随7 d灌胃给药,各组大鼠体质量缓慢增长,CHC中、高剂量组体质量得到改善,说明CHC可缓解PCPA失眠大鼠体质量下降的趋势。
细胞凋亡是由相关基因经过特定的调控程序、参与细胞生理性死亡的过程。目前已报道有数十种基因调控着细胞凋亡过程。比如按照功能区分为能够抑制凋亡基因的IAP、Bcl-2、EIB等作为一类,能够促进凋亡基因的Fas、Bid、Bax、P53等作为一类。还有能够双向调控基因比如Bcl-x、C-mye等[14-15]。在这3类相关调控基因中,Bcl-2是目前被认识第一个识别为能够抑制细胞凋亡的特定基因,相关研究指出基因Bcl-2能够抵抗其凋亡机制的主要原因有直接性的抗氧化、抑制细胞中调节蛋白Bak、Bax的促凋亡的细胞毒作用、牵制在线粒体中释放加速凋亡的相关蛋白质比如凋亡诱导因子(AIF)和细胞色素C、以及阻止凋亡蛋白酶激活、维持相关细胞钙的稳态[16-17]。其中Bcl-2/Bax是能够抑凋亡和促细胞凋亡的特定基因表达的蛋白。两对功能相反的基因关系极为密切,因为两个基因的表达能够平衡,这决定着相关细胞存活和特定细胞的死亡[18]。
本次实验研究中应用TUNELAI指数及流式观察早期细胞凋亡的计算发现,说明PCPA模型组大鼠显著增加了松果体细胞凋亡,MT组同CHC中、高剂量组均能抑制松果体细胞凋亡,证实了CHC对松果体保护作用的实验验证。实验结果同时显示,模型对照组松果体Bcl-2蛋白表达下降,但Bax蛋白表达增加明显。通过给予CHC之后,Bcl-2的表达会明显升高,但Bax 表达会降低明显,提示CHC通过协调Bcl-2/Bax的平衡对PCPA失眠大鼠细胞凋亡进行改善与保护。如果能够对CHC的凋亡机制做更充分和深入的了解,更全面去认识CHC,它可能会成为一个潜在的治疗松果体损伤并且能够改善睡眠的新药,为失眠患者带来福音。
