奶牛A6型溶血性曼氏杆菌与牛支原体混合感染的实验室诊断
2022-02-08金圣子尢振东黄思琪刘星尧刘雪松
金圣子 , 尢振东 , 黄思琪 , 刘星尧 , 郑 铎 , 刘雪松 , 刘 云
(1.东北农业大学动物医学学院黑龙江省实验动物与比较医学重点实验室 , 黑龙江 哈尔滨 150030 ;2.黑龙江省农业科学院畜牧兽医分院 , 黑龙江 齐齐哈尔 161005)
随着养牛业的快速发展,呼吸系统疾病成为危害养牛业发展的一类重要疾病。且牛呼吸道疾病的原因很复杂,常由病毒、细菌和牛支原体单独或混合感染引起,给养牛业造成了巨大的经济损失。溶血性曼氏杆菌(Mannheimiahaemolytica,Mh)是反刍动物上呼吸道的共生细菌[1]。但当动物免疫机能损害时,Mh会侵入下呼吸道,是引起牛运输热 (Shipping fever)及牛呼吸道疾病(Bovine respiratory diseases,BRD)的主要病原菌[2]。Mh可根据表面蛋白的抗原性差异分为12种荚膜血清型,其中血清型A1和A6目前最容易造成牛场大规模肺炎的暴发[3]。另外Clawson 等通过核苷酸多态性基因型的系统发育分析将Mh分为2个主要基因型(1型和2型),其中基因2型Mh被证实是造成BRD的潜在致病株[4]。牛支原体是一种介于细菌与病毒之间的无细胞壁结构的原核微生物,分布于世界各地,且牛支原体常伴随其他病原混合感染[5],能够对机体的免疫防御系统造成严重的破坏,以达到增强继发感染病原微生物致病力的效果。牛支原体可在宿主体内持久存在,并有多种传播途径,牛群中一旦感染便很难清除。
1 材料与方法
1.1 试验材料
1.1.1 样本采集 病料来自某规模化奶牛场病死牛。该牧场进入12月份后陆续有奶牛出现体温升高、流鼻涕、呼吸困难等症状,且病程短、死亡率高。其中对病牛呼吸道疾病综合征相关病毒,牛传染性鼻气管炎病毒(Infections bovine rhinotracheitis virus,IBRV)、牛病毒性腹泻病毒(Bovine viral diarrhoea virus,BVDV)、牛呼吸合胞体病毒病(Bovine respiratory syncytial virus,BRSV)、牛副流感病毒(Bovine parainfluenza virus,BPIV)的检测结果均为阴性。对病死奶牛进行剖检,肺表现间质性肺炎、肺气肿及纤维素性胸膜炎等病理变化。无菌采取肺组织,4~8 ℃保存备用。
1.1.2 主要试剂 脑心浸液培养基(BHI),购自北京奥博星生物技术有限公司;绵羊血平板,购自南京佰杰斯生物技术有限公司;MH肉汤培养基(MHB),购自广州鸿泉生物科技有限公司;革兰染液、瑞氏-吉姆萨染料,均购自于南京建成生物工程研究所;DNA提取试剂盒,购自北京天根生化科技有限公司;细柱式DNA胶回收试剂盒,购自生工生物工程(上海)股份有限公司;药敏纸片,购自温州市康泰生物科技有限公司;引物委托哈尔滨擎科生物科技有限公司合成。
1.1.3 实验动物 清洁级昆明白雌鼠,40日龄,购自长春长生科技有限公司,许可证号:SCXK(辽)2020—0001。
1.2 试验方法
1.2.1 牛支原体检测 无菌操作剪取奶牛肺脏后,加入少量生理盐水研磨,按DNA提取试剂盒说明书提取病料DNA,然后以此为模板对牛支原体uvrC特异性基因进行PCR扩增[6]。引物信息见表1。

表1 本研究中寡核苷酸引物序列Table 1 Sequence of oligonucleotide primers used for this study
1.2.2 细菌的分离纯化及染色镜检 将5头病死奶牛无菌采集的肺组织接种于绵羊血平板上,于37 ℃恒温培养24 h后观察菌落生长状态,挑取单个菌落接种于BHI液体培养基进行纯化,置于37 ℃摇床,220 r/min培养12 h。取菌液进行革兰染色及瑞氏染色后镜检。
1.2.3 致病菌分子学鉴定 分别从接种5头奶牛肺脏的培养皿中挑取菌落,按基因组提取试剂盒说明书提取细菌的基因组DNA,并以此为PCR扩增的模板,应用引物AJ11[7]随机扩增多态性DNA(Random amplified polymorphic DNAs,RADP)技术进行归类。PCR扩增16S rRNA并进行测序,扩增产物测序结果提交 GenBank数据库,再用NCBI BLAST及DNASTAR的MegAlign软件对序列进行比对。引物信息见表1。
1.2.4 菌株荚膜血清型及基因型鉴定 菌株荚膜血清型的鉴定采用Klima等[9]建立的鉴定Mh荚膜血清型1型、 2型和6型的PCR鉴定法。提取菌株的全基因组DNA后,分别以Hyp、Core2、TupA为靶基因进行PCR扩增,其中Hyp、Core2、TupA基因分别代表血清型1型、2型和6型。引物信息见表1。菌株基因型的鉴定采用Wynn等[10]建立的菌落表型目测鉴定法。菌株先在血琼脂平板上于37 ℃、5%CO2的条件下培养两代后,再于血平板上培养18 h,根据固体培养基上的菌落颜色及三维形状等表型特征来区分基因1型和2型菌株。
1.2.5 小鼠致病性试验 取1 mL分离菌液接种于200 mL BHI培养液中,置于全自动控制的细菌发酵罐37 ℃、200 r/min培养,保证氧气充足。每隔一段时间从发酵罐中抽取菌液0.2 mL测OD600 nm值,并记录对应的数据,绘制生长曲线。采用稀释平板计数法测定对数生长期的菌液浓度,将1、0.2、0.04浓度的菌液腹腔注射小鼠(0.2 mL/只),观察4 d,记录病死数,按Reed-Muench法计算半数致死量(Median lethal dose,LD50)。
1.2.6 药敏试验 采用纸片扩散法测定致病菌对头孢克肟、头孢拉定、头孢噻肟、头孢唑林、头孢曲松、洛美沙星、恩诺沙星、环丙沙星、氨苄西林、阿莫西林、四环素、多西环素、美罗培南、庆大霉素共14种抗菌药的敏感性。判读标准遵循临床和实验室标准协会(Clinical and Laboratory Standards Institute,CLSI) 2020年发布的《M100抗微生物药物敏感性试验执行标准》。
2 结果
2.1 牛支原体检测 5头病死奶牛肺组织DNA经牛支原体uvrC特异性引物PCR扩增后均可见对应大小的目的条带 (图1),可见5头病死奶牛均感染支原体。
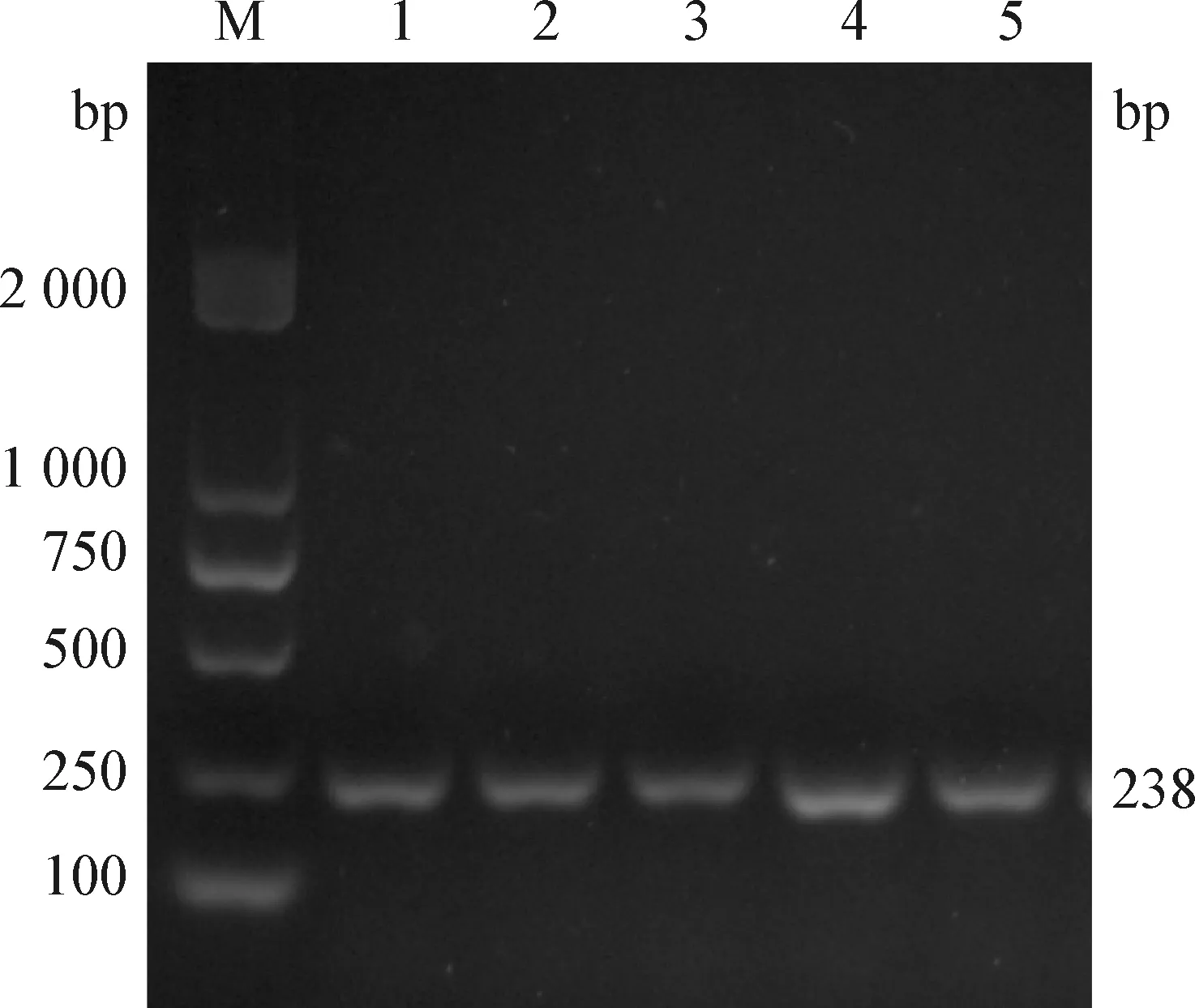
图1 uvrC基因PCR扩增Fig.1 PCR amplification of uvrC geneM:DL2 000 DNA 相对分子质量标准;1~5:奶牛编号M:DL2 000 DNA Marker;1-5:Number of cows
2.2 细菌的分离纯化及染色镜检 将5头病死奶牛的肺脏组织接种于绵羊血平板上,37 ℃培养24 h后在血平板才可观察到表面光滑的灰白色小菌落(图2A),且具有β溶血特征(图2B),除此之外未分离到其他细菌。革兰染色后呈阴性杆菌(图3A)、瑞氏染色可见两极浓染(图3B);菌体长度在1.2~2.5 μm,宽度在0.5~0.8 μm。
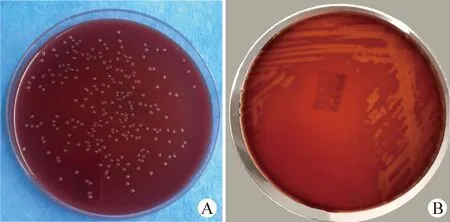
图2 致病菌培养特性Fig.2 Growth characteristics of pathogenic bacteriaA:致病菌在绵羊血平板上形成表面光滑的灰白色小菌落;B:致病菌在绵羊血平板上形成β溶血环A:Pathogenic strains formed small grayish colonies with smooth surface on sheep blood plates;B:Pathogenic strains formed β hemolytic rings on sheep blood plates
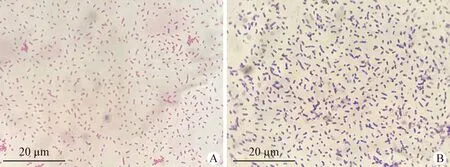
图3 致病菌镜检Fig.3 Microscopic examination of pathogenic bacteriaA:革兰染色; B:瑞氏染色A:Gram staining; B:Raynaud's staining
2.3 致病菌分子学鉴定 分别采自5头病死奶牛的5株溶血菌在随机引物扩增下,得到数量、大小一致的条带谱(图4A),提示5头病死奶牛感染相同的致病菌,将该致病株命名为RX2020。
经16S rRNA通用引物扩增,进行凝胶电泳后,在1 465 bp左右处得到条带(图4B),测序结果提交 GenBank数据库,登录号为MW325979,BLAST比对结果显示,5株分离菌均为Mh。核苷酸序列对比结果显示,其与2014年广东省动物卫生监督研究所分离到的牛源Mh(GenBank登录号:KM5768489)同源性为99.9%。
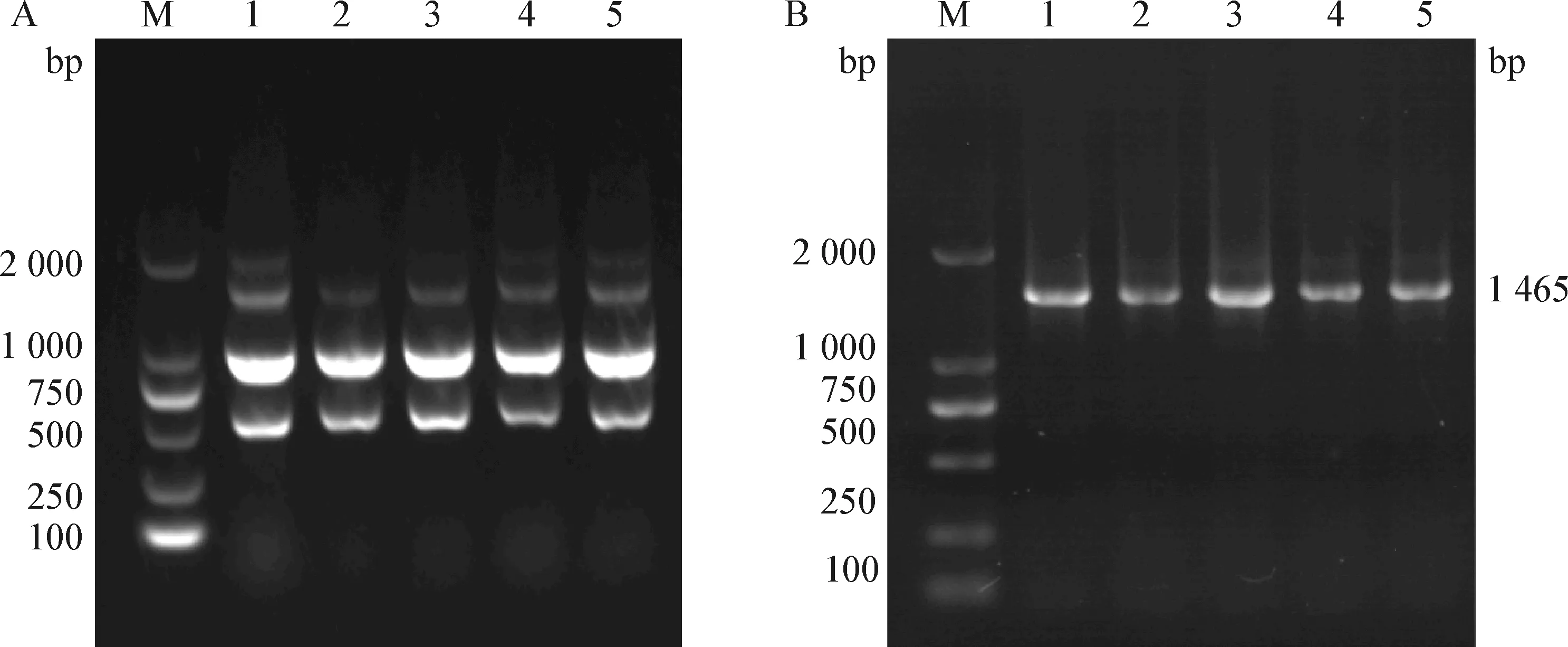
图4 分离菌株随机引物(A)及16S rRNA 通用引物(B)PCR扩增Fig.4 PCR amplification of random primers (A) and 16S rRNA universal primers (B) of isolated strainsM:DL2 000 DNA 相对分子质量标准; 1~5:5株分离株的PCR扩增产物M:DL2 000 DNA Marker; 1-5:PCR amplification products of 5 isolates
2.4 菌株荚膜血清型及基因型鉴定 RX2020的荚膜血清型PCR扩增结果显示,仅6型特异性基因TupAPCR结果为阳性 (图5),鉴定其为血清6型Mh。
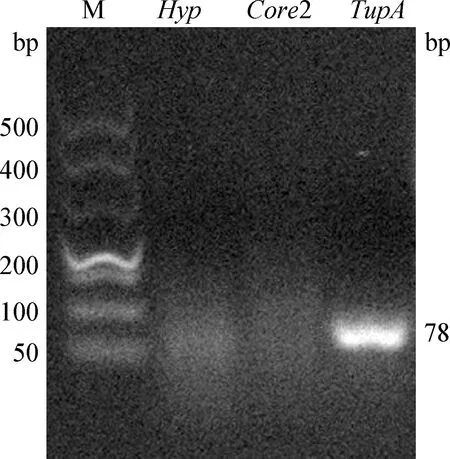
图5 RX2020荚膜血清型鉴定Fig.5 Capsular serotype identification of RX2020M:DL500 DNA 相对分子质量标准M:DL500 DNA Marker
按Wynn等[10]的方法培养后可观察到RX2020在血平板上生长为乳白色菌落,呈圆顶状,能均匀反射光线,边缘反射光与中心反射光一致 (图6),鉴定其为Mh基因2型菌株。

图6 RX2020菌落表型Fig.6 RX2020 colony phenotyping
2.5 小鼠致病性试验 根据生长曲线可知致病菌在培养5 h时处于对数生长期(图7),用稀释平板计数法测定此时菌液浓度为2.4×108CFU/mL,3个浓度的菌液腹腔注射后小鼠死亡情况见表2,按Reed-Muench法计算出RX2020对小鼠的LD50为1.94×107CFU。
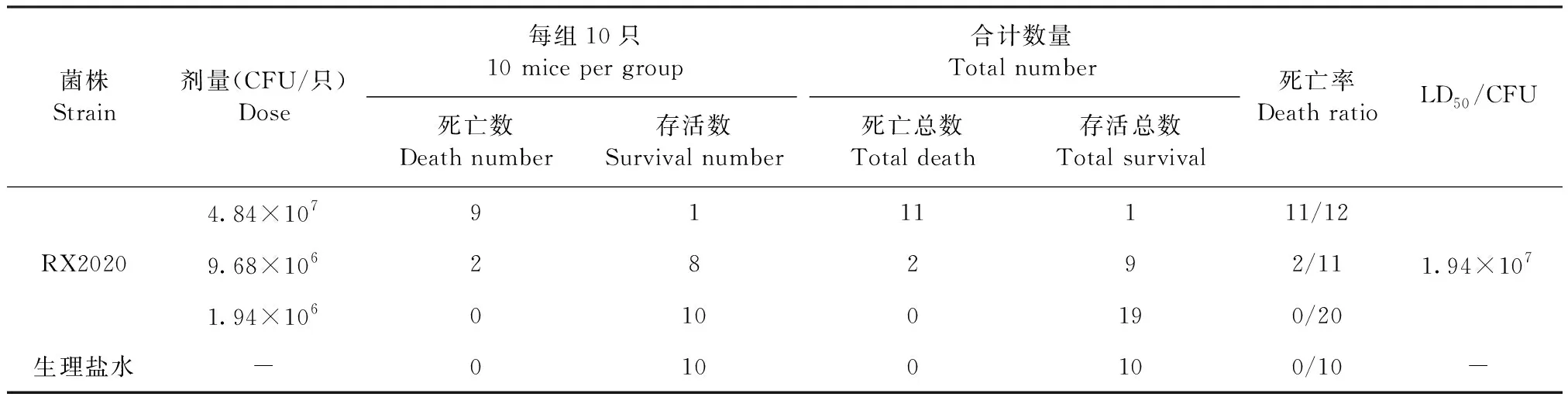
表2 RX2020对小鼠的LD50Table 2 LD50 in mice for RX2020
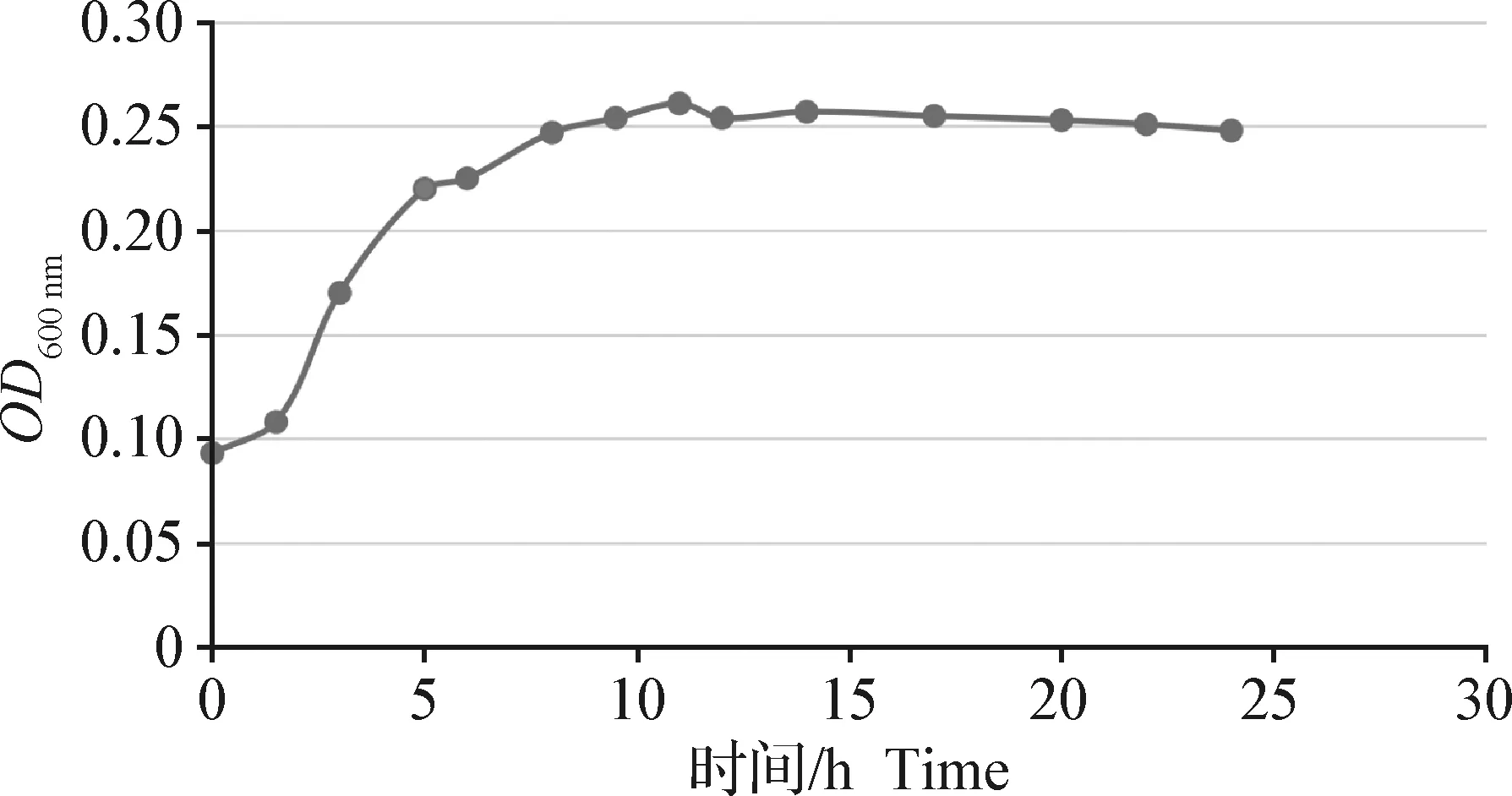
图7 RX2020的生长曲线Fig.7 Growth curve for RX2020
2.6 药敏试验 RX2020的药敏试验结果见表3,此分离株对大多数抗菌药敏感。
表3 药敏试验结果Table 3 Results of antibiotics sensitivity
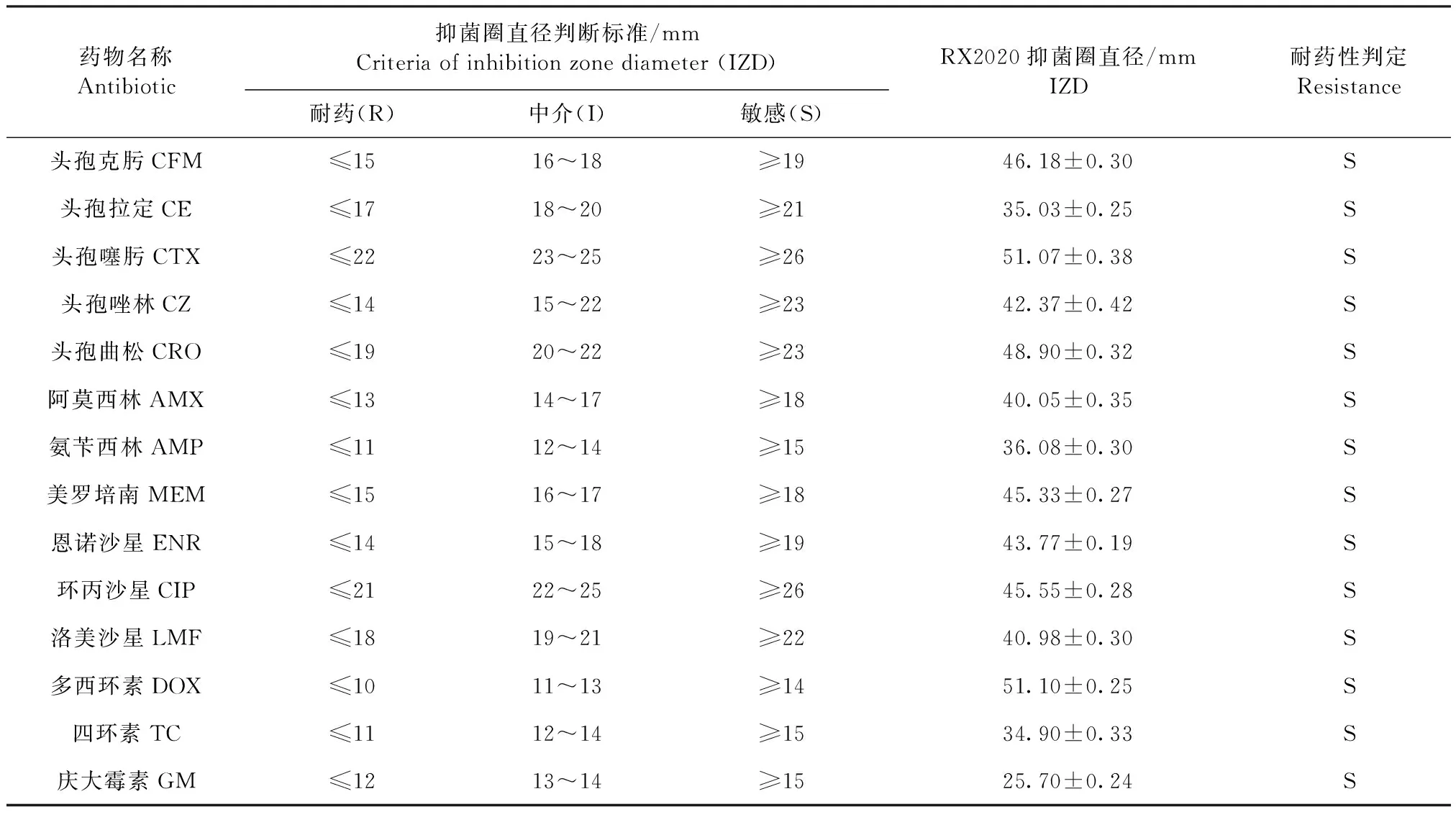
表3 药敏试验结果Table 3 Results of antibiotics sensitivity
药物名称Antibiotic抑菌圈直径判断标准/mmCriteria of inhibition zone diameter (IZD)耐药(R)中介(I)敏感(S)RX2020抑菌圈直径/mmIZD耐药性判定Resistance头孢克肟CFM≤1516~18≥1946.18±0.30S头孢拉定CE≤1718~20≥2135.03±0.25S头孢噻肟CTX≤2223~25≥2651.07±0.38S头孢唑林CZ≤1415~22≥2342.37±0.42S头孢曲松CRO≤1920~22≥2348.90±0.32S阿莫西林AMX≤1314~17≥1840.05±0.35S氨苄西林AMP≤1112~14≥1536.08±0.30S美罗培南MEM≤1516~17≥1845.33±0.27S恩诺沙星ENR≤1415~18≥1943.77±0.19S环丙沙星CIP≤2122~25≥2645.55±0.28S洛美沙星LMF≤1819~21≥2240.98±0.30S多西环素DOX≤1011~13≥1451.10±0.25S四环素TC≤1112~14≥1534.90±0.33S庆大霉素GM≤1213~14≥1525.70±0.24S
注:R:耐药; I:中介; S:敏感Note:R:Resistant; I:Intermediate; S:Sensitive
3 讨论
细菌感染引起的肺炎对围产期的奶牛来说是致命的。致病菌Mh是引起奶牛和犊牛肺炎的常见细菌,在我国新疆、内蒙、甘肃、黑龙江、云南、广西等地均有发现,重庆地区暴发过3次较大流行[11],给我国养牛业造成了重大的经济损失。而牛支原体肺炎在我国各地区均出现流行,有调查显示,超半数的牛场发生牛支原体感染,且许多奶牛场支原体抗体阳性率高于50%[12-13]。牛支原体的自然感染可导致渗出性支气管肺炎,但试验性牛支原体的单独感染仅能引起犊牛及免疫状态低下的成年牛亚临床肺炎[14]。且已有研究发现,由Mh或其他致病菌的初始感染引起的炎症会加剧牛支原体的感染[15]。可见牛支原体引起的成年牛严重肺部疾病是由于其与其他微生物之间相互作用,协同促进疾病发展。本试验利用常规微生物学方法和分子生物学技术,对某奶牛场患肺炎牛进行病原的分离培养以及血清型及基因型鉴定,并对分离菌株进行致病力及药物敏感性试验,为奶牛呼吸道疾病的诊断、预防与治疗提供参考,为Mh疫苗的生产提供菌种资源。
本次分离的A6型Mh对大多数抗菌药均敏感,但据驻场兽医反馈,头孢唑林配合青霉素联给药后治疗效果不显著。有统计指出,目前牛支原体对青霉素、头孢菌素类药物完全耐药,对氟喹诺酮类药物和大环内酯类药物都存在耐药基因,其高度敏感的四环素类药物中存在部分国家禁用兽药[16]。由此本课题组推论在混合感染的情况下,牛支原体可耐受抗菌药并干扰宿主免疫系统,妨碍宿主对原发病原Mh的清除,这意味着针对牧场由Mh引起的牛运输热及牛呼吸道疾病,早期识别并加强预防为最合理的疾控方式。
目前国内对牛Mh的研究主要集中在流行率和抗菌药敏感性上,关于Mh血清型流行性的研究很少。对血清型流行情况进行有计划的监测并保证所有致病性的血清型都已被开发的疫苗所涵盖,是决定疫苗保护效力的重要组成部分。A1型Mh一直被认为是引起牛呼吸道疾病的最主要血清型,即使研究指出A6型Mh引发BRD越来越普遍,大多数疫苗依然只针对溶血性曼氏杆菌A1血清型进行保护[17]。这也是国内外使用的Mh疫苗对牛的保护效果不稳定的主要原因。本试验从牛场5头死亡奶牛肺脏组织均分离出A6型Mh,经RAPD证实为同一株致病株,结合场内奶牛感染情况,可见其水平传播率极高,Reed-Muench法计算出其对小鼠的LD50为1.94×107CFU。2019年Andres-lasheras 等的研究指出,A6型Mh在BRD中的作用一直被低估,在临床BRD病例的病原统计中发现,下呼吸道A6型Mh检出率明显高于上呼吸道样品[18]。也就是说,若发生A6型Mh感染,仅用鼻拭子对牛进行上呼吸道采样不能分离主要致病菌。本试验对牛场分离的A6型Mh野生菌株进行分离鉴定,并将其16S rRNA基因序列上传NCBI,可为该菌的鉴定与治疗提供参考,也可为进一步的疫苗生产提供菌种资源。
本试验还对2020年Wynn等[10]建立的菌落表型目测鉴定法进行尝试,将分离的Mh鉴定为基因2型,具有引发BRD的潜力。据描述此法可准确鉴定91%的菌株,一些特征模棱两可的菌株还需借助基质辅助激光解析电离飞行时间质谱(MALDI-TOF MS)进行分析验证,此法可用于临床强致病力Mh株的快速筛查和粗略分离,值得其他兽医从业者参考。
