鸭源蛔虫分子生物学鉴定及临床病理分析
2022-02-08黄潇航彭佳佳李诗艺王诗晨李梦蕊李永霞贺金峪黄志坚殷光文
黄潇航 , 彭佳佳 , 张 龙 , 李诗艺 , 王诗晨 , 李梦蕊 ,李永霞 , 贺金峪 , 黄志坚 , 殷光文
(1.福建农林大学动物科学学院 蜂学学院 , 福建 福州 350002 ; 2.福建省动物药物工程实验室 , 福建 福州 350002)
我国水禽产业较为发达,但是球虫、蛔虫等寄生虫的感染影响了水禽的生产性能,造成了较为严重的经济损失,因此及时有效地确诊水禽寄生虫病的感染类型具有重要意义。动物蛔虫多具有较为相似的形态特征,依靠传统形态学方法较难进行判断,因此分子生物学技术的发展为快速鉴定蛔虫种类提供了新方法。鸭蛔虫的临床案例在国内报道较少,且尚未开展致病原相关研究。在已报道的临床鸭源蛔虫临床案例中,林琳等[1]通过形态学鉴定诊断了1例番鸭蛔虫病,通过虫卵、成虫形态学方法的比对判断为鸡蛔虫。而在江梅[2]报道的临床案例中,鸭蛔虫被认为主要是禽蛔虫,但主要还是依据形态学进行判断。本试验通过对1例送检至福建省畜禽疾病诊疗中心患有蛔虫病的番鸭进行剖检,观察其病理变化。通过苏木精-伊红(Hematoxylin-eosin,H.E.)染色法对番鸭肠道由于蛔虫寄生产生的肠道病变进行了观察。在形态学鉴定基础上,使用分子生物学技术,对采集的虫体进行DNA提取和PCR扩增鉴定,通过与数据库中蛔属线虫的遗传序列比对,基于18S rRNA遗传区间对鸭源蛔虫进行了分子生物学鉴定,为鸭蛔虫病的生物学分类提供了相关的借鉴和参考。
1 材料与方法
1.1 样品来源 用于剖检、制备病理切片研究的病变组织,鸭源蛔虫虫株均由福建省农业科学院畜禽疾病诊疗中心惠赠。
1.2 主要试剂和仪器 DNA提取试剂盒FastDNA SPIN Kit,购自美国MP Biomedicals公司;EasyTaqMix 聚合酶、EasyPure Quick Gel Extraction Kit,均购自北京全式金生物技术股份有限公司。Omega Fluor Plus 凝胶成像系统,美国 Aplegen 公司产品;Veriti 梯度 PCR 仪,美国Applied Biosystems公司产品;电泳仪,北京市六一仪器厂产品。
1.3 病理组织学观察 采集样品时记录鸭肠道剖检病变。取病变肠组织,固定于10%中性福尔马林缓冲液,经常规组织脱水、透明、包埋、切片,然后进行H.E.染色,显微镜下观察并记录病理变化。
1.4 病原形态学观察 使用体式显微镜对虫体进行形态学观察。
1.5 PCR扩增 将3条虫体编号为Y1~Y3,按FastDNA SPIN Kit试剂盒说明书所述方法,提取虫体基因组DNA。使用线虫通用引物[3](NEMF1:5′-CGCAAATTACCCACTCTC-3′;S3:5′-AGTCAAATTAAGCCGCAG-3′),通过PCR扩增18S rRNA基因片段。引物由福州尚亚生物公司合成。反应体系(25 μL):DNA模板2.0 μL,上、下游引物各1.0 μL,2×EasyTaqMix酶12.5 μL,ddH2O 8.5 μL。反应程序:94 ℃ 2 min;94 ℃ 20 s,55 ℃ 20 s,72 ℃ 1 min,共35个循环;72 ℃ 5 min。同时设ddH2O作为阴性对照,使用鸡蛔虫DNA作为阳性对照。通过胶回收纯化目的条带,送往福州铂尚生物公司进行测序。
1.6 系统进化分析 将测序得到的基因序列与NCBI中公布的相关基因序列进行对比分析,使用DNAMAN进行同源性比对,采用MEGA 7.0生物软件绘制邻近法(Neighbor-joining,NJ)序列系统发生树。
2 结果
2.1 病理组织学观察 病理切片观察结果显示,发生肠道蛔虫寄生的番鸭黏膜层肠绒毛排列不规则,大量肠绒毛脱落,周围可见大量脱落的上皮细胞,肠腔内可见大量坏死的细胞碎片;黏膜层肠腺数量丰富,排列紧密;肌层局部可见结缔组织增生,并伴有少量炎性细胞浸润(图1)。从病理损伤程度判断,鸭蛔虫的感染造成了鸭肠道严重机械性损伤。
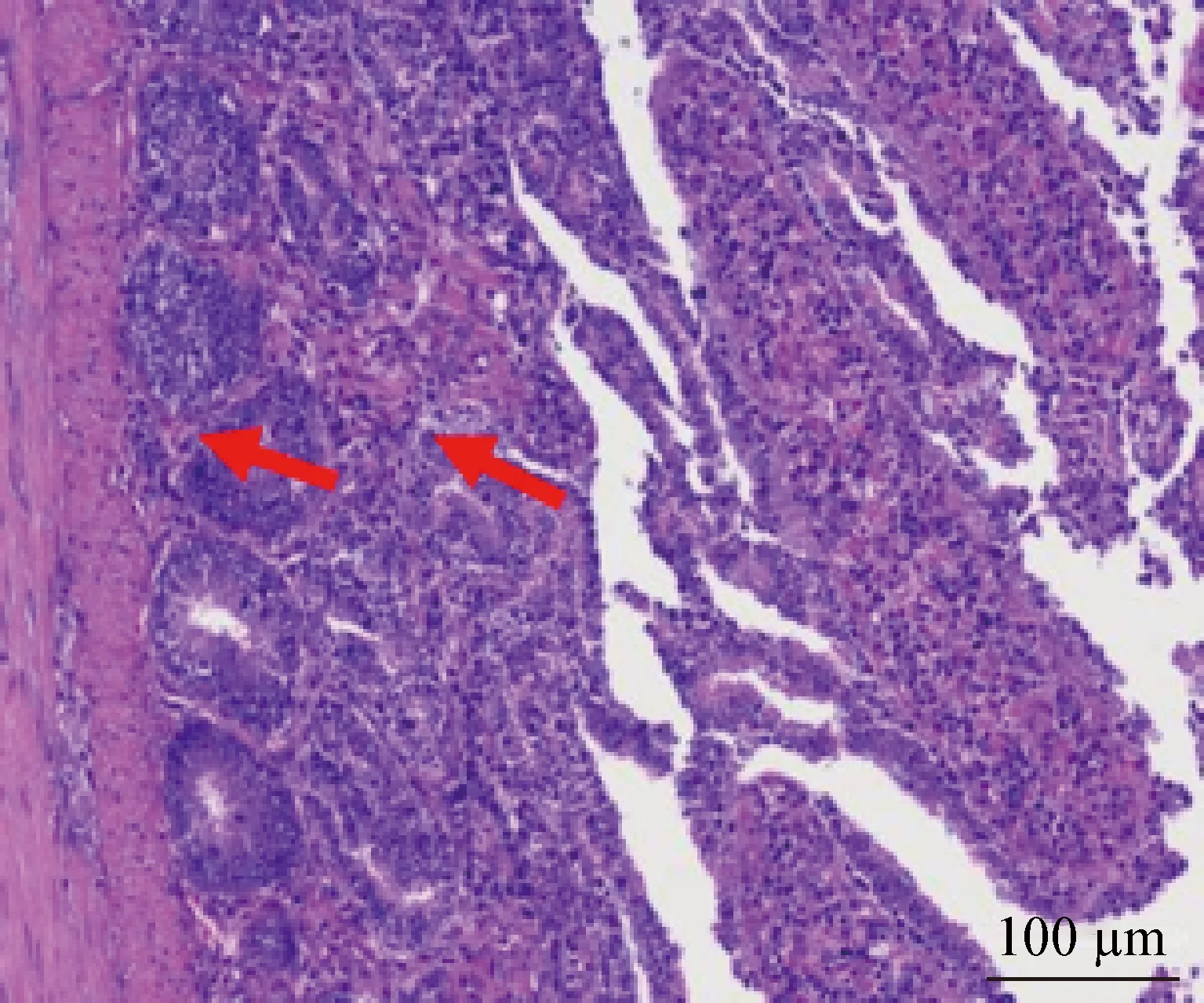
图1 番鸭小肠病理切片 (H.E.染色,200×)Fig.1 Histopathological section of the small intestine from Muscovy duck (H.E.staining,200×)箭头:炎性浸润,肠黏膜脱落Arrow:Inflammatory infiltration and intestinal mucosa abscission
2.2 病原形态学观察 在病鸭肠道内壁可以观察到细长的虫体,虫体颜色为褐黄色,肠道内容物中观察到大量虫体寄生(图2)。收集虫体后,通过体视显微镜观察怀疑虫体为蛔虫。
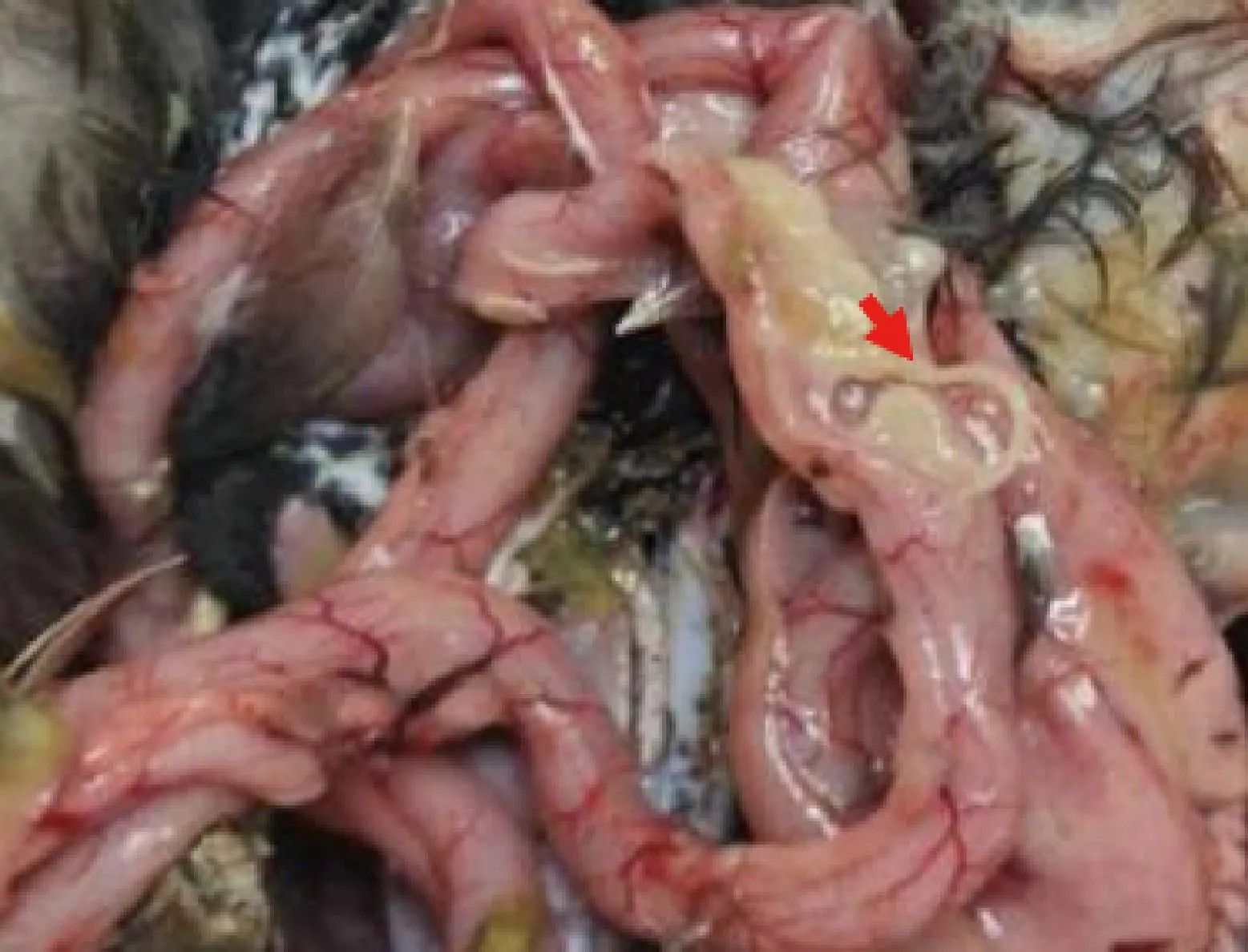
图2 番鸭小肠的虫体(箭头)Fig.2 Worms in the small intestine of Muscovy duck (Arrow)
2.3 PCR扩增及系统进化分析 扩增获得的目的片段大小在744 bp左右(图3)。切割阳性产物经过胶回收纯化后送往福州铂尚生物公司进行Sanger双向测序,获得Y1~Y3序列。3条鸭源蛔虫的18S rRNA序列经过DNAMAN片段修剪对齐,双向多序列比对后,片段同源性为100%。选取Y1作为代表株与NCBI数据库中弓首蛔虫、鸡蛔虫、鸡异刺线虫等虫种的18S rRNA序列进行同源性比对。结果如图4所示,扩增的Y1~Y3鸭源蛔虫18S rRNA片段种群遗传上与鸡蛔虫同源性在99%~100%,其次是鸡异刺线虫;Y1~Y3鸭源蛔虫在进化树分支上形成了独立的分支,与Ascaridiagalli(EF180058.1)序列聚合为一支,与弓首蛔虫属等形成了独立分支,且与鸡异刺线虫等分支可信度超过50,置信度较高。结合形态学鉴定和序列生物同源性分析,本试验分离自鸭肠道的蛔虫属于Ascaridiagalli。
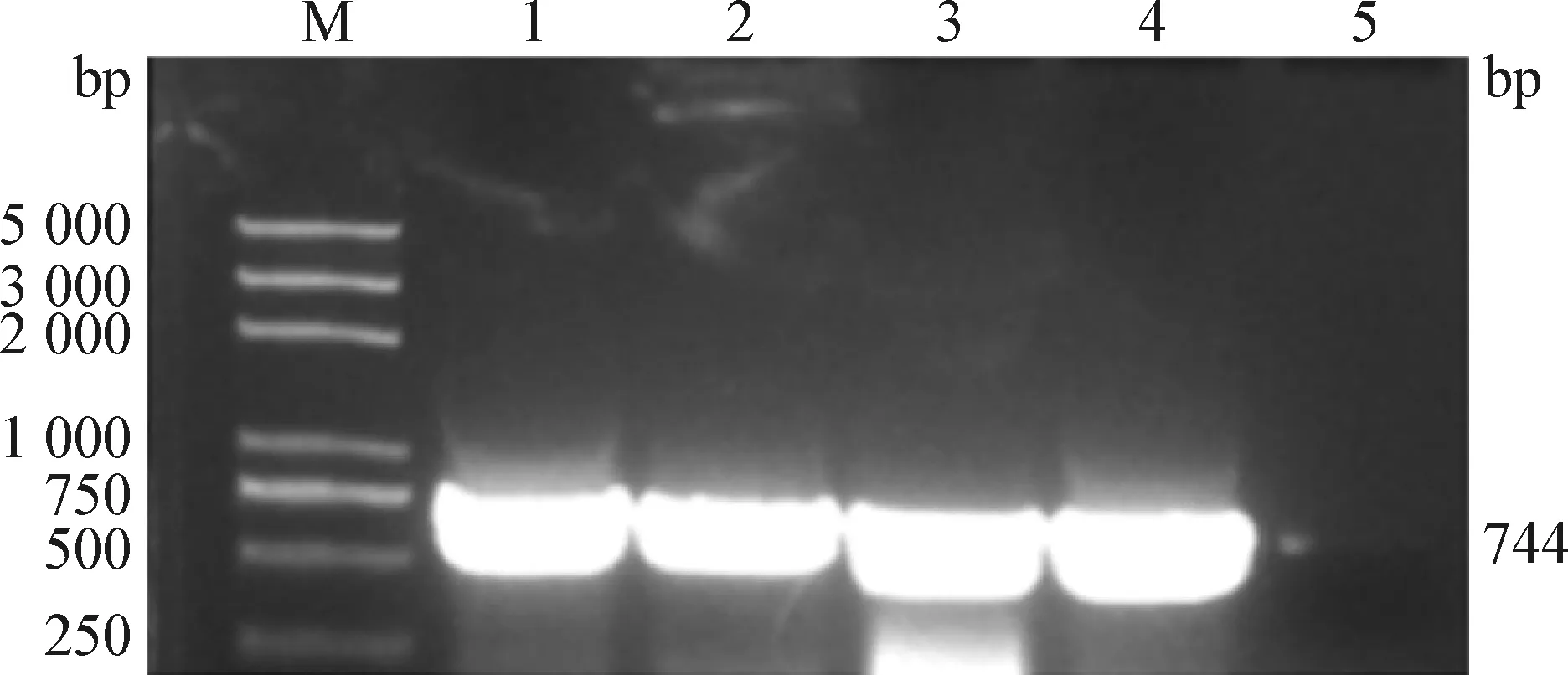
图3 鸭源蛔虫18S rRNA的 PCR扩增Fig.3 PCR amplification of 18S rRNA gene from duck-source AscarisM:2K plus DNA相对分子质量标准; 1~3:Y1~Y3鸭源蛔虫18S rRNA基因片段; 4:阳性对照; 5:阴性对照M:2K plus DNA Marker; 1-3:18S rRNA gene fragment of Y1-Y3 strains; 4:Positive control; 5:Negative control

图4 邻近法进化树Fig.4 Phylogenetic tree by Neighbor-joining method▲:鸭源蛔虫福建株样本▲:Fujian strains of duck-source Ascaris
3 讨论
蛔虫是一种演化历史时间较长的寄生虫,种类繁多。我国畜禽养殖业中较常见的蛔虫种类为鸡蛔虫、猪蛔虫、鸽蛔虫等,在临床上多以造成动物肠道损伤为主,寄生数量较多时会导致动物虚弱甚至死亡。从本试验病理组织学观察结果来看,蛔虫的感染寄生造成番鸭肠黏膜损伤、炎性反应,造成肠道机械性损伤,表明鸭源蛔虫对禽肠道具有较强的致病性。
符敖齐等[4]根据形态学观察报道了家鹅感染鸡蛔虫的临床案例,李欣等[5]采用分子生物学方法通过对核糖体间隔转录区(Internal transcribed spacer,ITS)的测定分析,认为分离自鹅肠道的蛔虫是有别于鸡蛔虫的新种蛔虫——鹅蛔虫,这也提示了在现有水禽临床案例中,基于传统形态学归类的蛔虫分类可能由于分子生物学介入而有了更多新种发现的可能性。有关鸡蛔虫的分子生物学研究、临床防控等已经有较多报道[6-11],但是关于鸭的蛔目线虫感染,目前的报道较少,在2020年de Carvalho等[12]报道了异尖线虫在巴西番鸭的寄生。
国内对于鸭源蛔虫的分子生物学研究鲜有报道,诊断也多数停留在了形态学鉴定上。本试验借助分子生物学技术对鸭源蛔虫进行了分子生物学鉴定,从18S rRNA的基因同源性分析,本试验中的鸭源蛔虫属于鸡蛔虫,这进一步佐证了早期临床研究中对感染鸭蛔虫的种类为鸡蛔虫的观点[1],为防控鸭群蛔虫病提供了分子生物学上的相关参考。本试验中鸡蛔虫在鸭蛔虫肠道中的感染,可能与鸭摄入鸡蛔虫的感染性虫卵有关。因此,在临床养殖中鸭群不应与鸡等家禽混养,且做好环境消毒,定期使用阿苯达唑、左旋咪唑等驱虫药物能够起到防控效果。
