GRP78在伪狂犬病病毒感染过程中的作用研究
2022-02-04薛晓暖郑小惠辛航阔谢青青祁保民
薛晓暖,郑小惠,辛航阔,谢青青,刘 坤,祁保民,朱 婷
(福建农林大学动物科学学院/蜂学学院福建省畜禽病原感染与免疫学重点实验室,福建 福州 350002)
伪狂犬病病毒(Pseudorabies virus,PRV)是疱疹病毒科、α-疱疹病毒亚科的成员。PRV 可以感染多种哺乳动物,猪是PRV 的唯一天然宿主,病毒通过口腔或者鼻腔感染后进入宿主上呼吸道内复制,然后通过神经末梢侵入外周神经系统,并在其内建立潜伏感染[1-2]。PRV传染性极强,受感染猪的分泌物和排泄物中存在大量的病毒,主要通过直接接触传播,但也可以通过空气、水和受污染的物品传播,猪伪狂犬病的暴发难以控制,给养猪业造成严重经济损失[3-4]。
葡萄糖调节蛋白78(Glucose-regulated protein,78 ku,GRP78)是真核生物热休克蛋白70(HSP70)的家族成员之一,作为一种分子伴侣普遍存在于内质网中以促进蛋白的正确折叠;除此之外,GRP78在调控内质网应激、维持内质网的钙稳态,抗凋亡以及抗肿瘤的发生和发展过程中发挥至关重要的作用[5]。研究发现,GRP78 除了定位在内质网中,也存在于多种细胞的细胞膜,并且在压力刺激或者错误折叠蛋白积累的刺激下,GRP78可以逃离内质网的束缚而转移到细胞质和细胞膜,细胞膜上的GRP78被称为CS-GRP78[6],CS-GRP78 的显著增加是许多侵袭性癌症的特征,如乳腺癌、卵巢癌、胰腺癌和结肠癌[7]。此外,CS-GRP78 还可以促进多种病原侵入宿主细胞,相关研究发现,病毒或者细菌的感染可以增加CS-GRP78 的表达,而降低CS-GRP78 的表达可能会阻止病原颗粒的内化,进而阻止其侵入宿主细胞[8]。本研究以GRP78 为研究对象,检测PRV 感染对GRP78 蛋白的表达和亚细胞定位的影响,通过封闭细胞膜上的GRP78 表位、以及过表达和下调细胞内GRP78 的表达,研究其对PRV 复制的影响,为揭示PRV 的感染和发病机制奠定基础。
1 材料与方法
1.1 主要实验材料PK-15 细胞、PRV Min-A 株均由本实验室保存。DMEM 培养基、胎牛血清、生物素sulfo-NHS-SS-biotin、Lipofectamine RNAiMAX 和兔源PRV 多克隆抗体(pAb)均购自Thermo Fisher 公司;streptavidin 磁珠购自苏州海狸生物医学工程有限公司;兔源GRP78 pAb、兔源ATP1A1 pAb购自protein⁃tech公司;鼠源GRP78单克隆抗体(MAb)购自Santacruz生物技术公司;鼠源β-actin MAb、鼠源GAPDH MAb、HRP标记的山羊抗兔IgG和HRP标记的山羊抗鼠IgG、FITC标记的山羊抗兔IgG 和AF488 标记的山羊抗鼠IgG 均购自北京全式金生物技术有限公司;兔IgG、4%的多聚甲醛溶液、DAPI 染色液和抗荧光淬灭封片液均购自上海碧云天生物技术有限公司。
1.2 PRV 感染的PK-15 细胞内GRP78 蛋白表达检测采用MOI 0.1 的PRV 感染PK-15 细胞,分别于37 ℃,5% CO2培养6 h、12 h、24 h 和30 h 时收集细胞,利用RIPA裂解液裂解并分别提取细胞总蛋白,加入2×Loading Buffer煮沸变性后,分别以兔GRP78 pAb(1∶1 000)、兔源ATP1A1 pAb(1∶1 000)为一抗,山羊抗兔IgG-HRP(1∶100 000)为二抗,经western blot 检测PRV 感染情况和GRP78 蛋白的表达水平。试验设置添加PBS 的PK-15 细胞为对照组,以β-actin 为内参。
1.3 PRV 感染的PK-15 细胞中GRP78 蛋白的亚细胞定位及其细胞膜蛋白中GRP78 蛋白含量检测收集1.2 中PRV(MOI 0.1)感染24 h后的PK-15细胞和对照组细胞,分别用4%的多聚甲醛溶液室温固定细胞30 min,以兔GRP78 pAb(1∶100)为一抗,山羊抗兔IgG-FITC(1∶100)为二抗,DAPI 染色后封片,使用激光共聚焦显微镜观察GRP78 在细胞中的定位情况。
同时,取感染24 h 后的PK-15 细胞和对照组细胞,分别加入1 mg/mL 的sulfo-NHS-SS-biotin,经室温孵育30 min 后裂解细胞,离心收集上清,向上清中加入streptavidin 磁珠,4 ℃孵育12 h 后离心收集磁珠,向磁珠中加入2×Loading Buffer煮沸后,分别以兔源GRP78 pAb(1∶1 000)、兔源PRV pAb(1∶1 000)、兔源ATP1A1 pAb(1∶1 000)为一抗,以山羊抗兔IgGHRP(1∶100 000)为二抗,通过western blot 检测细胞膜上GRP78 蛋白的含量,试验设ATP1A1 作为细胞膜蛋白内参。
1.4 兔源GRP78 pAb 处理PK-15 细胞后PRV 滴度的检测将不同浓度的兔源GRP78 pAb(50 μg/mL 和100 μg/mL)分别与培养12 h 后的PK-15 细胞孵育1 h 后,对照组细胞则分别使用不同浓度的兔IgG(50 μg/mL 和100 μg/mL)孵育1 h 后,均利用PRV(MOI 0.1)感染24 h 后收集上清, 10 倍倍比稀释(102~105)后加入PK-15 细胞孵育1 h,加入1%的甲基纤维素,继续培养3 d 后采用空斑计数测定PRV的病毒滴度[9]。
1.5 GRP78与PRV在PK-15细胞中共定位的间接免疫荧光试验(IFA)取1.2 中PRV(MOI 0.1)感染24 h后的PK-15 细胞和对照组细胞,分别用4%的多聚甲醛溶液室温固定细胞30 min,分别不经或者经2%的Triton X-100 透化后,以鼠GRP78 MAb(1∶100)和兔PRV pAb(1∶100)的混合液为一抗,山羊抗鼠IgG-AF488(1∶100)和山羊抗兔IgG-FITC(1∶100)的混合液为二抗,DAPI 染色后封片,使用激光共聚焦显微镜观察GRP78 与PRV 在细胞膜和细胞内的共定位情况。
1.6 下调GRP78 蛋白的表达后PK-15 细胞中PRV复制水平的检测根据猪源GRP78 基因序列(No.407060),由吉玛基因股份有限公司设计合成特异性的干扰RNA 分子siGRP78:GGCAGCUGCUAUUG CUUAUTT/AUAAGCAAUAGCAGCUGCCTT,以 及1 条无关干扰分子siNC:UUCUCCGAACGUGUCACGUTT/ACGUGACACGUUCGGAGAATT, 采 用Lipofectamine RNAiMAX 转染试剂分别将siGRP78 和siNC 转染PK-15 细胞,37 ℃,5% CO2培养48 h 后感染MOI 0.1 的PRV,继续培养24 h 后分别收集细胞沉淀和上清,细胞沉淀采用RIPA 裂解液裂解后,加入2×Loading Buffer 煮沸,分别以兔源GRP78 pAb(1∶1 000)、兔源PRV pAb(1∶1 000)为一抗,羊抗兔HRP-IgG 为二抗,通过western blot 检测GRP78 蛋白的表达水平和PRV 的增殖水平,实验以β-actin 为内参。另外将收集的上清液分别10倍倍比稀释(102~105)后加入PK-15细胞孵育1 h,加入1%的甲基纤维素,继续培养3 d后采用空斑计数试验测定PRV的病毒滴度[9]。
1.7 过表达GRP78 蛋白的表达后PK-15 细胞中PRV 复制水平的检测使用Lipofectamine 2000 将本实验室前期制备的重组质粒pCMV-GRP78 和空载体质粒pCMV-FLAG 分别转染PK-15 细胞,37 ℃、5%CO2培养48 h后,采用MOI 0.1 PRV感染细胞,继续培养24 h后分别收集细胞沉淀和上清,参照1.6中western blot 方法检测GRP78 蛋白的表达水平和PRV 的增殖水平,通过空斑计数试验测定PRV 的病毒滴度[9]。
2 结 果
2.1 PRV 感染对GRP78 蛋白表达影响的检测结果分别收集PRV(MOI 0.1)感染6 h、12 h、24 h 和30 h的PK-15细胞,通过western blot 检测PRV感染情况及GRP78 蛋白表达的变化,结果显示,PRV 感染12 h 后可检测到PRV蛋白的表达,表明PRV已侵入PK-15细胞并增殖;另外,与对照组相比,PRV 感染PK-15细胞后各时间点GRP78 蛋白的表达水平均无显著变化(图1)。表明PRV 感染不影响GRP78 蛋白的表达。
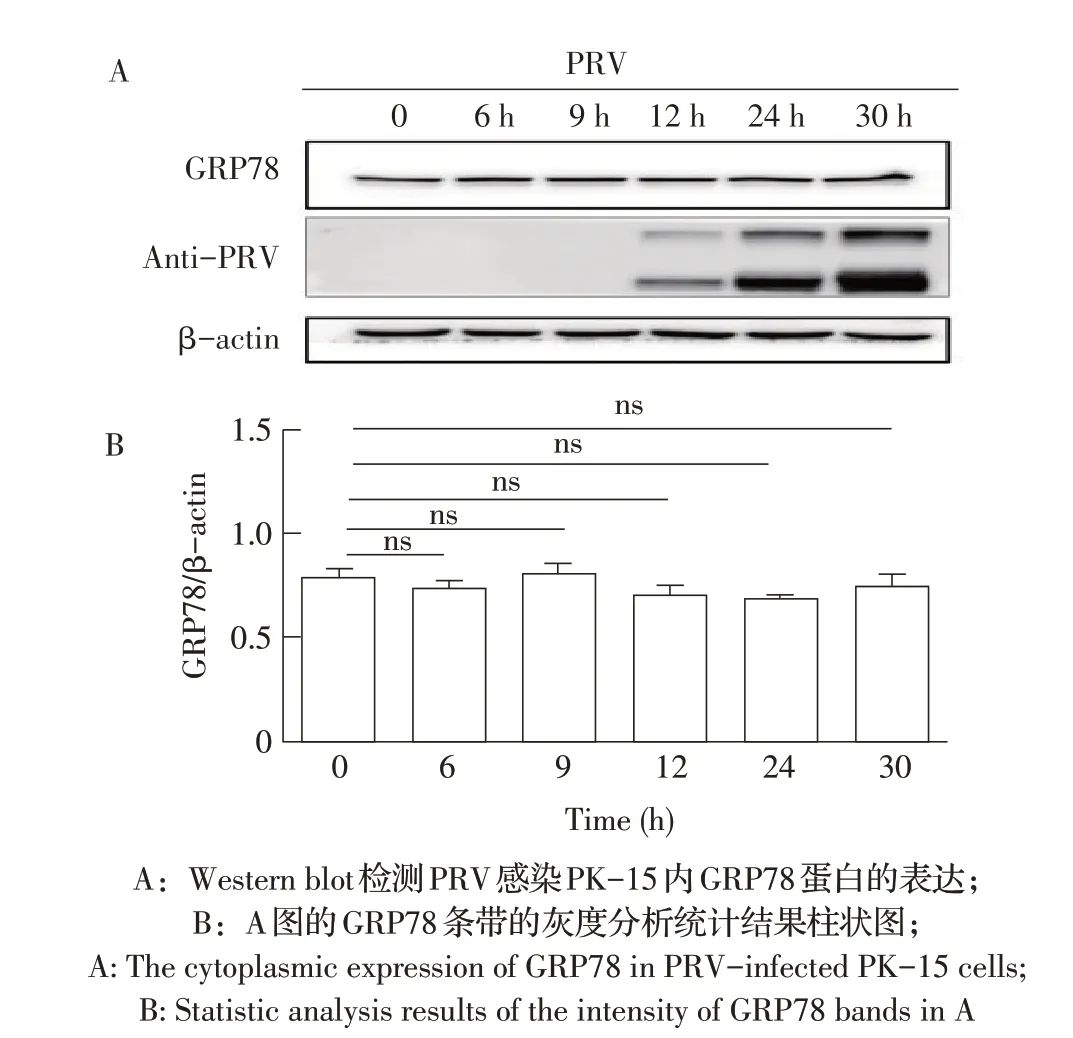
图1 PRV感染对GRP78蛋白表达影响的检测结果Fig.1 Effect of PRV infection on GRP78 protein expression
2.2 PRV 感染的PK-15 细胞内GRP78 亚细胞定位及其细胞膜上GRP78 蛋白含量的检测结果研究表明,在压力刺激、病原微生物感染或者错误折叠蛋白积累的刺激下,细胞内的GRP78 可以转移到细胞膜上,从而发挥重要作用[10]。本研究通过激光共聚焦显微镜观察PRV 感染24 h 后PK-15 细胞中GRP78的定位,结果显示, PRV 感染PK-15 细胞后细胞膜出现明显的绿色荧光,且荧光强度明显强于PBS 对照组(图2A)。进一步通过生物素标记细胞膜上所有的蛋白,然后用可以与生物素相结合的streptavidin磁珠分离细胞膜蛋白,再用GRP78 的特异性抗体检测细胞膜上的GRP78 蛋白,结果显示,与PBS 对照组相比,PRV 感染细胞的细胞膜上的GRP78 蛋白水平显著增加(P<0.05,图2B,图2C)。以上结果表明PRV 感染可以增加细胞膜上GRP78 的蛋白含量。
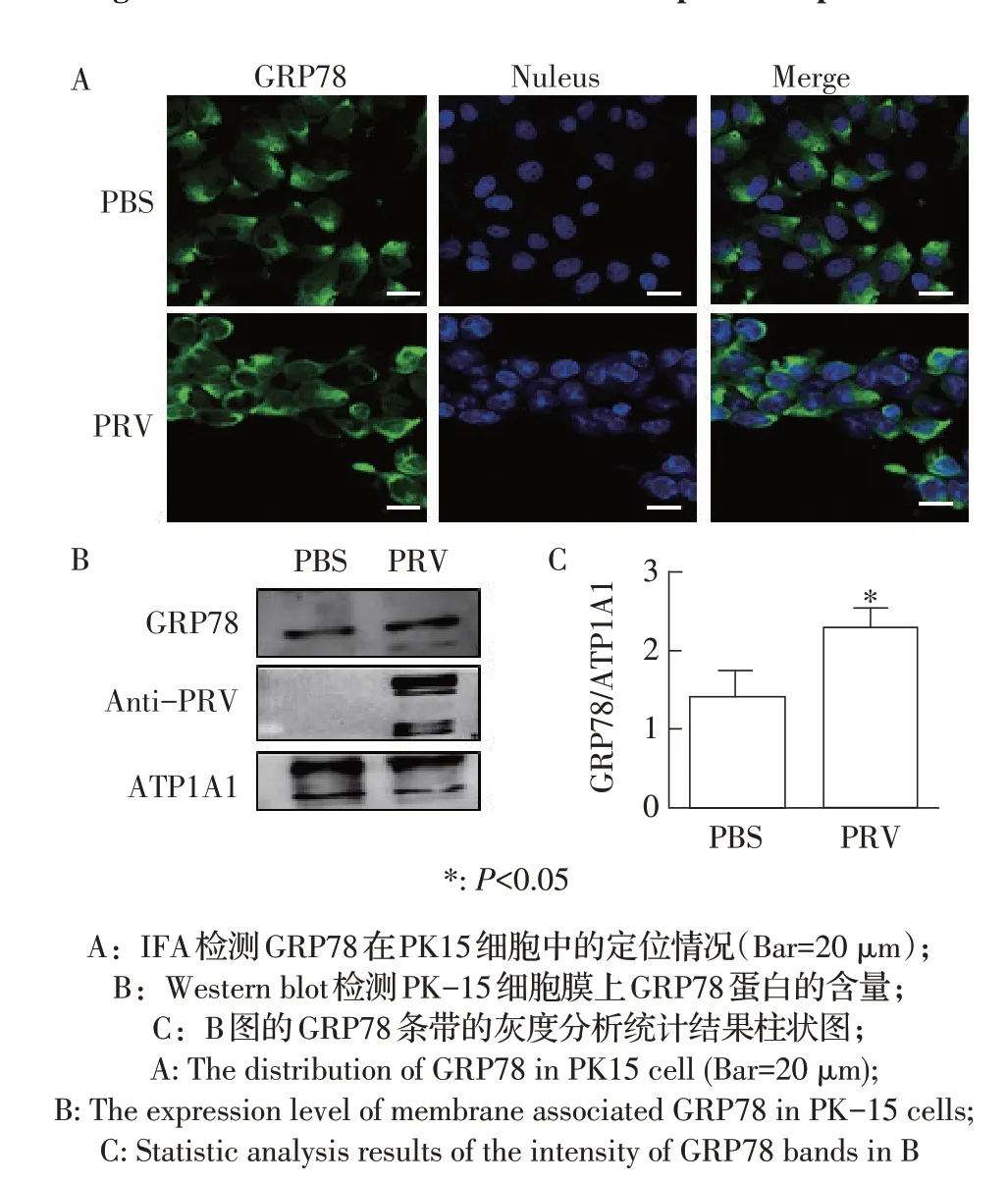
图2 PRV感染对GRP78在细胞膜分布影响的检测结果Fig.2 Effect of PRV infection on the distribution of GRP78 in cell membrane
2.3 GRP78 pAb 处理PK-15 细胞后对PRV 复制影响的检测结果PK-15 细胞分别与50 μg 和100 μg 的兔源GRP78 pAb 共孵育后感染PRV,通过空斑试验检测细胞培养上清中PRV 滴度,结果显示,与兔IgG 对照组相比,50 μg 和100 μg 的GRP78 pAb 孵育细胞后再感染PRV 组的病毒滴度均未见明显降低(图3)。表明GRP78 并不是PRV 侵入宿主细胞的关键因子,但可能参与PRV 从PK-15 细胞内的释放。
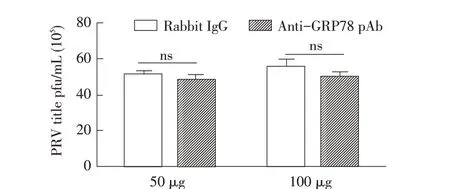
图3 GRP78 pAb处理PK-15细胞后对PRV复制影响的检测结果Fig.3 Influence of anti-GRP78 antibody on the of PRV in PK-15 cells
2.4 GRP78 与PRV 在PK-15 细胞中共定位的检测结果PRV 感染PK-15 细胞24 h 后,通过IFA 分别检测GRP78 与PRV 在细胞膜和细胞内的共定位情况,结果显示,未经Triton X-100 透化的细胞经相应IFA检测后,细胞膜表面GRP78 蛋白的红色荧光与PRV蛋白的绿色荧光无共定位(图4A);经Triton X-100透化的细胞经相应IFA 检测,结果显示,细胞内GRP78 蛋白的红色荧光与PRV 蛋白的绿色荧光有明显的共定位现象(图4B)。表明GRP78 与PRV 在细胞膜无共定位,但是二者在细胞质中有共定位。
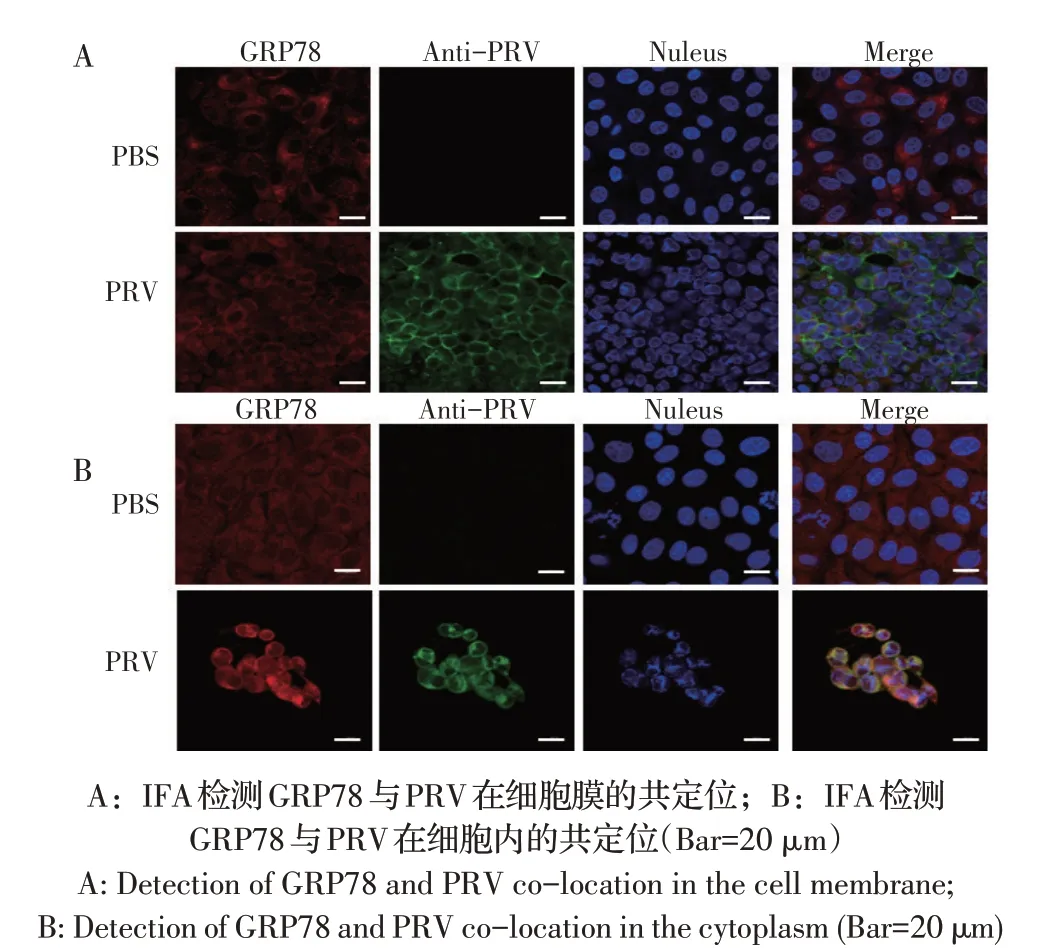
图4 GRP78与PRV在PK-15细胞中共定位的检测结果Fig.4 Detection of GRP78 and PRV co-localization in PK-15 cells
2.5 下调GRP78 蛋白的表达对PRV 复制影响的检测利用western blot检测siGRP78干扰后的PK-15细胞,结果显示,与siNC 对照组相比,siGRP78 干扰组GRP78 蛋白的表达水平显著降低(图5A、图5C),且siGRP78 干扰组的PRV 蛋白水平显著低于siNC 对照组(P<0.05,图5B、图5D)。将收集的细胞上清进行空斑试验以检测PRV的病毒滴度,结果显示,与siNC对照组相比,siGRP78 干扰组PRV 的病毒滴度显著降低(P<0.05,图5E)。以上结果表明,下调GRP78 蛋白的表达可显著降低PRV 的释放。
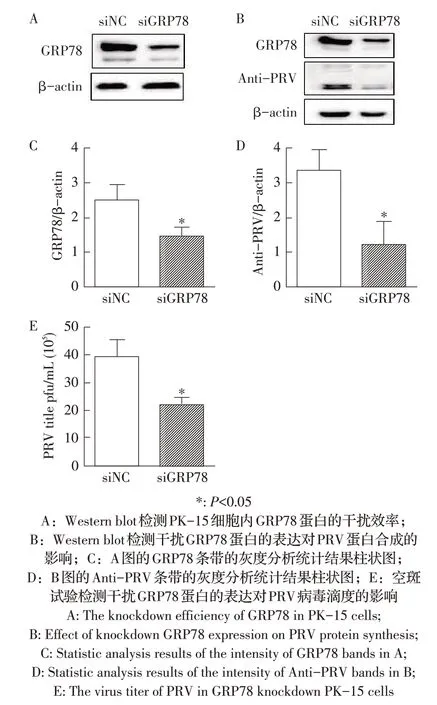
图5 敲低GRP78的表达对PRV复制影响的检测结果Fig.5 Effect of knockdown GRP78 expression on PRV replication
2.6 过表达GRP78 蛋白的表达对PRV 复制影响的检测利用western blot检测过表达GRP78对PRV复制的影响,结果显示,与转染空载体pCMV-FLAG相比,转染pCMV-GRP78质粒的细胞中GRP78蛋白的表过水平显著增加(P<0.05,图6A、图6C),而转染pCMVGRP78 质粒的细胞与空载体pCMV-FLAG 转染组相比,PRV蛋白水平未见明显差异(图6B、图6D)。将收集的细胞培养液进行空斑试验,以检测PRV 的病毒滴度,结果显示,转染pCMV-GRP78质粒的细胞培养液中的病毒滴度显著高于空载体pCMV-FLAG 转染组(P<0.05,图6E)。以上结果表明,过表达GRP78 蛋白可以显著增加细胞培养液中PRV 的滴度。
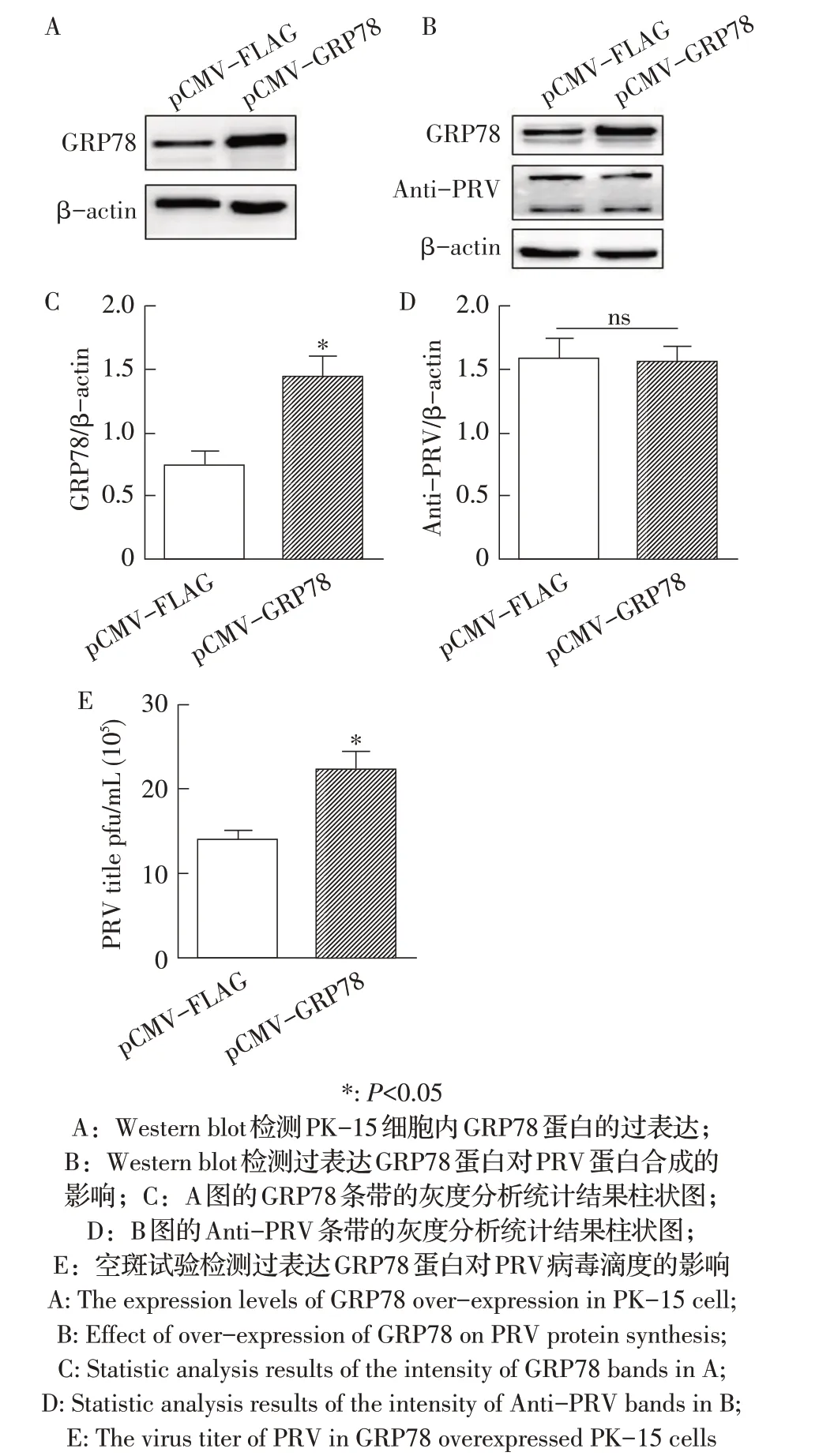
图6 过表达GRP78对PRV复制影响的检测结果Fig.6 Effect of overexpression of GRP78 on PRV replication
3 讨 论
GRP78 是热休克蛋白家族HSPA5 的成员,主要存在于真核细胞的内质网膜上,负责调控非折叠蛋白反应,以促进蛋白的正确折叠或者促进错误折叠蛋白通过内质网相关蛋白降解(ERAD)途径被清除[11]。在应激条件下,GRP78 在细胞膜上大量表达,与细胞表面的大量配体或者其他蛋白结合,在信号传导、细胞增殖和迁移、细胞凋亡、炎症反应等方面发挥重要作用。同时,细胞表面的GRP78 也成为多种病原(细菌、真菌和病毒)进入细胞的工具[10,12]。本研究发现,PRV 感染PK-15 细胞并不影响GRP78 蛋白的表达,但可以增加细胞膜上GRP78 蛋白的含量,提示GRP78向细胞膜的转移可能与病毒的侵入、复制或者释放有关。研究发现,GRP78广泛分布在N2a 细胞、小鼠原代神经元细胞和人上皮细胞Hun-7 的细胞膜上,并且可以与乙型脑炎病毒(JEV)的囊膜蛋白结构域Ⅲ结合参与病毒的感染[5]。中东呼吸综合征病毒(MERS-CoV)感染可以增加细胞膜上的GRP78 蛋白水平,这有助于病毒的侵入、吸附和复制[13];在鸭坦布苏病毒(TMUV)感染过程中,GRP78作为细胞的受体介导病毒感染,利用抗体阻断细胞膜上的GRP78 蛋白表位可以显著地阻止TMUV 的感染[14]。GRP78还作为登革热病毒2 型(DFV-2)的受体,使用抗体封闭细胞表面的GRP78 蛋白表位,可以阻止该病毒的感染[15]。但本研究进一步采用兔多克隆抗体封闭PK-15 细胞表面的GRP78 蛋白表位,检测其对PRV 复制的影响,结果显示,封闭细胞表面的GRP78 蛋白表位并未影响PRV 的感染,表明GRP78并不是PRV 侵入宿主细胞过程中的关键因子。
除了介导病毒侵入,GRP78 在病毒蛋白的合成、成熟和释放过程中也发挥重要的作用。在病毒复制过程中,GRP78 的缺失可能导致病毒蛋白合成减少或病毒蛋白的错误折叠,导致出芽或未成熟的病毒粒子受损,传染性减弱。其次,GRP78 还可以通过维持内质网稳态促进病毒各组分的组装,为病毒的成熟提供有利的环境[16]。寨卡病毒(ZIKV)感染可以增加GRP78 蛋白的表达,并且ZIKV 囊膜E 蛋白可以与GRP78 结合,缺失GRP78 的表达能够明显降低病毒蛋白的翻译和病毒粒子的释放[17]。GRP78 对人巨细胞病毒(HCMV)的组装和释放也是必需的,抑制GRP78 的功能能够显著降低感染性病毒粒子的释放,导致病毒核衣壳滞留在细胞核或核膜外[18]。此外,GRP78 还可与病毒颗粒结合,从而增强病毒的感染性,研究发现,GRP78 存在于日本脑炎病毒(JEV)的病毒颗粒中,而缺乏GRP78 的成熟病毒颗粒的感染性显著降低[19]。而本研究发现,GRP78 与PRV 在细胞膜无共定位,但是二者在细胞质内有共定位现象;此外,本研究利用RNA 干扰技术下调PK-15 细胞内GRP78 蛋白的表达能够显著降低细胞内PRV 蛋白的合成和细胞上清中的病毒滴度,但PK-15 细胞内过表达GRP78 虽然能够增加细胞培养液上清中的病毒滴度,但并不影响细胞内PRV 蛋白的合成。GRP78 是一种重要的内质网分子伴侣,参与维持内质网的稳态和蛋白翻译[11],因此推测上述结果可能是由于细胞内现有的GRP78 足以维持病毒蛋白的合成。 此外,过表达和下调GRP78 的表达均能够影响细胞培养液中的病毒滴度,提示GRP78 可能参与病毒向细胞外的释放或者介导感染性病毒粒子在细胞间的传播。 研究表明,在HCMV 和JEV 感染过程中,阻止GRP78 的表达并不影响细胞内病毒蛋白的合成,但能显著降低感染细胞培养液中病毒滴度[18-19]。这和本研究结果一致。此外,近期研究发现GRP78 与乙肝病毒(HBV)衣壳蛋白preS1 相互作用,正向调节病毒粒子的释放[20]。因此,结合上述研究报道和本研究结果推测,GRP78 是PRV 感染细胞的重要宿主因子,参与PRV从宿主细胞中释放到胞外,但是否影响病毒的包装、病毒粒子的成熟等过程,这些具体的分子机制还需要后续进一步的研究。
本研究初步探究了GRP78在PRV感染过程中的作用,证实GRP78作为一种重要的宿主因子正调控PRV的释放,为进一步研究PRV的感染机制奠定了研究基础。
