猪链球菌和副猪嗜血杆菌双重TaqMan荧光定量PCR检测方法的建立与应用
2022-02-04靳曼玉高树基李金朋张小玲董发明
靳曼玉,高树基,李金朋,张小玲,丁 轲,董发明,汪 洋
(1.河南科技大学动物科技学院,河南 洛阳 471000;2.洛阳市畜禽分子病原与免疫学重点实验室,河南 洛阳 471003)
猪链球菌(Streptococcus suis,SS)能引发猪脑膜炎、关节炎、心内膜炎、肺炎等多种疾病,还可感染人,是一种重要的人畜共患病原体[1]。近年来,在中国SS 引发的疾病发病率呈逐年上升趋势,该病已成为导致养猪业经济损失的主要原因之一[2-3]。副猪嗜血杆菌(Haemophilus parasuis,HPS)是猪上呼吸道的一种共栖菌,可引起以浆液性或纤维性多发性浆膜炎、关节炎以及脑膜炎为特征的格拉泽氏病(Glässer's disease),严重时会致死[4-5]。随着近几年规模化密集养猪模式的高速发展以及国内猪群的频繁流动,呼吸系统疾病成为现代养猪生产面临的最严重的问题之一。SS和HPS作为两种重要的猪呼吸道常在菌和致病菌,在临床上常发生混合感染,引起的临床症状和病理变化也很难区分,猪呼吸道疾病的发病率上升、病情加重,同时也增加了疾病的复杂性和诊断难度[6-8]。因此,建立一种快速、灵敏、特异性强的检测方法对准确诊断SS和HPS的感染具有重要意义。
随着分子生物学的发展,PCR 方法在检测中的应用越来越广泛,而TaqMan 荧光定量PCR 是新一代的检测方法,该方法检测样品的同时还可以对病原基因准确定量,在病原检测和分析方面具有广阔的应用前景[9]。因此,本研究根据SSgdh基因和HPS 16S rRNA基因保守序列分别设计1 对特异性引物和探针,建立了能够同时检测SS 和HPS 的双重TaqMan 荧光定量PCR方法,为SS和HPS的临床检测提供了技术手段。
1 材料与方法
1.1 菌株和临床样品SS 野生型强毒菌株HA9801(血清型2 型)由陆承平教授惠赠;HPS 野生型强毒菌株H5L3(血清型5 型)由赵战勤教授惠赠;大肠杆菌DH5α 感受态细胞、猪支气管败血波氏杆菌(Bor⁃detella bronchiseptica,Bb)、金黄色葡萄球菌(Staphy⁃lococcus aureus,SA)、猪胸膜肺炎放线杆菌(Actino⁃bacillus pleuropneumoniae,APP)、无乳链球菌(Strep⁃tococcus agalactiae,GBS)等均由河南科技大学畜禽分子病原与免疫学重点实验室分离并保存。临床样品来自河南省部分地区养殖场疑似感染SS 和/或HPS的猪肺部组织样品共54 份。
1.2 主要试剂DL2000 DNA Marker、pMD19-T 载体、2×PCR Master Mix 均购自宝生物工程(大连)有限公司;Bestar®qPCR Master Mix(TaqMan Probe)购自上海星汉生物科技有限公司;UNIQ-10 柱式微量琼脂糖凝胶DNA 回收试剂盒(B511139-0050)、SanPrep柱式质粒小量抽提试剂盒(B518191-0050)购自生工生物工程(上海)股份有限公司;细菌基因组DNA提取试剂盒(DP304-02)购自天根生化科技(北京)有限公司。
1.3 引物和探针的设计与合成根据NCBI中登录的SS基因序列(AY853916.1)和HPS 基因序列(AB004032.1),利用Primer Express 3.0 软件分别对SSgdh基因和HPS 16S rRNA 基因的全长和特异片段设计引物和探针(表1),并由上海生工生物工程技术服务有限公司合成,利用ddH2O 将其浓度的稀释为10 μmol/L 后,-20 ℃保存备用。
1.4 重组质粒标准品的构建与鉴定利用细菌基因组DNA 提取试剂盒分别提取SS 和HPS 菌株的基因组DNA,并将其作为模板,采用表1 中的相应全长基因引物PCR 扩增2 种细菌的目的基因,将其分别与pMD19-T 载体连接,再转化至大肠杆菌DH5α 感受态细胞后并经菌液PCR 鉴定,鉴定为阳性的菌液提取重组质粒由生工生物工程(上海)股份有限公司测序鉴定无误后,作为相应细菌的质粒标准品。利用超微量分光光度计分别测定重组质粒的浓度,按照以下公式计算拷贝数:拷贝数(拷贝/μL)=(质粒浓度×10-9×6.02×1023)/(660 道尔顿/碱基×碱基数),并分别命名为标准品pMD-gdh和pMD-16S rRNA。

表1 TaqMan荧光定量PCR引物和探针序列及常规PCR引物序列Table 1 TaqMan real-time PCR primers and probes sequences and conventional PCR primers sequences
1.5 双重TaqMan荧光定量PCR反应体系和条件的优化采用20 μL反应体系,其中2×Bestar®qPCR Master Mix 10 μL,引物gdh-QF/R和16S rRNA-QF/R各0.4 μL,探针gdh-QF/R 和16S rRNA-QF/R 各0.2 μL,以相同稀释度pMD-gdh和pMD-16S rRNA 重组质粒标准品各2 μL混匀后作为模板,最后加ddH2O补至20 μL。反应条件为95 ℃2 min;95 ℃10 s、60 ℃30 s,40 个循环。然后采用方阵法分别对引物的浓度(0.15 μmol/L、0.2 μmol/L、0.25 μmol/L、0.3 μmol/L、0.35 μmol/L、0.4 μmol/L、0.45 μmol/L)、探针浓度(0.05 μmol/L、0.1 μmol/L、0.15 μmol/L、0.20 μmol/L、0.25 μmol/L、0.3 μmol/L、0.35 μmol/L)、退火温度(49 ℃~61 ℃)、循环数(30次、35 次、40 次)进行优化,筛选最佳的反应体系和条件。
1.6 标准曲线的建立将重组质粒标准品pMD-gdh和pMD-16S rRNA分别10倍倍比稀释,选取103~107倍稀释质粒分别作为模板,采用优化好的反应体系和条件进行TaqMan 荧光定量PCR 扩增,最后以质粒标准品浓度的对数值为x 轴,Cq 值为y 轴,绘制标准曲线,同时设置ddH2O 为阴性对照。
1.7 特异性试验利用细菌基因组DNA提取试剂盒提取SS、HPS、Bb、SA、APP、GBS 的基因组DNA 作为模板,按照优化好的反应体系和条件进行双重TaqMan荧光定量PCR 扩增,以评估该方法的特异性。
1.8 敏感性试验将重组质粒标准品pMD-gdh和pMD-16S rRNA分别10倍倍比(100~104)稀释后,同稀释度两种重组质粒以相同体积混合后作为模板;另外,将过夜培养的SS和HPS菌液,分别10倍比稀释后进行平板计数,根据菌液浓度,将两种细菌浓度调整至1×108cfu/mL,然后10 倍倍比稀释(105cfu/μL~101cfu/μL),同浓度两种菌液以相同体积混合后作为模板。按照优化好的反应体系和条件分别对上述重组质粒标准品和菌液进行双重TaqMan 荧光定量PCR扩增。同时,以重组质粒标准品稀释液作为模板进行常规PCR 扩增(常规PCR 反应体系:总体系20 μL,2×PCR Master Mix 10 μL、引物SS-gdh-F/R和HPS-16SF/R 各0.5 μL、模板各2 μL、ddH2O 7 μL;反应条件:95 ℃5 min;95 ℃30 s、55 ℃30 s、72 ℃60 s,72 ℃10 min,35 个循环)。确定两种方法的最低检测限并比较分析,评估本研究建立检测方法的敏感性。
1.9 重复性试验选取10 倍倍比稀释(104~106)后的重组质粒标准品pMD-gdh和pMD-16S rRNA 同稀释度等体积混合后作为模板,利用本研究建立的方法检测每个稀释度重复3 次,检测组内重复性;以上述浓度的质粒标准品作为模板,在不同时间采用该方法检测每个稀释度重复试验3 次,检测组间重复性。同时根据每个稀释度的Cq 值计算组内和组间变异系数(CV),以此评估该检测方法的重复性。
1.10 临床样品的检测 从河南地区猪场收集54 份疑似感染SS 和/或HPS 猪的肺部组织,每份病料样品各称取1 g 研磨后利用细菌基因组DNA 提取试剂盒分别提取基因组DNA 作为模板,分别采用本实验建立的双重TaqMan 荧光定量PCR 方法与常规PCR 方法[10-11]、国标法(GB/T 19915.5-2005《猪链球菌2 型多重PCR 检测方法》、GB/T 34750-2017《副猪嗜血杆菌检测方法》)[12-13]同时对上述样品进行检测,比较本研究建立的方法与这两种方法的检测结果,并计算其与二者的符合率。
2 结 果
2.1 重组质粒标准品的构建与鉴定分别以SS 和HPS 菌株基因组DNA 为模板,利用设计的引物进行PCR扩增,结果显示,均获得与预期大小一致的目的片段,分别为106 bp和112 bp。将其克隆至pMD19-T 载体,构建重组质粒pMD-gdh和pMD-16S rRNA,测序结果显示目的片段正确插入,表明重组质粒标准品均正确构建。利用超微量分光光度计测定提取的重组质粒标准品pMD-gdh和pMD-16S rRNA 浓度分别为333.6 ng/μL 和289.98 ng/μL。经公式计算得重组质粒标准品pMD-gdh和pMD-16S rRNA 拷贝数分别为7.534×1010拷贝/μL 和6.350×1010拷贝/μL。
2.2 双重TaqMan 荧光定量PCR 反应体系和条件的优化结果通过对退火温度、循环数、引物浓度和探针浓度的优化,选择荧光强度高,扩增效率较一致,非特异性信号未出现时最大循环数的条件。结果显示,优化后双重TaqMan 荧光定量PCR 反应体系为20 μL,含2×Bestar®qPCR Master Mix 10 μL,引物各0.6 μL(0.3 μmol/L),探针各0.3 μL(0.15 μmol/L),模板各2 μL 和ddH2O 4.8 μL。反应条件为:95 ℃2 min;95 ℃10 s,60 ℃30 s,40 个循环。
2.3 双重TaqMan 荧光定量PCR 标准曲线的建立分别将7.534×1010拷贝/μL 质粒标准品pMD-gdh和6.350×1010拷贝/μL 质粒标准品pMD-16S rRNA 以10倍倍比稀释(103~107)等体积混匀后作为模板,经荧光定量PCR 扩增获得扩增曲线和标准曲线(图1A 和图1B),结果显示,所得质粒标准品拷贝数(x)与Cq值(y)的线性方程为:SS:y=-3.424x+40.481,相关系数R2=0.997,扩增效率为95.9%;HPS:y=-3.034x+36.810,相关系数R2=0.999,扩增效率为113.6%。结果表明:本实验建立的方法在103拷贝/μL~107拷贝/μL范围内,各种质粒标准品的模板数与对应的Cq 值均呈良好的线性关系。
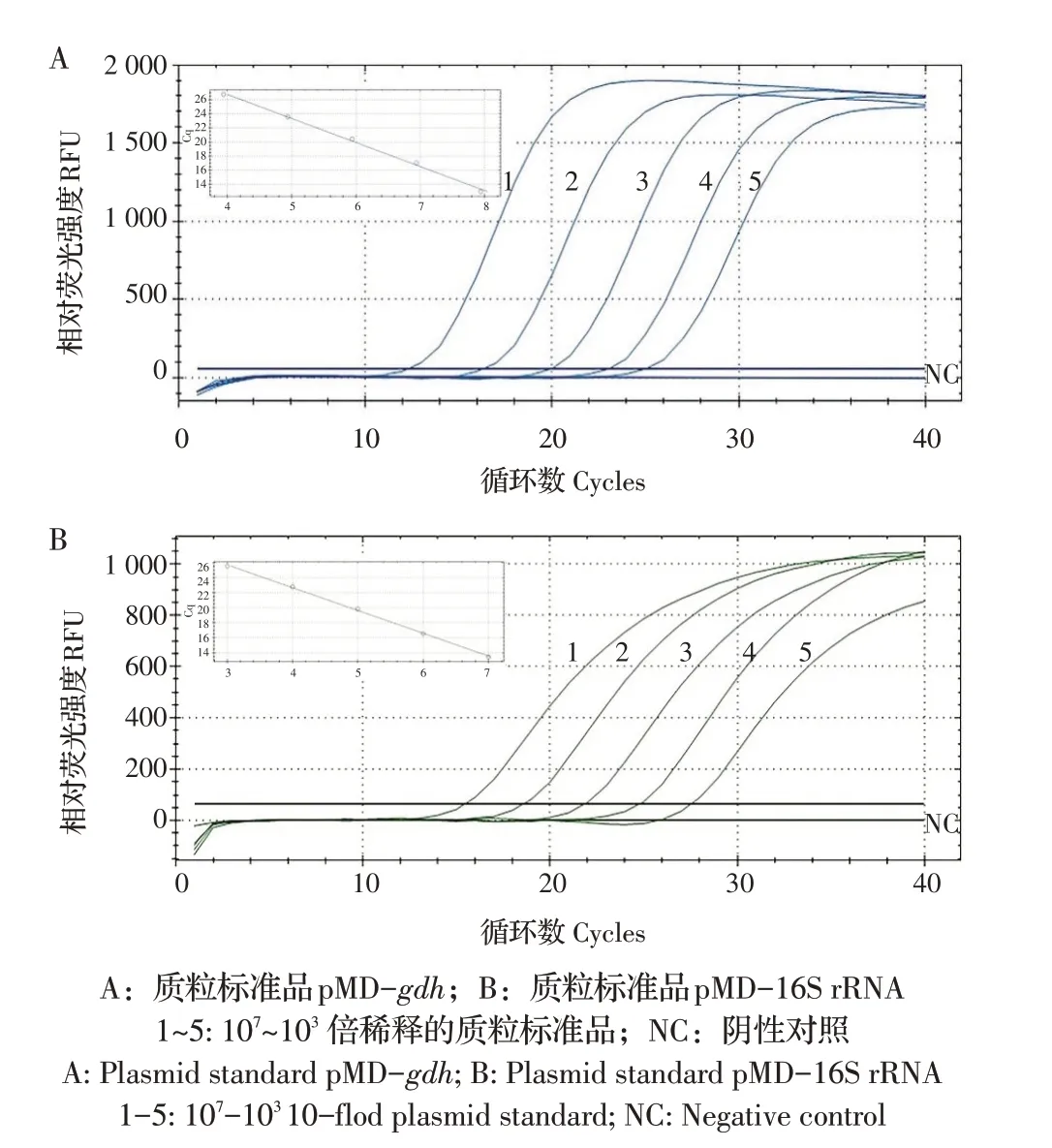
图1 TaqMan荧光定量PCR的扩增曲线和标准曲线Fig.1 Amplification curve and standard curve of the TaqMan real-time PCR
2.4 特异性试验结果分别以提取的SS、HPS、Bb、SA、APP、GBS 的基因组DNA 为模板,利用建立的TaqMan 荧光定量PCR 方法扩增。结果显示,仅SS 和HPS 出现荧光信号,分别出现特异性的gdh和16S rRNA 基因的扩增曲线;其他4 种菌及阴性对照均未达到阈值,检测结果为阴性(图2)。表明所建立的双重TaqMan 荧光定量PCR 方法特异性较强。

图2 TaqMan荧光定量PCR的特异性试验结果Fig.2 Specificity test for the TaqMan real time PCR
2.5 敏感性试验结果分别将重组质粒标准品pMD-gdh、pMD-16S rRNA 稀 释 液(104~100)和SS、HPS 细菌稀释液(105cfu/μL~101cfu/μL)作为模板,进行双重TaqMan 荧光定量PCR 扩增,同时对混合重组质粒标准品进行常规PCR扩增。结果显示,双重Taq⁃Man 荧光定量PCR 方法对pMD-gdh和pMD-16S rRNA质粒标准品的检测下限分别为7.534×101拷贝/μL 、6.350×101拷贝/μL;对SS 和HPS 菌液的检测下限均为102cfu/μL。而常规PCR 方法对质粒标准品的检测下限分别为7.534×103拷贝/μL、6.350×103拷贝/μL(图3)。二者相比TaqMan 双重荧光定量PCR 检测方法比常规PCR 敏感性提高了100 倍。结果表明,建立的双重TaqMan 荧光定量PCR 检测方法的敏感性较高。
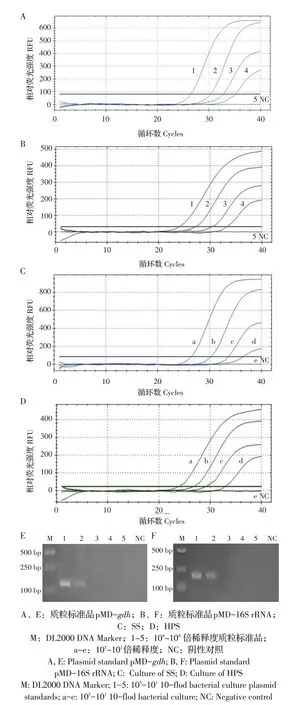
图3 TaqMan荧光定量PCR的敏感性试验Fig.3 Sensitivity test for the TaqMan real time PCR
2.6 重复性试验结果选取10 倍倍比稀释后的pMD-gdh和pMD-16S rRNA 质粒标准品混合物作为模板,利用该双重TaqMan 荧光定量PCR 方法分别进行批内和批间重复性试验。结果显示,批内和批间重复性试验变异系数均在3%以下(表2),表明本研究建立的双重TaqMan 荧光定量PCR 方法稳定性和重复性较好。

表2 TaqMan荧光定量PCR的重复性试验Table 2 Repeatability test for the TaqMan real time PCR
2.7 临床样品的检测结果利用建立的双重TaqMan荧光定量PCR、常规PCR 方法和国标法,对来自河南地区的54 份疑似病料样品进行检测。结果显示,双重TaqMan 荧光定量PCR 检测的阳性率为38.89%(21/54),与国标法结果一致;常规PCR检测的阳性率为31.48%(17/54),且常规PCR 检测出阳性的样品经双重TaqMan 荧光定量PCR 检测结果也均为阳性(表3)。经计算,TaqMan 荧光定量PCR 方法与常规PCR 方法的阳性符合率为100%,阴性符合率为89.19%,总符合率为92.59%;与国标法的总符合率为100%。结果表明,本研究建立的双重TaqMan 荧光定量PCR检测方法准确性较好,可以用于临床检测。

表3 临床样品的检测结果Table 3 Detection results of clinical samples
3 讨 论
近年来,随着国内规模化养殖业的高速发展以及畜群跨区域的频繁流动,临床上由SS 和HPS 混合感染引起的猪呼吸道疾病不断增加且难以控制。然而,SS 和HPS 感染后引起宿主相似的临床症状和病理变化,不仅导致猪呼吸道疾病的发病率和严重程度增高,也给鉴别诊断和疫情防控造成了困难。因此,对SS 和HPS 同时快速、准确的检测,是有效防治该病的重要前提。为了提高检测的效率及准确性,本研究结合分子生物学手段,在已有检测方法的基础上建立了同时检测该两种细菌的双重TaqMan荧光定量PCR 方法。
TaqMan 荧光定量PCR 是一种特异性强、敏感性高的核酸定量检测技术。其结合了PCR对核酸的高效扩增、探针技术的高特异性和光谱技术的高敏感性,且为完全封闭式反应,降低了假阳性[14-15]。目前,用于SS和HPS的检测方法主要有PCR、环介导等温核酸扩增(LAMP)、酶联免疫吸附试验(ELISA)等[16-21],但常规PCR 耗时长,特异性相对较低;而LAMP 因其对环境要求较为严格,假阳性率较高;ELISA 相较于TaqMan荧光定量PCR则具有灵敏度较低、耗时长、等缺点。TaqMan 荧光定量PCR 具有耗时短、操作简易、灵敏度高、特异性强等优点,对样品检测的同时还可以对其定量分析,因此广泛应用于病原的临床检测。
目前,尚无研究报道基于SSgdh基因序列和HPS 16S rRNA 基因序列的双重TaqMan 荧光定量PCR 检测方法。因此,本研究根据SS 和HPS 的保守基因gdh、16S rRNA,分别设计了引物和探针,并对引物浓度、探针浓度、退火温度等反应体系和条件进行优化,提高扩增效率,进而建立了双重TaqMan 荧光定量PCR检测方法。结果显示,建立的双重TaqMan 荧光定量PCR方法对SS和HPS重组质粒标准品的最低检测限分别为7.534×101拷贝/μL和6.350×101拷贝/μL,对SS和HPS 的最低检测限均为102cfu/μL,且与Bb、SA、APP、GBS 均无交叉反应,相比贾爱卿等建立的SS和HPS双重PCR敏感性高出至少10倍[22],可以定量检测且特异性更强。本研究建立的双重TaqMan荧光定量PCR方法对质粒标准品的敏感性较高,且与常规PCR方法比较,该方法对质粒标准品的敏感性提高了100 倍。此外,对建立的双重TaqMan荧光定量PCR方法在不同时间段进行了重复性试验,组内组间变异系数均小于3%,表明该方法的稳定性和重复性较高。与刘博婷等建立的双重环介导等温核酸扩增(LAMP)方法[15]相比,耗时短、过程封闭、操作简单,更加敏感、准确。
利用所建立的双重TaqMan 荧光定量PCR 方法对河南省部分地区的54 份临床样品进行检测,并与常规PCR 和国标法相比较。结果显示,TaqMan 荧光定量PCR 方法与常规PCR 方法检测的阳性率分别为38.89%和31.48%,二者符合率为92.59%;与国标法结果一致,二者符合率达100%,可见本研究建立的方法准确性较好,可以用于临床样品检测,且Taq⁃Man 荧光定量PCR 方法的敏感性高于常规PCR 方法。
综上所述,本研究建立的双重TaqMan 荧光定量PCR 方法可以对SS 和HPS 同步快速鉴别检测,并且具有较好的特异性、敏感性和重复性。这对于SS 和HPS 及二者混合感染的早期快速检测和同步定量检测,以及猪呼吸道疾病的预防和流行病学的监测提供了可靠有效的技术手段。
