鸽I型腺病毒SYBR Green I荧光定量PCR检测方法的建立
2022-02-04杨俊杰韩晓语刘春羽王亚新温永俊王凤雪
杨俊杰,韩晓语,刘春羽,王亚新,郭 昊,温永俊,王凤雪
(内蒙古农业大学兽医学院,农业农村部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018)
禽腺病毒(FAdV)无囊膜、直径70 nm~90 nm、病毒粒子呈二十面体对称、基因组为双股DNA,主要的结构蛋白是六邻体蛋白(Hexon)和纤维蛋白(Fi⁃ber)[1]。FAdV 属共分为14 个种:禽腺病毒A~E 种、鸭腺病毒B、鸽腺病毒A(PIAdV-A)、鸽腺病毒B、鹅腺病毒A、火鸡腺病毒B~D 种、鹦鹉腺病毒B 种和猎鹰腺病毒B 种[2]。PIAdV-A 在国际病毒分类委员会(ICTV)的第九次报告中被建议设立为FAdV 属中的一个新物种[3]。鸽子感染PIAdV 后可分为I 型(也称为经典腺病毒、鸽I 型腺病毒或PIAdV-I 型)和II型(也称为鸽子II 型腺病毒或PIAdV-II 型),值得注意的是Ⅰ型和II 型的区分依据并不是某种病毒株或病毒抗原表位的差异,而是依据引起的临床症状和病变的不同[4]。PIAdV-I 感染后主要表现为呕吐、腹泻和大约一周的持续性体重减轻,PIAdV-II 感染后以广泛的肝坏死和突然死亡为特征[5]。目前PIAdV 一些分离株尚不能被定性分类,因为它们既不能与鹅的3 个腺病毒I 型抗血清发生反应,又不能与鸡的腺病毒阳性血清发生反应,但是通过群特异性反应可以被证实为PIAdV-I。PIAdV-I 的感染在临床上难以诊断、防制困难,所以建立早期快速特异性检测方法对有效防控该病具有重要意义[6]。
目前世界动物卫生组织(OIE)对PIAdV-I 尚无推荐的检测方法,因此对其的检测主要为病毒分离鉴定、免疫染色和电镜观察等,但是这些技术存在耗时长,过程复杂或缺乏一定特异性等弊端[7]。PIAdV的分离比较困难,因此通过该病毒的分离鉴定也不是常规检测手段,目前文献报道PIAdV 仅成功分离10 株[8]。SYBR Green I 荧光定量PCR(qPCR)检测方法具有操作方便、迅速、可视化等优点,相较于普通PCR 检测具有更高的灵敏性且无需进行核酸凝胶电泳分析步骤,还可规避开盖后造成的交叉污染风险。Raue 等以PIAdV-I IDA4(FN824512.2)株高度保守的Fiber 2 为靶基因建立了能够特异性检测到PIAdV-I 且不会与其他FAdV 发生交叉反应的普通PCR 方法,可直接用于组织样品中PIAdV-I 的检测[9]。因此,本研究拟在Raue 等的研究基础上,利用其设计的PIAdV-I Fiber 2 基因检测引物构建重组质粒标准品,并设计一对针对Fiber 2 基因的特异性qPCR 引物,建立一种快速检测PIAdV-I 的qPCR 方法,为PIAdV-I 感染的防控提供技术支持。
1 材料与方法
1.1 基因组和临床样品PIAdV-I、鸽圆环病毒(PICV)、新城疫病毒(NDV)、多杀性巴氏杆菌(PM)、禽致病性大肠杆菌(APEC)共5 种病原基因组均由本实验室于-80 ℃保存;PIAdV-II Fiber 2基因保守区标准阳性质粒由上海生工生物工程技术服务有限公司合成;30 份病死鸽肝脏样品采集于呼和浩特市某赛鸽公棚,-80 ℃保存。
1.2 主要试剂GoTaq®qPCR Master Mix 和琼脂糖凝胶回收试剂盒购自普洛麦格(北京)生物技术有限公司;血液/细胞/组织DNA 基因组提取试剂盒购自天根生化(北京)科技有限公司;LATaqDNA 聚合酶购自宝日医生物技术(北京)有限公司;Trans T1 感受态细胞购自北京全式金生物技术有限公司;pMDTM19-T Vector Cloning Kit 购自宝生物工程(大连)有限公司;T4 DNA 连接酶购自NEB(北京)有限公司。
1.3 引物设计与合成参考Raue 等针对PIAdV-I Fiber 2 基因保守区设计的一对特异性引物Fiber-F:ATCAACTACGACAACGAAGGC/Fiber-R:CGGTAGAG TTACGGGGAAATT,预期扩增片段967 bp[9]。利用Primer 5.0 软件设计SYBR Green I qPCR 特异性引物Fiber-q-F:ATTGGGAGTACGACTACGG/Fiber-q-R:GGAATGGGATCGGAGGTCTGTA, 预 期 扩 增 片 段174 bp。以上引物均由上海生工生物工程技术服务有限公司合成。
1.4 重组质粒标准品的构建与鉴定以PIAdV-I 基因组DNA 为模板,利用引物Fiber-F/Fiber-R PCR 扩增目的基因片段,并克隆于pMD19-T 载体构建重组质粒pMD19-Fiber,并经测序和序列比对鉴定正确后,利用紫外分光光度计测定重组质粒的浓度,根据公式计算拷贝数后作为重组质粒标准品,-20 ℃保存备用。
1.5 反应条件的优化及标准曲线的绘制按GoTaq®qPCR Master Mix 试剂盒说明书对qPCR 20 μL 反应体系中的上下游引物(10 μmol/L)体积(0.4 μL、0.5 μL、0.6 μL)进行优化,得到最佳反应体系;对退火温度(56 ℃、58 ℃、60 ℃、62 ℃)进行优化,得到最佳反应条件。将重组质粒标准品稀释为1×1010拷贝/μL 再进行10 倍倍比稀释(1×108拷贝/μL~1×103拷贝/μL)后作为模板,按照优化后的qPCR 反应条件扩增,绘制标准曲线和溶解曲线。
1.6 特异性试验利用建立的qPCR 方法对1.1 中列出的5 种病原基因组及PIAdV-II Fiber 2 基因保守区标准阳性质粒样品进行扩增,并设立阴性对照(ddH2O),评估该方法的特异性。
1.7 敏感性试验将重组质粒标准品10 倍倍比稀释(1×108拷贝/μL~1×100拷贝/μL)后分别作为模板,利用建立的qPCR 检测方法和Raue 等建立的PIAdV-I 普通PCR 检测方法[9]分别扩增,对比两种方法检测结果,评估该方法的敏感性。
1.8 重复性试验批内重复性试验:将重组质粒标准品10倍倍比稀释(1×109拷贝/μL~1×105拷贝/μL),每个样品设3 个重复,进行qPCR 的扩增,根据Ct 值计算标准差和变异系数评估该方法的批内重复性。利用建立的qPCR 对上述各稀释度的重组质粒标准品在不同的时间qPCR 扩增,进行批间重复性试验,每个样品重复3 次,根据Ct 值计算标准差和变异系数,评估该方法的批间重复性。
1.9 临床样品的检测取30 份病死鸽肝脏样品,分别研磨后离心,取上清,利用试剂盒提取基因组DNA 并作为模板,利用建立的qPCR 方法和Raue 等建立的PIAdV-I 普通PCR 方法[9]分别检测,比较二者的检测结果,并计算二者的符合率。
2 结 果
2.1 重组质粒标准品的鉴定结果测序和序列比对结果显示,克隆至pMD19-T的基因序列与目的基因序列相同,表明正确构建了重组质粒pMD19-Fiber。经计算浓度为6.31×1010拷贝/μL。
2.2 qPCR 反应条件的优化及标准曲线的建立通过反应体系和反应条件的优化,确定20 μL 最佳反应体系:Nuclease-Free Water 7.6 μL,2×GoTaq®qPCR Master Mix 10 μL,CXR Reference Dye 0.2 μL,Fiberq-F(10 μmol/L)0.6 μL,Fiber-q-R(10 μmol/L)0.6 μL,DNA 模板1 μL。最佳反应条件:95 ℃2 min;95 ℃15 s、60 ℃30 s,40 个循环;95 ℃15 s、60 ℃30 s、95 ℃15 s。在最佳反应体系和反应条件下,对浓度分别为1×103拷贝/μL~1×108拷贝/μL 的重组质粒标准品pMD19-Fiber 进行检测,建立标准曲线(图1)。标准曲线显示,质粒标准品浓度在1×103拷贝/μL~1×108拷贝/μL 时与Ct 值有良好的线性关系,标准曲线Y=-3.587x+48.275,相关系数R2=0.995,扩增效率为90%。溶解曲线显示,各浓度标准品均出现窄且尖的特异性单峰(图2),表明无引物二聚体和非特性扩增,其溶解温度为85.0 ℃±0.5 ℃。
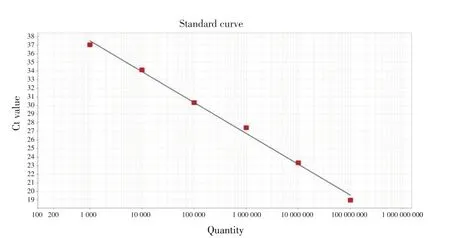
图1 qPCR方法标准曲线的建立Fig.1 Standard curve of qPCR
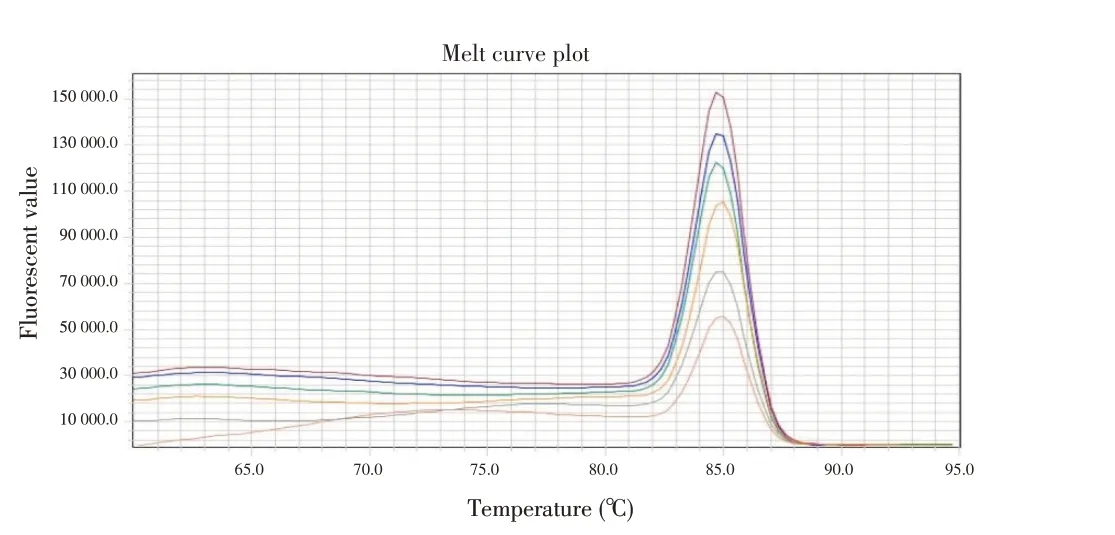
图2 qPCR方法的熔解曲线Fig.2 Melting curve of qPCR
2.3 特异性试验结果利用建立的qPCR 对6 个样品进行检测,结果显示仅PIAdV-I 检测为阳性,其他5 种病原和阴性对照检测均为阴性(图3),表明该方法特异性较强。
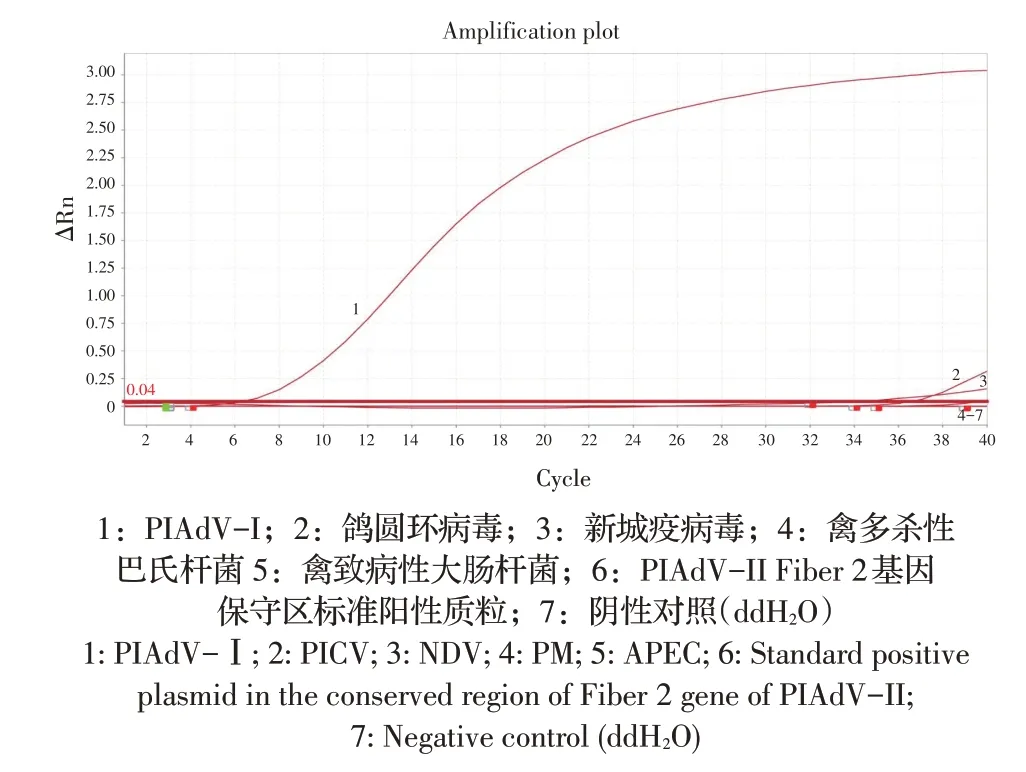
图3 qPCR的特异性试验结果Fig.3 Specificity test of fluorescence quantitative PCR
2.4 敏感性试验结果利用建立的qPCR 方法和普通PCR方法[9]分别对浓度为1×100拷贝/μL~1×108拷贝/μL的重组质粒标准品pMD19-Fiber 进行检测。结果显示,qPCR 对pMD19-Fiber 的最低检出限为1×102拷贝/μL(图4A),而普通PCR 对pMD19-Fiber 的最低检出限为1×104拷贝/μL(图4B)。表明该qPCR 方法的敏感性较高。

图4 PIAdV-I qPCR(A)和普通PCR(B)敏感性试验结果Fig.4 Sensitivity test results of PIAdV-I qPCR(A)and routine PCR(B)
2.5 重复性试验结果利用建立的qPCR 方法对浓度为1×105拷贝/μL~1×109拷贝/μL 的pMD19-Fiber 进行批内和批间重复性试验。结果显示,批内变异系数小于1%,批间变异系数小于2%(表1),表明该方法重复性较好。
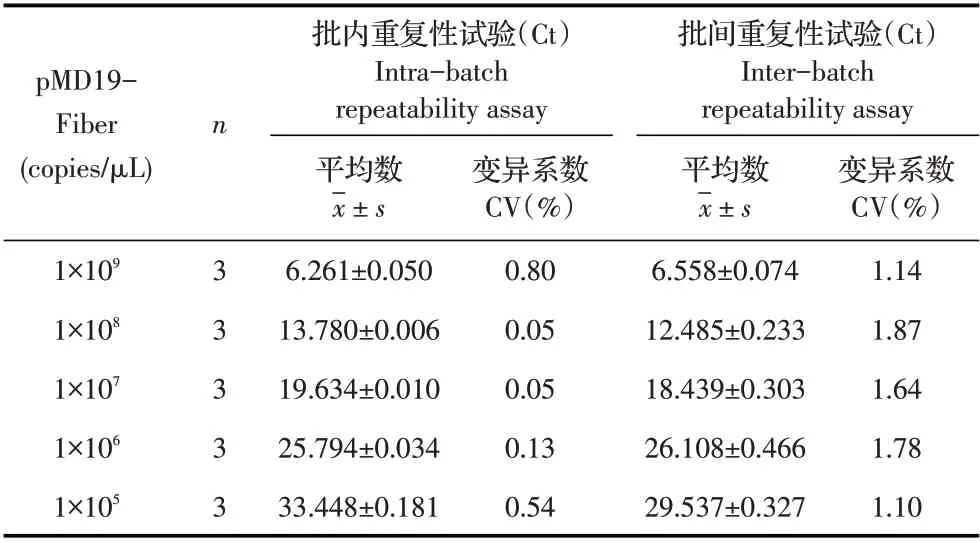
表1 重复性试验结果Table 1 Intra-and inter-assay reproducibility
2.6 临床样品的检测结果利用建立的qPCR 方法和Raue 等建立的PIAdV-I 普通PCR 方法[9]分别对采集的30份鸽肝脏样品检测。结果显示,普通PCR方法阳性检出率为36.7%(11/30);qPCR 方法阳性检出率为63.3%(19/30),且普通PCR 鉴定为阳性的样品qPCR检测的结果也均为阳性。两种方法的阳性符合率为100%,阴性符合率为57.89%,总符合率为73.30%,qPCR 方法阳性检出率明显高于普通PCR 检测方法,表明该qPCR 方法可以用于临床样品的检测。
3 讨 论
PIAdV-I 作为一种接触性传染病病原,传播范围广、发病率高,尤其对赛鸽,由于训放过程中处于高度应激状态,因免疫抑制从而成为易感动物[9]。20世纪70 年代就已经诊断出PIAdV-I 感染的散在病例,但直到1984 年Cousement 才首次在比利时发现只感染鸽的病原—PIAdV-I[10]。在此之后PIAdV-I 感染已不只局限在某一区域,而是在全世界范围内开始传播并被广泛报道[11]。该病虽病死率不高但极易与其他细菌或病毒等混合感染,造成鸽子的大量死亡,给鸽产业造成严重经济损失。我国对PIAdV-I的研究较少,对该病的发病机制,流行病学调查等也尚不明确。随着分子生物学技术的广泛应用,qPCR已应用于多种病毒性疾病的检测。与常规PCR 相比,SYBR Green I qPCR 检测方法具有简便、快速、灵敏、高效等特点,并可以对病毒定量检测[12]。
PIAdV-I 的分离费时费力,且难度极大;同时国内外文献对PIAdV-I 检测方法的研究报道极少,OIE 也无相关推荐检测方法,因此为了评估本研究建立的检测方法,本研究将建立的PIAdV- I SYBR Green I qPCR 检测方法和参考文献[9]中Raue 等建立的PIAdV-I 普通PCR 检测方法进行对比,两种检测方法对病毒的最低检测限分别为100拷贝/μL、1×104拷贝/μL。通过两种方法的最低检测限的比较发现,本实验建立的SYBR Green I qPCR 方法比普通PCR 具有更高的阳性检出率(63.3%),普通PCR 阳性检测率仅为36.7%,同时符合率也证实该方法的可靠性。因此,通过与现有的成熟的检测方法比较后发现,SYBR Green I qPCR 方法在兼具经济性和灵敏性的优势,能更好地在临床检测中进行推广。
本实验建立的SYBR Green I qPCR 检测方法为PIAdV-I的快速、特异、经济的临床检测提供了有力的技术支持,也对PIAdV-I 的流行病学调查及进一步研究奠定一定基础。
