基于体外抗氧化DPPH法优化生地抗氧化活性工艺*
2022-01-26任海云张朔生
任海云,张朔生
(山西中医药大学中药与食品工程学院,山西 太原 030619)
1 实 验
1.1 仪器与材料
1.1.1 仪 器
Thermo Fisher Scientific U3000高效液相色谱仪,美国赛默飞世尔Thermo公司;UV-610S紫外-可见分光光度计,上海元析仪器责任有限公司;Milli-Q 超纯水净化系统,默克化工技术(上海)有限公司;AX224ZH/E十万分之一电子天平,美国奥豪斯仪器(上海)有限公司;HH-6 数显恒温水浴锅,常州市金坛友联仪器研究所。
1.1.2 材 料
所用药材生地黄购自太原市北京同仁堂大药房,由山西中医药大学中药与食品工程学院张朔生教授鉴定为地黄(Rehmannia glutinosa L.) 根。1-二苯基-2-苦苯肼自由基:上海思域化工科技有限公司;对照品地黄苷D(批号ST1190120NG)、梓醇(批号 MUST-17032005)、毛蕊花糖苷(批号111530-201713)均为上海源叶生物科技有限公司;乙腈、甲醇、磷酸为为色谱纯,水为超纯水。其他试剂均为分析纯。
1.2 实验方法
1.2.1 色谱条件与系统适应性试验
色谱柱:Ultimate LP-C18(250 mm×4.6 mm, 5 μm);流动相:乙腈-水-1%磷酸混合水溶液;流速为1 mL/min;柱温为25 ℃;进样量:10 mL;检测波长:梓醇、地黄苷D以及毛蕊花糖苷分别为215 nm、203 nm与330 nm。在上述条件下, 供试品溶液中各组分色谱峰与其他峰分离良好, 峰形对称,分离度均大于 1.5,组分梓醇、地黄苷D与毛蕊花糖苷保留时间分别约为15.5、5.9、38.4 min。理论板数按各组分峰计均不低于 3000。
1.2.2 对照品溶液的制备
走入兵团、爱在兵团,了解兵团、融入兵团,是刘宇星来新疆工作一年后的真实情感,尤其是在红色革命基地参观了当年兵团战士生活、工作、学习的场景,看到兵团战士和北大荒拓荒者一样,在条件极其恶劣的情况下,与大自然展开了殊死较量。条件虽然艰苦,可是大家仍饱含着乐观主义精神和无私奉献的高尚情操,使他对兵团发展的历史有了更清晰的认识,对老一辈兵团战士的无私奉献精神肃然起敬,援疆让他收获了知识、开拓了视野,也感觉到身上的担子更重了,立誓要让自已在援疆本职岗位,用心、用情、用智、用党的好政策援疆,敢于担当,做一名无愧于党的援疆好干部。
精密称取干燥至恒定的梓醇、地黄苷D、毛蕊花糖苷对照品适量,加甲醇定容,分别制成含梓醇3.64 mg/mL、地黄苷D1.99 mg/mL、毛蕊花糖苷56 μg/mL的混合对照品溶液。
1.2.3 供试品溶液的制备
分别精密吸取生地水提液样品10 mL稀释定容至20 mL,微孔滤膜滤过,供试品溶液即制备完成。
1.2.4 DPPH溶液的制备
精密称取DPPH 0.0500 g,用甲醇定容至50 mL容量瓶,制成 0.002 mg/mL的混合溶液,即得。
1.2.5 线性关系考察
将对照品地黄苷D配成质量浓度为1.990、0.995、0.4975、0.24875、0.1243 mg/mL的溶液;梓醇质量浓度为3.640、1.820、0.910、0.455、0.2275 mg/mL的溶液;毛蕊花糖苷质量浓度为56.000、28.000、14.000、7.000、3.500 μg/mL的溶液。按“1.2.1”项下色谱条件各进样10 μL, 测定峰面积。将所得峰面积与各对照品的质量浓度进行线性回归, 得回归方程、相关系数 (r) 及线性范围,见表1。
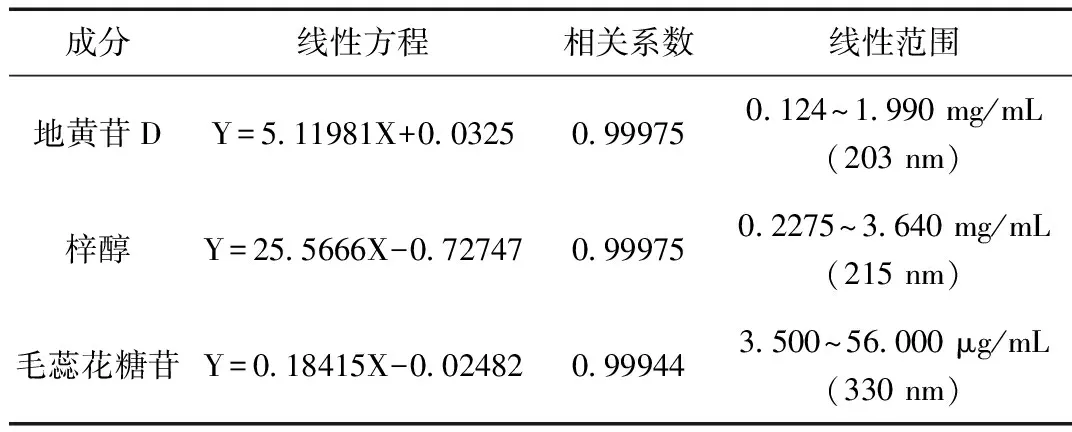
表1 回归方程和线性范围Table 1 The regression equation and linear range
1.2.6 生地抗氧化活性单因素实验设计
以生地为原料,DPPH清除率为指标,同时监测提取液中梓醇、地黄苷D、毛蕊花糖苷组分含量,固定煎煮次数2次、煎煮时间40 min,考察浸泡时间1.5、3、6、9、13、24 h对生地抗氧化活性的影响;固定浸泡时间1.5 h、煎煮时间40 min,考察煎煮次数2、3、4、5、6次对生地抗氧化活性的影响;固定浸泡时间1.5 h、煎煮次数2次,考察煎煮时间20 min、 30 min、40 min、50 min、60 min对生地抗氧化活性的影响。
1.2.7 生地抗氧化活性正交实验设计
在单因素实验的基础上,以DPPH清除率为指标,浸泡时间、煎煮时间以及煎煮次数为因素,进行 L9(34)正交试验, 优化获得最优条件。正交试验设计见表 2。
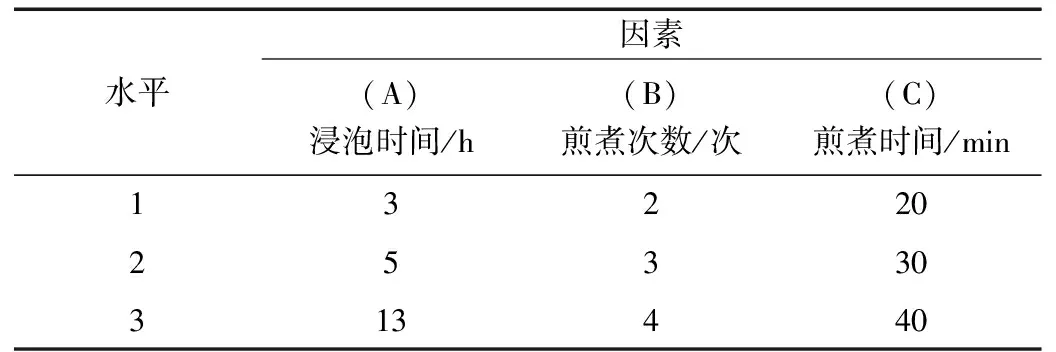
表2 因素水平表Table 2 The factor and level table
1.2.8 DPPH自由基清除率的计算方法
根据参考文献方法,精确量取供试品溶液1 mL分别与1 mL DPPH溶液以及1 mL 70%的甲醇混合均匀,避光孵育一小时,测其517 nm处的吸光度值,并通过下式计算DPPH的清除率:
DPPH清除率(%)=[1-(A1-A2)/A3]×100%
式中:A1为517 nm波长下,1 mL供试品溶液与1 mL的DPPH溶液混合室温避光孵育1 h后的吸光度值,A3为517 nm波长下,1 mL 70%甲醇与1 mL的DPPH溶液孵育后的吸光度值,A2为517 nm波长下,1 mL供试品溶液与1 mL甲醇孵育后的吸光度值。
2 结果与讨论
2.1 生地抗氧化活性单因素实验结果
2.1.1 浸泡时间对生地抗氧化活性的影响
如图1所示,随着浸泡时间增加,生地DPPH自由基清除率随之升高,13 h之后,DPPH自由基清除率增长减缓。从供试品组分含量变化可知浸泡3 h时生地提取液梓醇、地黄苷D以及毛蕊花糖苷等组分含量增加迅速,随后这些组分含量随浸泡时间延长增加缓慢,从9 h到13 h以较快速度增加,浸泡时间再延长则各组分含量增加放慢,与供试品DPPH自由基清除率变化规律相一致,因此选择浸泡时间3 h、5 h、13 h做正交实验水平测定。
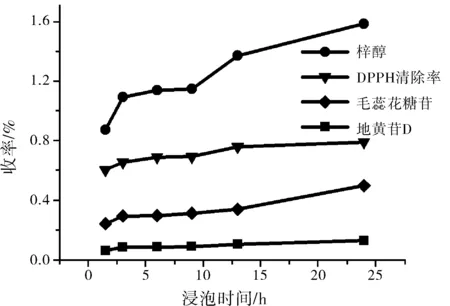
图1 浸泡时间对生地抗氧化活性的影响Fig.1 The effect of soaking time on antioxidant activity of driedrehmannia root
2.1.2 煎煮次数对生地抗氧化活性的影响
从图2中可以看出,煎煮4次后得到的供试品DPPH自由基清除率达到最高,然后再增加煎煮次数则导致其DPPH自由基清除率下降。供试品DPPH自由基清除率变化规律从梓醇、地黄苷D以及毛蕊花糖苷等组分含量相似变化趋势得到验证。由此选择煎煮次数2、3、4做正交试验水平测定。
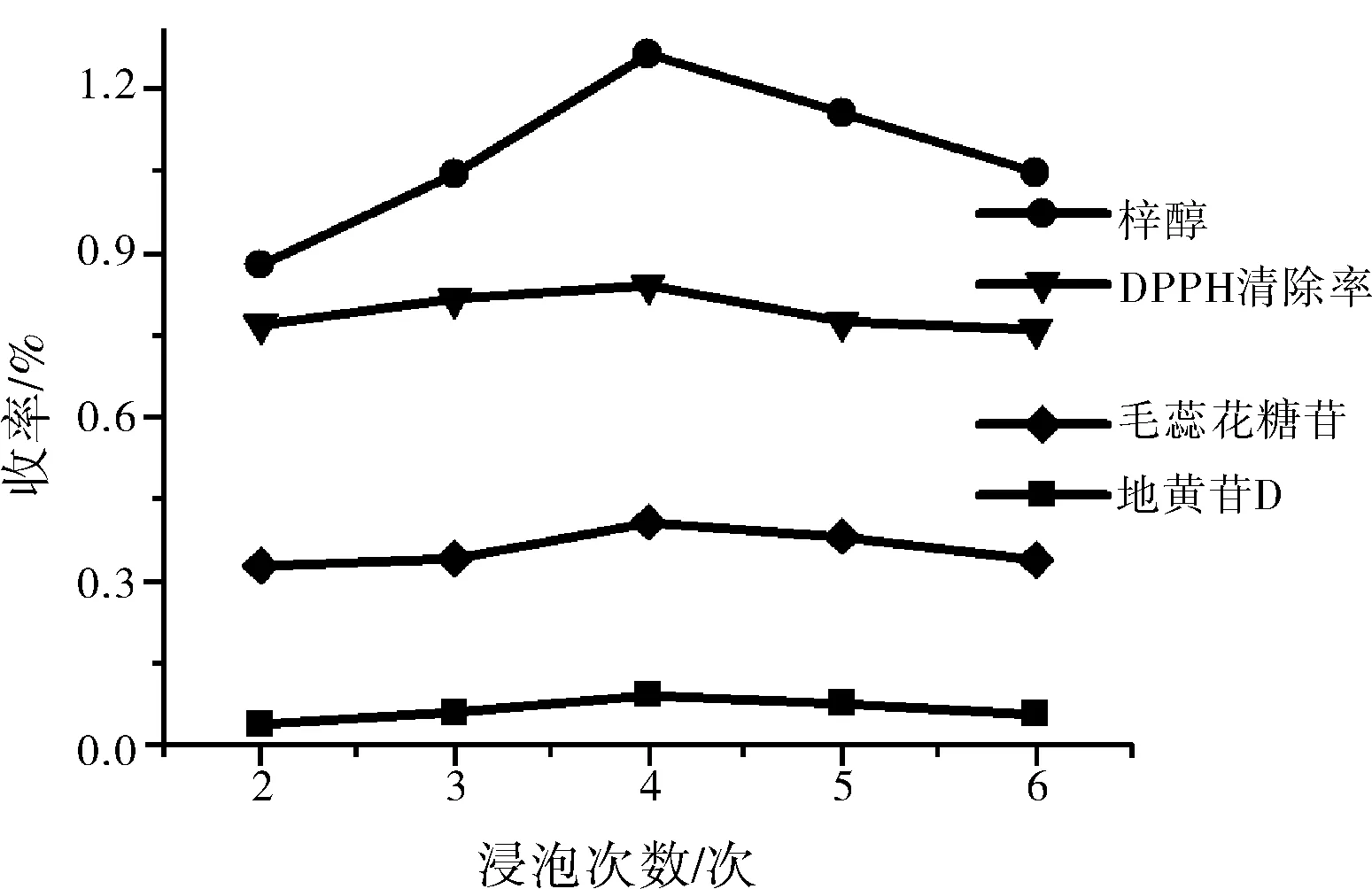
图2 煎煮次数对生地抗氧化活性的影响Fig.2 The effect of decoction times on antioxidant activity of driedrehmannia root
2.1.3 煎煮时间对生地抗氧化活性的影响
由图 3可知,从20到60 min随着煎煮时间增加,供试品对DPPH自由基清除率呈现明显上升的趋势,在40 min时达到最高值,之后其DPPH自由基清除率呈现缓慢下降的趋势。梓醇、地黄苷D以及毛蕊花糖苷等组分含量随煎煮时间变化规律与供试品DPPH自由基清除趋势率吻合。因此,选择煎煮时间20~40 min做正交实验水平测定。
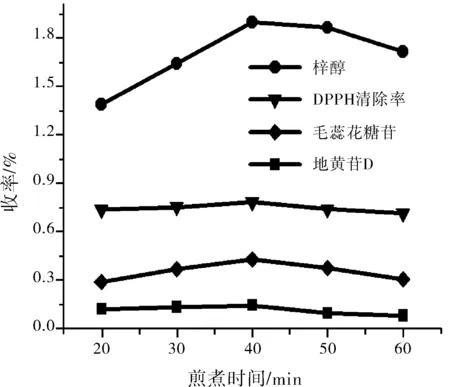
图3 煎煮时间对生地抗氧化活性的影响Fig.3 The effect of decoction time on antioxidant activity of driedrehmannia root
2.2 生地抗氧化活性正交实验结果
从表3可以直观地看出RC值最大,很显然因素C(煎煮时间)对生地抗氧化活性影响最大,为关键影响因素。这一点在表4方差分析中FC=4.58大于F0.05(2, 8)(4.46)可以得到验证。综合生产成本等因素最终确定提高生地抗氧化活性的最优工艺条件为A3B2C2,即浸泡时间13 h、煎煮次数3次、煎煮时间 30 min。按最佳工艺条件重复实验3次,其供试品DPPH自由基清除率为98.05%±0.0058%,说明该工艺流程设计稳定可行,具有较好的改进生地抗氧化活性的效果。
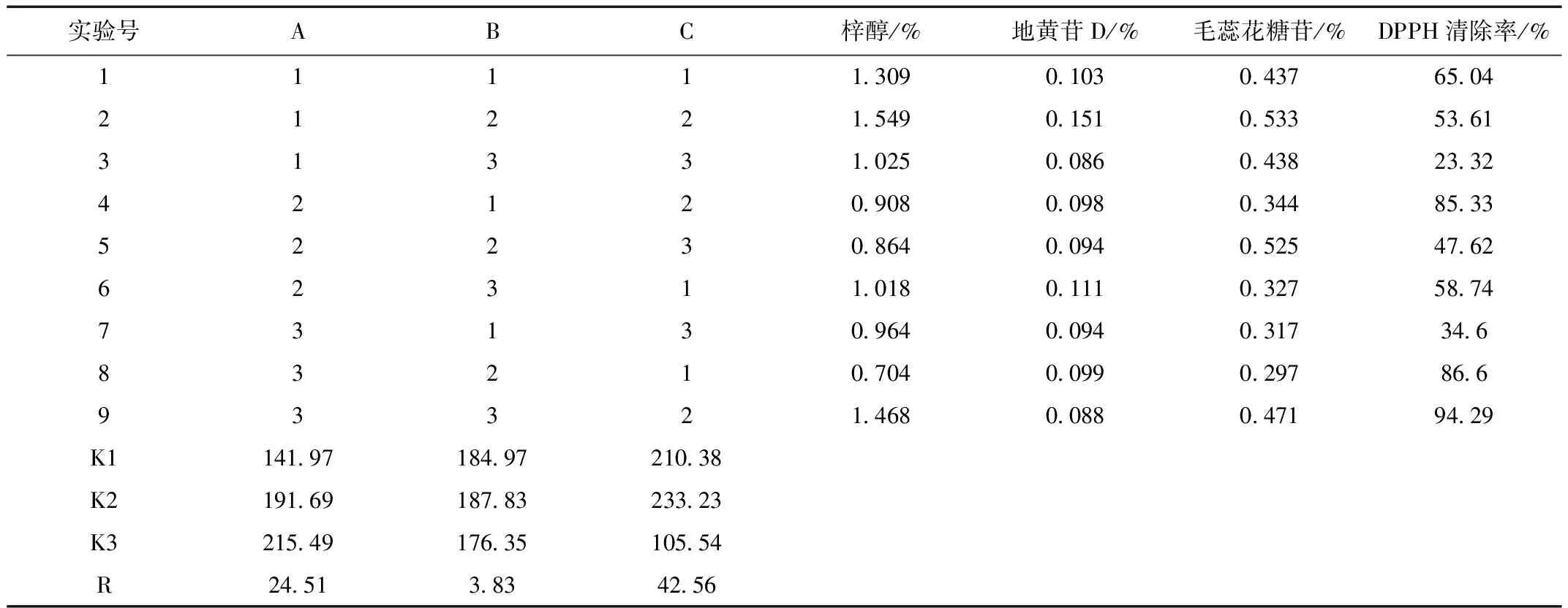
表3 正交实验设计及结果Table 3 The orthogonal experimental design and results
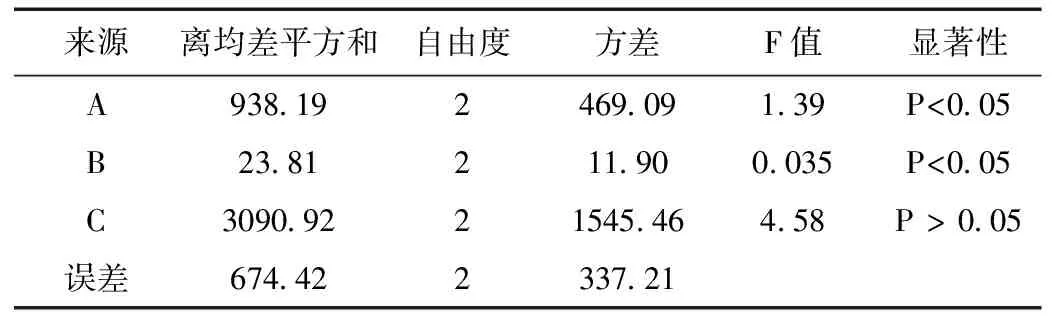
表4 方差分析结果 Table 4 The results of variance analysis
3 结 论
本研究以DPPH自由基清除率为指标,同时监测其抗氧化主要成分梓醇、地黄苷D、毛蕊花糖苷含量变化,设计正交实验对生地抗氧化活性进行研究,考察影响生地抗氧化活性的关键因素,最终确定了提高生地抗氧化活性的最佳工艺,同时发现生地抗氧化活性大小与其抗氧化成分含量正向相关,为建立合理的综合评价方法评价其抗氧化能力提供重要参考。
