卟啉金属有机框架材料在光动力治疗方面的应用*
2022-01-26张一凡奉启铖陈梓欣胡娅琪
张一凡,郝 林,奉启铖,陈梓欣,胡娅琪
(西安医学院药学院,陕西 西安 710021)
PDT是以光敏剂和氧的相互作用为基础的一种新型癌症治疗手段,通过将光敏剂注入体内,经特定波长激光照射后产生单线态氧和自由基,破坏肿瘤组织外周血管,从而对肿瘤细胞造成损伤,激发人体免疫机制[1]。与其他传统的治疗方法不同,PDT对组织具有侵袭小,低累积毒性和高反应性的优点。该手段相较于手术或化疗等治疗方法可有效降低长期发病率,其中光敏剂的性能直接决定PDT效果[2]。
在众多光敏剂中,由于卟啉(图1)在光治疗窗口(600~ 850 nm)具有较高的活性氧(ROS)产率,且结构易于官能化修饰、结构多样,因此在PDT方面具有一定的优势。但是卟啉化合物疏水性较强,并且平面大环π-π系统之间的强吸引力相互作用导致其在生理条件下具有很强的自聚集倾向[3],更是由于体内应用代谢较快而降低其对光的吸收而降低生物利用度,所以为实现更好的治疗效果,往往会增加光敏剂的用量,同时也增加了药物毒性而引起副作用。目前在II型PDT中三重激发态分子吸收能量并传递给周围的O2,氧分子被激发形成1O2或其他ROS,因而PDT的治疗效果取决于细胞中的O2含量。然而,由于肿瘤细胞较快的新陈代谢(如侵略性增殖和肿瘤血管系统的畸变)会导致组织处于缺氧状态,较低的O2含量使光敏剂无法高效地产生ROS,这是降低PDT效果的主要限制因素。因此目前PDT所面临的挑战主要集中在:如何改善光敏剂的溶解性、聚集问题、提高ROS产率和实现肿瘤的靶向联合治疗。因此,开发新型的光敏系统以改善PDT效果至关重要。
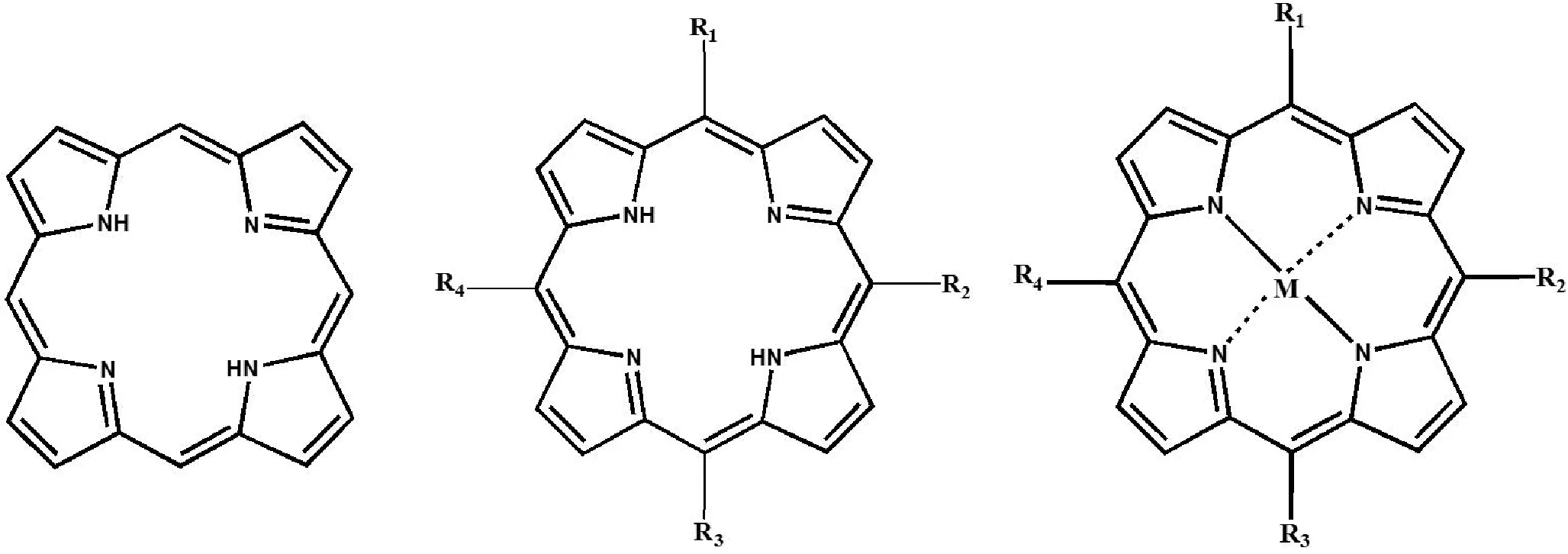
图1 卟吩、卟啉和金属卟啉的结构示意图Fig.1 Structural formulas of porphin, porphyrin and metal porphyrin
为了解决以上问题,研究者将卟啉分子作为有机桥连配体合成具有一定尺寸和周期性结构的Por-MOFs,通过MOFs对卟啉进行纳米功能化修饰,在Por-MOFs框架结构中,卟啉分子之间被很好的分隔开,避免了由于分子聚集而引发的性能下降,以期改善其在体内的循环性能、肿瘤富集能力、以实现更好的PDT效果。目前,Por-MOFs纳米材料作为光敏剂在PDT治疗中主要是以II型机制与光热治疗、化疗、放疗等结合,进行多模式协同治疗。本文着重对近五年来Por-MOFs在PDT的应用进行概述,主要包括ROS产率的提高,肿瘤乏氧微环境的改善,生理活性分子的消耗,信号分子的释放,靶向联合治疗这五个方面,并对其应用前景进行了展望。
1 ROS产率的提高
较低的ROS产率是降低PDT效果的主要因素,为了获得较高的PDT治疗效果,提高ROS的产率是关键问题之一。早在2014年,Lu等[4]首次通过Hf4+和羧基卟啉(H2DBP)合成DBP-UiO NMO,用于治疗头颈部癌。通过将卟啉分子以MOFs结构进行组装有效地避免了卟啉分子聚集引起的自猝灭,提高了对癌细胞的靶向性,有利于ROS的扩散,卟啉羧基与Hf之间的配位作用加强了系间窜越使得3O2转换为1O2,在体内体外显示出较强的PDT效果。但由于卟啉的摩尔消光系数相对较低而影响PDT效果,难以治疗临床病例中深层组织肿瘤。因此,为加快组织内1O2产率,增强光敏剂的光吸收系数,该课题组设计了一种氯基纳米金属有机框架,将DBP-UiO中的卟啉还原为二氢卟吩,得到了DBC-UiO,光谱产生13 nm的红移,大大提高了摩尔消光系数(约11倍),PDT效果明显提升[5]。Zhou等[6]报道了以一种碘取代的二羧基锌卟啉(ZnDTPP-I2-2H)为配体通过一锅法在UiO-66基础上合成新型ZnDTPP-I2⊂UiO-66。相对于无碘取代的ZnDTPP⊂UiO-66,ZnDTPP-I2⊂UiO-66通过重原子效应有效提高了卟啉光敏剂的系间窜越效率和1O2产率,在生理条件下具有较高的光敏性,对于肿瘤细胞具有优异的PDT效果。然而,Ju等[7]认为由于三重激发态分子可以转变为基态的过程受到辐射衰减,磷光,最终会降低1O2的产率。增强系间窜越未必会提高3O2-→1O2的转换率,因此要增强PDT效果需要提高1O2的产率。该工作将卟啉(TMPyP)组装为PS@MOF,进一步地将叶酸和半胱天冬酶标记在PS@MOF表面得到PS@MOF多功能纳米探针,减弱了磷光,提高了3O2-→1O2的转换率。修饰的Cy3标记的半胱天冬酶可用来进行细胞凋亡成像,以及激活半胱氨酸天冬氨酸蛋白酶3用于药物治疗效果的评估。通过二苯基苯并呋喃检测1O2的形成,发现1O2产率得到增加6.2倍,PS@MOF合成简单,生物相容性好,特异性好,PDT治疗效果较优。这项工作将诊断功能整合在一个纳米载体上,在癌症的精准诊断和治疗前景方面具有广阔的应用。
除了以卟啉直接作为配体合成Por-MOFs,通过后修饰法将卟啉光敏剂连接到NMOFs颗粒表面不仅可以保持卟啉的光敏性,同时可以保持NMOFs的结构完整性。如Kan等[8]通过后修饰的合成方法将卟啉连接到MOFs纳米颗粒的表面,保持了MOF材料的完整性和卟啉的光敏特性,发现MOFs颗粒中卟啉的位置可能是提高PDT效果的关键因素。基于TiO2与Por-MOFs之间的光化学反应,Shi等[9]将超小TiO2包覆于镧系上转换纳米粒子(UCNPs)与Por-MOFs异质二聚体表面构筑的光敏系统具有较好的生物相容性,稳定性和水溶性,在近红外光辐射条件下,UCNPs产生的紫外可见光不仅可以刺激TiO2和卟啉的光化学反应,同时能实现有效的肿瘤富集和深层渗透,可作为一种理想的PDT平台用于多种类型的肿瘤治疗。为了提高Por-MOFs在细胞内的富集,降低毒性,Wang[10]报道了一种由MOF通过液相剥离法制备超小Por-MOFs纳米点,此材料可被肾脏快速清除,具有较低的生物毒性,由于尺寸较小,产生的1O2是单纯MOFs前体的2倍,可以较好的从框架材料中扩散出去,避免了单线态氧的猝灭,大大降低了PDT因NMOFs内部产生的ROS利用效率低下而导致的PDT有效性的降低。超小型纳米点在体内显示出高效的肿瘤富集和快速的肾清除能力,这一研究成果推进了安全有效的光动力治疗材料的开发及临床应用。
2 肿瘤乏氧微环境的改善
缺氧是大多数实体瘤的一个最显著特征,通常是由肿瘤细胞的侵略性增殖和肿瘤血管系统的畸变引起的,严重的缺氧微环境降低了PDT效果,更是产生复发、侵袭和转移而造成难以治愈的重要原因。因此要提高PDT效果必须要改善肿瘤细胞缺氧环境。
纳米酶由于具有高稳定性、低成本和易于制备等优点,在生物医学领域得到了广泛的关注,已有诸多研究报道了将纳米酶用于肿瘤的化学动力学治疗。然而,由于纳米酶对正常组织毒性相对较高和在靶点组织活性较低,开发一种毒性低、多种酶活性且高效肿瘤部位特异性的纳米复合酶仍然面临巨大的挑战。基于PtNPs对H2O2优异的催化性,Liu等[14]提出一种催化性增强的双纳米酶Por-MOFs(PCN),首先将具有过氧化氢酶活性的Pt NPs负载于PCN表面形成三明治夹层结构-PCN@Pt@PCN,内层结构嵌入葡萄糖氧化酶模拟酶-AuNPs,再通过配位作用将叶酸修饰于其表面得到PCN@Pt@PCN-AuNPs-FA复合材料,增加了材料在生理环境中的稳定性。其中Pt NPs可以通过将肿瘤细胞内H2O2催化为O2而有效地改善肿瘤细胞的乏氧状态,增强了PDT效果,另外Au NPs促进了β-D-葡萄糖的消耗,与Pt NPs协同作用实现了肿瘤的饥饿疗法。此项工作考虑了肿瘤微环境,基于改善微环境的思想设计了相关的纳米反应器,为实际应用中催化多层模型的设计在提供了思路。
除此之外,抑制葡萄糖的有氧酵解可减少氧的消耗,有利于提高PDT效果。Zhang等[15]以Por-MOFs纳米粒子(PCN-224)为载体,将葡糖氧化酶(GOX)和过氧化氢酶(CAT)封装至MOFs内部,癌细胞膜包覆表面。光激发条件下,PCN-224生成1O2,GOX加速了葡萄糖的分解,进而抑制了葡萄糖的有氧酵解,切断了肿瘤的能量供给。此外,CAT将肿瘤细胞内H2O2还原为O2,改善了组织内乏氧情况。Zhao等[16]通过液层扩散法制备得到负载氧化铁的铁Por-MOFs(FeTCPP/Fe2O3MOF)材料,MOFs材料中的铁以及负载的Fe2O3可以催化芬顿反应产生羟基自由基进而改善肿瘤细胞的乏氧环境。Por-MOFs优异的单分散性和多孔性使更多的活性位点暴露,促进了PDT过程中卟啉分子与氧分子间的能量交换,1O2、·OH协同作用获得了理想的PDT/CDT肿瘤治疗效果。进一步地将微囊化红细胞包覆于MOFs表面以增强其在体内的血液循环和停留时间,再将AS1411适配体修饰在MOFs表面以实现其在肿瘤组织中的高富集,这项工作为Por-MOFs在肿瘤靶向治疗方面提供了理论实践基础。
3 生理活性分子的消耗
谷胱甘肽(GSH)是一种普遍存在的生物硫醇,具有清除毒素、维持氧化还原稳态和调控基因的作用,GSH的浓度异常可能引起多种疾病。光敏剂产生的ROS可被细胞中高浓度的GSH消除,因而降低了PDT效果。因此有两种途径可以提高ROS的产率:(1)减少GSH浓度;(2)增加光敏剂浓度。但光敏剂的浓度过高会引起副作用,因此减小GSH的含量有望增强PDT效果。鉴于Cu2+可以特异性结合GSH,Zhang等[17]报道了一种Al-Cu混合金属Por-MOFs,其中Cu2+为PDT的活性中心,通过与Cu2+的特异性键合作用,细胞内GSH浓度降低,ROS浓度增大,同时Por-MOFs被癌细胞捕获在光辐射条件下产生高浓度ROS,获得了较好的PDT效果。
除了Cu2+,过氧化氢酶、MnO2、MnFe2O4等都可以消耗GSH,Zhang等[18]以MnFe2O4为核,四羧基卟啉为配体,Zr4+为金属节点合成了MnFe2O4@MOF核-壳纳米粒子,MnFe2O4不仅可以与GSH反应,还具有过氧化氢酶的活性可将H2O2催化生成1O2,有效改善了癌细胞的乏氧环境,具有较高的PDT效果,基于MnFe2O4的磁共振成像可辅助PDT用于肿瘤的精准治疗。MnO2具有很强的氧化能力,能被GSH还原为Mn2+,可用作肿瘤细胞MRI/PDT联合诊疗平台。该检测平台为早期肿瘤的诊断提供了更可靠的检测方案。Tian等[19]将MnO2包覆至Por-MOFs(PCN-222)表面,进一步负载阿霉素得到生物相容性好的PCN@MnO2材料,GSH被MnO2消耗提高了1O2产率,PDT效果得到增强,实现了阿霉素的可控释放,这肯定了MnO2在PDT和化疗方面所具有的重要意义,显示了在成像引导的癌症治疗方面的应用前景。Liu等[20]合成了不同类型的Por-MOFs纳米粒子,并成功地应用在成像-PDT多模诊疗方面,为癌症的精准治疗提供了方向。比如在Fe3O4表面原位生成了Por-MOFs(PMOF)得到了生物相容性良好的核-壳纳米材料,用于荧光/磁共振双模成像引导的PTT/PDT双模治疗。Fe3O4@C@PMOF具有在癌细胞中高富集,正常细胞中低毒的优点,在肿瘤的多模诊疗方面具有一定的潜力。
4 信号分子的释放
作为自然界中最小、最简单的生物活性分子之一的NO,参与调解多种细胞活动,如血管生长、平滑肌舒张、免疫应答、细胞凋亡和突触信息传递等。NO除了在正常生理活动中发挥作用以外,大量研究已证实体内NO生成不足常常与多种重大疾病的发生有密切的关系,内生NO在抗肿瘤和治疗方面具有重大的意义,适当浓度的NO可促进肿瘤生长,高浓度的NO则不利于肿瘤生长而具有抗肿瘤作用。人体内NO是通过NO合成酶催化L-精氨酸(L-Arg)和O2生成的。鉴于L-Arg为NO供体,Zhang等[21]将L-Arg负载到Por-MOFs(PCN-224)中得到L-Arg@PCN-224纳米粒子,进一步包覆癌细胞膜可以更真实地模仿肿瘤细胞表面结构。PCN-224产生的大量1O2,不仅可以实现PDT,还可以催化L-Arg产生高浓度NO进行联合治疗。结果表明,NO由于可以自由扩散至乏氧的深层次肿瘤组织,包覆的癌细胞膜对肿瘤细胞具有靶向性,可有效地增强同类肿瘤细胞的PDT效果。Ma等[22]首次以四(4-羧基苯基)锌卟啉为主有机配体、Cu2+为辅助配体合成了一种新型的混合金属的MOF纳米粒子类型的光敏剂(MOF NP),这种光敏剂能够将PDT治疗过程中肿瘤微环境中存在信号分子-H2S激活,实现了活细胞内ROS的可控释放,能够有效地杀死肿瘤细胞进而达到实现有效的PDT治疗效果。这为发展应用于能够实现肿瘤细胞内部活性氧可控释放以及靶向治疗的多功能化的MOF NP光敏剂提供了思路。
5 靶向联合治疗
Por-MOFs解决了传统卟啉光敏剂存在的水溶性差,自猝灭聚集的缺点。但是提高对癌组织的靶向性仍然是Por-MOFs在PDT应用方面的关键问题。通过将小分子、多肽、抗体、适配体引入Por-MOFs可以实现与癌细胞表面受体的特异性结合,增强靶向性。其中功能化DNA修饰的Por-MOFs在这方面得到了广泛的应用,针对目前MOFs-DNA合成复杂的问题。Liu等[23]以Zr4+为金属节点,四羧基卟啉,苯甲酸为配体合成Por-MOFs(Zr-MOF),在此基础上通过磷酸功能化适配体与Zr4+强烈的配位作用将适配体修饰在Zr-MOF,进一步地与癌细胞表面受体结合引起适配体结构的改变,增强了PDT靶向效果。
纳米MOFs的结构和尺寸会影响药物的负载,以及细胞的吞噬作用。Zhang等[24]以四羧基卟啉、苯甲酸为配体,Zr4+为金属节点合成了PCN-224,PCN-224可以作为载体负载阿霉素(DOX)得到DOX@PCN-224,进一步地将两终端修饰羧基和荧光素的A549肺癌细胞适配体通过羧基与Zr4+的配位作用,修饰于DOX@PCN-224得到PCN-224-DNA,当PCN-224-DNA接触A549细胞后,可以通过与肿瘤细胞表面的蛋白特异性结合作用进行识别,另外荧光素可以实现癌细胞的追踪,肿瘤微环境较低pH使得DOX被释放,引起癌细胞凋亡,并且在化学治疗和光动力治疗联合方面表现出较高的靶向性,表面进行适配体功能化修饰的PCN-224为基于MOFs材料的靶向治疗和生物传感器的发展提供了思路。Sun等[25]以一锅法合成的ZIF-8纳米粒子为模板,通过自牺牲模板法合成了具有超高载药量的空心球形H-PMOF,相对于传统非空心Por-MOFs纳米粒子,H-PMOF不仅具有较强的光动力治疗效果,还可作为药物载体负载阿霉素(DOX)和吲哚菁绿(ICG),负载率高达635%,进一步将细胞膜包覆在其表面得到具有优异的同型性瘤靶向作用和免疫逃逸功能的材料,更有意思的是DIHPm显示出pH调控和近红外激光触发的DOX释放能力,实现了药物的可控递送。Min等[26]设计了一种将抗血管生成药物封装于卟啉MOFs孔道内,然后在MOFs外包裹一层MnO2,癌细胞膜包覆表面,从而增加生物相容性,极大地提高了PDT的治疗效果。Li等[27]通过将葡萄糖氧化酶(GOx)和过氧化氢酶嵌入PCN-224的癌细胞膜,伪装卟啉金属有机骨架,构建了一种用于协同饥饿和光动力治疗的肿瘤靶向级联生物反应器(mCGP)。通过仿生表面功能化,mCGP的免疫逃逸和同源靶向行为将显著增强其肿瘤靶向能力。mCGP通过催化内源性过氧化氢促进微环境氧化,在光照射下加速细胞内葡萄糖的分解,增加单线态氧产率,实现了对肿瘤的PDT-饥饿-免疫协同治疗。
相对于传统MOFs,多组分MOFs(混合配体,混合金属)具有结构多样性,多组分Por-MOFs结合了每一种成分所具有的物化性质,极大地增强了材料的整体功能,具有较高的应用性能。例如,Sun等[28]引入多个具有不同分子尺寸、对称性、连接性的有机配体通过一锅法合成稳定性较高的多组分Por-MOFs(Zr-MOF),通过调控卟啉分子和开关分子的比例获得了较高的1O2产率。通过光致变色开关控制光辐射实现ROS的可逆产生,相比与同种分子光敏剂,Zr-MOF纳米离子具有优异的1O2产生调控性能以及增强的PDT效果[29]。Sakamaki等[30]以多种卟啉衍生物(二羧基苯基/五氟苯基取代镍卟啉/卟吩)为混合配体,Hf4+为金属节点合成了Por-MOFs,再进行金属化将Zn2+配位至卟啉中心作为生物偶联位点。通过将乙二胺功能化麦芽三糖修饰在Hf-MOFs表面可以提高分子两亲性与癌细胞表面过度表达的糖受体结合,增加胰腺癌和乳腺癌细胞对光敏剂的摄取以提高靶向性,克服了目前PDT过程中在光敏剂持续时长、肿瘤特异性差等问题,且对正常组织毒性较小以及不存在暗毒性,能够保证正常组织免受损伤。另外,由于MOFs组分含有顺磁性Ni2+,因此可作为磁共振成像试剂。
6 结 语
PDT由于具有高效性、低毒性、无创性在癌症治疗方面具有广阔的应用前景,仍然面临一些挑战,比如如何提高缺氧环境中PDT的治疗效果,解决肿瘤组织的缺氧问题是关键问题。Por-MOFs光敏剂的发展为增强PDT效果起到了一定的作用,通过调控Por-MOFs结构性能实现高效的联合诊疗在癌症治疗和抗癌药物的递送方面意义重大。比如,以NO供体为代表的气体治疗具有较小的毒性和副作用,优异的生物相容性,联合PDT以期对癌症地诊疗研究有所突破。
