不同因素对地黄毛蕊花糖苷含量的影响*
2022-09-26张梓玉肖文欣马广尧
任 翔 刘 畅 张梓玉 肖文欣 马广尧
(河南中医药大学药学院,河南 郑州 450046)
地黄(拉丁学名:Rehmanniaglutinosa)为双子叶植物纲管状花目玄参科植物,又名酒壶花、牛奶子、地髓、山菸根等[1],块根入药,是一种重要的传统药材,最早著于《神农本草经》中,为“四大怀药”之一。不仅在河南、陕西、江苏等道地产区有着悠久的栽培历史,在韩国和日本也有种植。根据加工炮制方法的不同及药性的差异可分为鲜地黄、干地黄、熟地黄等种类。地黄在中成药市场上应用普遍,常和其他药用植物合用制成疗效各异的中药丸剂。地黄含有毛蕊花糖苷、地黄素、环烯醚萜甙类和糖类等化学成分。另外,地黄中含有的无机离子和微量元素主要有钾、钙、钠、镁等[2]。
毛蕊花糖苷,又称毛蕊花苷、麦角甾苷、类叶升麻苷等,是一种天然多酚的苯丙氨酸糖苷化合物。毛蕊花糖苷的分子式为C29H36O15,相对分子质量是624.59。纯品为白色针晶粉状,毛蕊花糖苷最早发现于毛蕊花属植物,其后在杨丁香花、地脚金、臭梧桐、齐墩果、肉苁蓉、地黄、毛泡桐、连翘和马缨丹等200多种不同植物的根、茎、叶和花中均有发现[2]。现代研究发现毛蕊花糖苷具有抗氧化、抗肿瘤、抗辐射、神经保护等多种较强的生物活性[3-5],受到国内外相关研究学者的广泛关注,其药用价值和药理作用的研究近些年来已经成为研究开发天然药物的新方向[6]。为深入探究地黄中毛蕊花糖苷含量的影响因素,本文从炮制方法、产区差异、不同部位、采收时节入手,为地黄品种培育鉴定和培育毛蕊花糖苷高含量新品种提供理论指导和试验思路。
1 不同炮制方法毛蕊化糖苷含量差异
在地黄进行炮制时,毛蕊花糖苷的糖苷键受温度、辅料等多种因素的影响而发生部分断裂、脱去端基单糖等情况,这使熟地黄中毛蕊花糖苷的含量显著低于生地黄。不同炮制方法对温度、辅料的要求有所不同,对地黄中毛蕊花糖苷的破坏程度也不同。
目前常用的地黄炮制方法有清蒸法、酒炖法和九蒸九晒法,其中清蒸法和酒炖法均未加入辛香类药物,九蒸九制法中加入了砂仁。比较这3种炮制方法对地黄中毛蕊花糖苷含量的影响可得出结论:清蒸熟地黄和酒炖熟地黄中苯丙素苷毛蕊花糖苷、异毛蕊花糖苷的含量较生地黄降低;相比生地黄,九蒸九晒制得的熟地黄中异毛蕊花糖苷、苯丙素苷毛蕊花糖苷几乎完全降解(见表1)。毛蕊花糖苷和异毛蕊花糖苷属于苯丙素苷,均相对稳定,在清蒸熟地黄和酒炖熟地黄中均可以检测到,但较生地黄含量下降。而九蒸九晒法中因熟地黄蒸晒次数较多,毛蕊花糖苷几乎全部降解[7]。见表1。
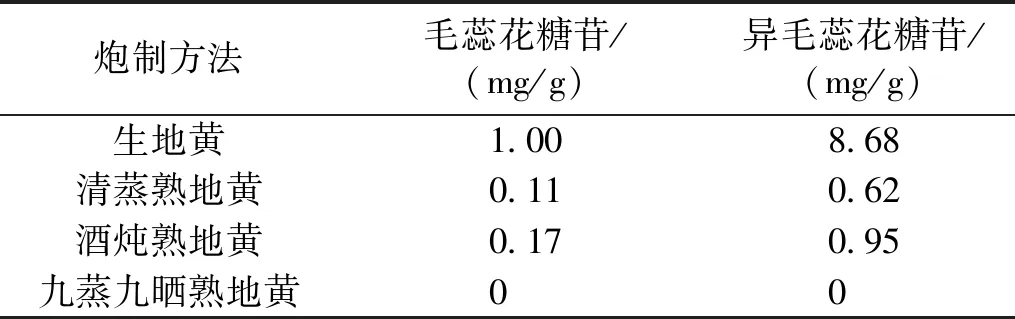
表1 不同炮制方法地黄中毛蕊花糖苷含量测定结果
2 不同产区地黄样品毛蕊花糖苷含量测定分析
2.1 药材来源 地黄分别取种植于河南温县(海拔110 m)、获嘉(海拔 90 m)、新乡市北环 (海拔80 m)、封丘(海拔76 m)和山东单县(海拔45 m)5个相近的生态环境区域,烘干粉碎。
2.2 测定结果分析 以乙腈-磷酸溶液(体积比1∶1)为流动相,检测波长为210 nm,柱温为23℃;毛蕊花糖苷以乙腈-醋酸溶液(体积比为20∶1)为流动相,检测波长为334 nm,柱温30℃,流量1.0 mL·min-1,进样量10 μL,HPLC分析毛蕊花糖苷标准品和样品,毛蕊花糖苷含量为横坐标,峰面积为纵坐标,得线性回归方程:Y=18193X~16.093,R=0.9993,毛蕊花糖苷在0.008 4~0.072 0 μg线性关系良好。对不同产区,同一品种地黄按照上述方法进行毛蕊花糖苷含量的测定,并将测出值代入回归方程得出试验结果。见表2。由表2可知,不同产地地黄样品中毛蕊花糖苷的含量在0.01%~0.04%波动,其中获嘉产地毛蕊花糖苷含量最高,为0.035%。毛蕊花糖苷含量最低的是新乡市北环。通过SPSS分析得出,温县、获嘉差异不显著,与新乡市北环、封丘、单县有较显著差异[8]。新乡市北环、封丘、单县3个地区毛蕊花糖苷含量偏低可能受自然环境的水分、光照及人文条件影响。
表2 不同产地地黄样品中毛蕊花糖苷含量测定结果
通过本实验可以得出,沿河南温县向东顺黄河经获嘉、新乡市北环、封丘直至山东单县都适宜种植地黄,其中温县地区地黄毛蕊花糖苷含量较其他地区含量更高且稳定,可结合当地情况适当调整为解决市场需求扩大地黄种植开辟一条新的途径[8]。
3 不同部位地黄样品毛蕊花糖苷含量测定分析
3.1 毛状根中毛蕊花糖苷含量测定条件 称量1 g原材料粉末在60℃进行干燥,然后将其加入100 mL锥形瓶中,再加入70%甲醇溶液10 mL超声处理45 min,补足质量,过滤后将滤液定容至50 mL,摇匀后量取2.5 mL该溶液于50 mL容量瓶中,加入70%的甲醇溶液至刻度处。将溶液摇匀作供试液。毛蕊花糖苷的测定条件与方法,参照2015年版《中华人民共和国药典》。毛蕊花糖苷的测定条件以乙腈-0.1%醋酸溶液(16∶84)为流动相;ZORBAX SB-Aq(4.6 mm×250.0 mm,5-Micron)色谱柱,柱温为30℃;流速为1 mL·min,检测波长334 nm[9]。
3.2 毛状根中毛蕊花糖苷含量的测定结果 经过实验得出,在地黄的毛状根样品中可以检测到少量的毛蕊花糖苷。在地黄诱导后8 d内,实验组与对照组毛状根中毛蕊花糖苷含量均出现先上升后下降的趋势,且均在诱导后第2天达到最高。其中,实验组毛状根干重在诱导后的第2天达到最大值71.48 mg·g-1,约为对照组毛状根中毛蕊花糖苷含量(50.72 mg·g-1)的1.41倍,差异具有统计学意义(P<0.05)。但在诱导2 d后,实验组毛状根中毛蕊花糖苷的含量相比照组明显下降的更快,诱导第6天(P<0.01)和第8天(P<0.01)时显著低于对照组中的毛蕊花糖苷含量[10]。
精密称定地黄叶和地黄样品粉末各0.1 g,按干燥品计算,测得样本S1、S2、S3、S4、S5、S6、S7、S8、S9、S10地黄叶中毛蕊花糖苷的含量分别为23.46 mg·g-1、24.94 mg·g-1、27.74 mg·g-1、21.80 mg·g-1、20.45 mg·g-1、15.83 mg·g-1、4.02 mg·g-1、7.71 mg·g-1、9.24 mg·g-1、9.01 mg·g-1。均值为16.12 mg。测得地黄样品1、2、3、4、5中的毛蕊花糖苷的含量分别为0.89 mg·g-1、1.13 mg·g-1、1.13 mg·g-1、1.78 mg·g-1、1.98 mg·g-1。均值为1.38 mg·g-1。
经对地黄叶与地黄样品中毛蕊花糖苷的含量分析发现,相同条件下地黄叶中的毛蕊花糖苷含量均值约为16.12 mg·g-1,而地黄样品的毛蕊花糖苷含量均值为1.38 mg·g-1,即地黄叶中毛蕊花糖苷的含量高于地黄样品。进而推断出,毛蕊花糖苷合成主要在地黄叶,其他部位合成较少。
同时有研究表明[11],地黄全草和块根中毛蕊花糖苷含量相差不大,可以推算出块根不是地黄毛蕊花糖苷的主要合成部位见图1。
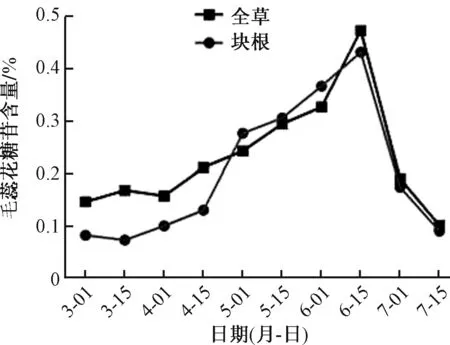
图1 地黄不同部位毛蕊花糖苷含量随时间变化测定结果
4 不同时节地黄中毛蕊花糖苷的含量
毛蕊花糖苷是地黄众多化学成分中较稳定的一种。本研究在2015年和2016年分别在道地产区种植了85-5、北京一号、沁怀、金九、白选5个地黄品种。分析了毛蕊花糖苷在不同时期的地黄块根和地黄叶片中的含量,为合理种植地黄和选择毛蕊花糖苷含量较高的新地黄品种提供数据依据和实验材料。
4.1 道地产区地黄种植和采收 于2015年和2016年4月中下旬种植。选取地黄块根直径2~4cm,分成1.5~2 cm的小段在10年没有种植且地势平坦、沙壤土、肥力好的地块垄作,双排种植。每年7月10日、7月30日、8月20日、9月20日、9月30日、10月10日、10月20日、10月30日、11月10日采集地黄块的根和叶片,从5个品种中随机抽取10株长势相当的地黄植株。将鲜地黄的根、叶洗净,将根切成约5 mm的小块,根和叶分别在55℃干燥和粉碎,然后通过药典3号筛,粉末放入烘干机备用[12]。
4.2 不同采收时期地黄块根毛蕊花糖苷的含量变化 为分析毛蕊花糖苷在不同品种、不同采收时期的地黄中的积累规律,课题组2年内检测了5个地黄品种的块根中毛蕊花糖苷的含量。2015年,5个品种的毛蕊花糖苷含量在7月至9月相对较低,10月后较高。85-5、北京一号、沁怀、金九和白选块茎中毛蕊花糖苷的含量分别为0.007%~0.253%、0.017%~0.304%、0.008%~0.212%、0.027%~0.461%、0.018%~0.796%。2016年,5种地黄块茎中毛蕊花糖苷的含量分别为0.017%~0.143%、0.019%~0.132%、0.017%~0.179%、0.023%~0.620%、0.067%~0.403%。在2015年的9个收获期中,白选的毛蕊花糖苷含量最高的有6期;2016年,白选毛蕊花糖苷含量最高的有7期,说明白选是5个地黄品种里毛蕊花糖苷含量较高的。2015年的9期里,沁怀有3期毛蕊花糖苷含量最高,2期第二;2016年,沁怀的毛蕊花糖苷含量2个时期第一,5个时期第二,说明沁怀的毛蕊花糖苷含量也比较高。另外,其他3个品种的毛蕊花糖苷含量相对于白选和沁怀来说较低。
4.3 不同采收期地黄叶片中毛蕊花糖苷含量的变化 分析了除枯叶外5个品种叶片(整叶)中毛蕊花糖苷的积累规律。2015年,85-5、北京1号和金九的叶片毛蕊花糖苷的含量分别为3.043%~5.783%、2.552%~5.941%和2.485%~4.763%,3个品种的毛蕊花糖苷含量都有3次最高。沁怀和白选的含量较低,分别为1.895%~3.887%和1.717%~5.995%。
2016年北京1号和金九的含量分别为1.955%~5.968%、0.681%~4.837%和1.950%~5.431%。3个品种毛蕊花糖苷含量最高的次数分别是7次,0次、2次。沁怀和白选的毛蕊花糖苷含量分别为1.189%~3.909%和0.693%~4.071%[12],毛蕊花糖苷含量略低。
4.4 不同发育阶段地黄叶片中毛蕊花糖苷含量的变化 为了分析毛蕊花糖苷的含量在地黄叶片不同生长发育阶段的差异,课题组在2015年和2016年分别检测了毛蕊花糖苷在北京1号和85-5的幼叶、展开叶和衰老叶中的含量。结果见图2。幼叶中毛蕊花糖苷的含量是3个时期的叶片中最低的。
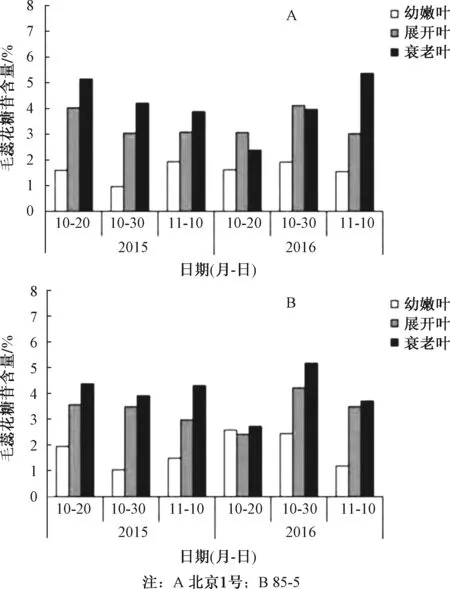
图2 不同发育阶段地黄叶片中毛蕊花糖苷含量变化
2015年:北京1号和85-5叶片在一年的3个收获期中毛蕊花糖苷含量变化规律相同,均为衰老叶>展开叶>幼叶。
2016年:10月20日和10月30日,北京1号毛蕊花糖苷含量为展开叶>衰老叶>幼叶;11月10日毛蕊花糖苷含量为衰老叶>展开叶>幼叶;在10月20日收获85-5时,毛蕊花糖苷含量在叶片发育的3个时期差异不明显。在10月30日和11月10日时,毛蕊花糖苷含量为衰老叶>展开叶>幼嫩叶。2015年和2016年的数据显示,毛蕊花糖苷在衰老叶片和展开叶片中的含量较高。
