微贮豆秸饲粮中添加维生素D对绵羊肠道健康的影响
2022-01-25韩红宇王天元陈昱筱庞全海
韩红宇,王 帅,王天元,陈昱筱,秦 红,李 振,庞全海*
(1.山西农业大学 动物医学学院,山西 太谷 030801;2.山西省忻州市忻府区畜牧兽医中心,山西 忻州 034000;3.山西省柳林县动物疫病预防控制中心,山西 柳林 033300;4.山西省阳曲县农业技术推广中心,山西 阳曲 030100;5.山西中医药大学 基础医学院,山西 榆次 030619)
众所周知,维生素D的主要功用是促进小肠黏膜细胞对钙和磷的吸收、调节机体钙磷代谢,并参与细胞的增殖和分化、机体免疫应答、机体的氧化应激及炎症反应等一系列过程[1-2]。近年有人提出了维生素D信号在肠道炎性疾病免疫中的作用[3-4],肠道NF-κB信号通路已成为胃肠免疫相关信号通路研究的热点[5-6],在肠道免疫及抗微生物感染中起着极为重要的作用[7]。但是,这些研究多限于人或水生动物[8],而在其他动物的研究报道较少。现有日粮中添加维生素D3对动物生长性能、肠道健康影响的报道[9-10],但尚未见有在微贮饲料中添加维生素D对于绵羊肠道形态及NF-κB信号通路影响的报道。因此,本研究旨在通过在微贮豆秸饲粮中添加不同水平维生素D探讨其对绵羊肠道形态和抗氧化功能以及肠道NF-κB信号通路的影响,阐明其对绵羊肠道健康的影响机制,进而为维生素D在豆秸饲料和绵羊生产中的合理利用提供科学基础。
1 材料与方法
1.1 实验动物25只体质量相似(18.51~22.95 kg)、临床健康的3月龄杜泊羊(♂)×小尾寒羊(♀)的F1公羔25只(由山西省柳林县汇源新盛养殖专业合作社提供),将羊随机分为5组,每组5只。
1.2 微贮豆秸按照参考文献[11]方法进行制作。
1.3 试验饲粮所有处理组均饲喂精料+微贮豆秸,对照组的VD3添加量为0,试验组的VD3添加量分别为300,600,900,1 200 IU/kg。各处理组基础饲粮配方及营养水平见表1,2。
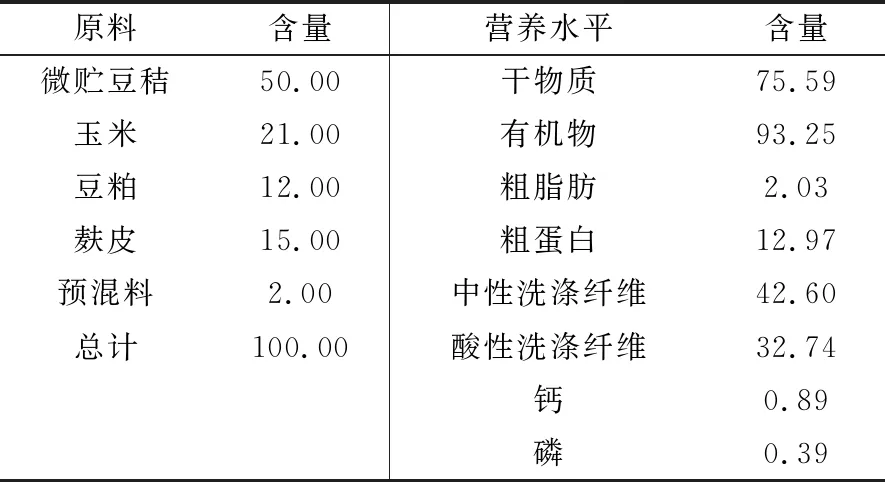
表1 基础饲粮配方及营养水平(干物质基础) %
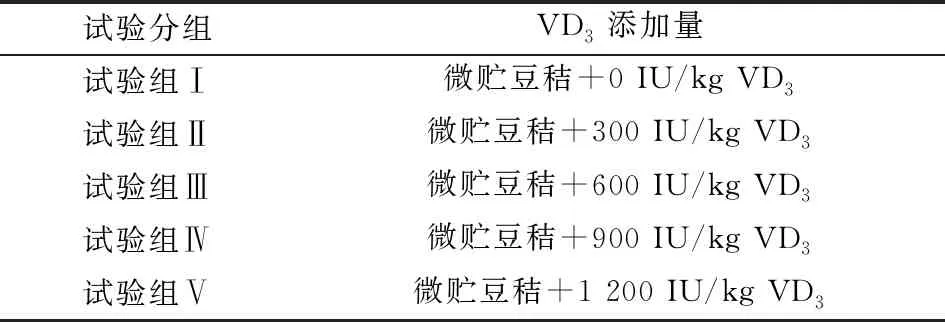
表2 试验分组及VD3添加量
1.4 主要试剂RNA提取试剂TRIzol(购自大连TaKaRa公司);PCR引物(购自华大基因测序公司);CAT测定试剂盒、T-SOD测定试剂盒、GSH-Px测定试剂盒、MDA测定试剂盒(均购自南京建成生物工程有限公司);RNA反转录试剂盒(购自加拿大abm公司)等。
1.5 主要仪器设备KD-BM生物组织包埋机(浙江省金华市益迪医疗设备厂);DMLB光学显微镜(美国Leica公司);漩涡振荡仪(海门市其林贝尔仪器有限公司);全波长多功能酶标仪(Thermo Forma公司);普通PCR仪(美国Bio-Rad公司);荧光定量PCR仪(美国Bio-Rad公司)等。
1.6 肠道形态观察试验期最后1 d采集绵羊十二指肠、空肠、回肠、结肠中部肠段(1 cm×2 cm)放入4%多聚甲醛中固定备用,之后镜检观察其绒毛高度、隐窝深度、并计算绒隐比。
1.7 肠道抗氧化性性能测定在试验期最后1 d,每组随机挑选4只绵羊进行屠宰取样,分别采集绵羊十二指肠、空肠、回肠、结肠,放入液氮中备用。用南京建成生物工程有限公司试剂盒测定CAT、T-SOD、GSH-Px、MDA的活性。
1.8 肠道NF-κB通路中相关因子测定从NCBI中选取试验所需的基因及内参18S RNA的mRNA序列,采用Pick Primer设计引物。所有引物由上海生工合成,引物信息见表3。

表3 PCR引物序列及相关信息
提取绵羊组织总RNA,将其反转录为cDNA,按Abm公司5×All-In-One RT MasterMix(with AccuRT Genomic DNA Removal Kit)进行荧光定量PCR,计算相对定量结果。本试验利用2-△△Ct法计算不同基因在肠道中的表达量。
1.9 结果处理试验结束后,先将数据采用Microsoft Office 2013中的Excel进行整理,然后用SPSS 17.0进行分析。
2 结果
2.1 维生素D对绵羊肠道形态的影响由表4可知,VD3添加剂量为300 ~1 200 IU/kg时均可极显著升高十二指肠绒毛高度(P<0.01),且添加量为600 IU/kg时,差异最高;添加量为300~900 IU/kg时,可极显著降低隐窝深度(P<0.01),而添加量为1 200 IU/kg时,这种差异不再极显著(P<0.05);各试验组均可极显著升高十二指肠绒隐比(P<0.01),且添加量为600 IU/kg时,差异最高(图1)。
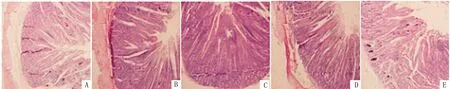
A.对照组;B~E.试验组(VD3添加剂量分别为300,600,900,1 200 IU/kg)
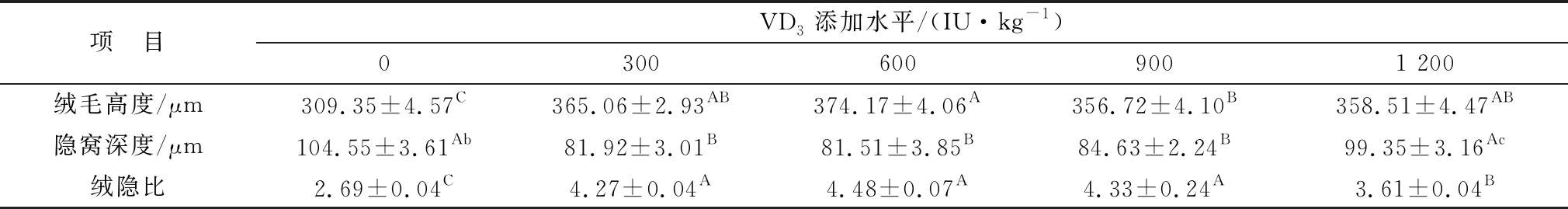
表4 微贮豆秸饲料中添加维生素D对绵羊十二指肠形态的影响
由表5可知,VD3添加量为300,600,900 IU/kg时可极显著升高绵羊空肠绒毛高度(P<0.01),且添加量为600 IU/kg时差异最高;而添加量为1 200 IU/kg时无显著性差异(P>0.05);添加量为600~1 200 IU/kg时,可极显著降低空肠隐窝深度(P<0.01);各试验组均可极显著升高绒隐比(P<0.01),且添加量为600 IU/kg时差异最高(图2)。
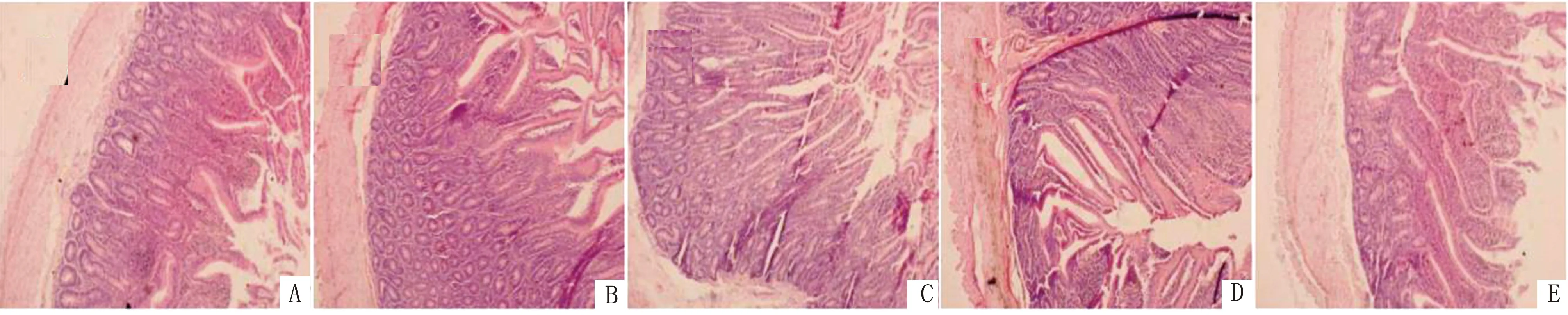
A.对照组;B~E.试验组(VD3添加剂量分别为300,600,900,1 200 IU/kg)
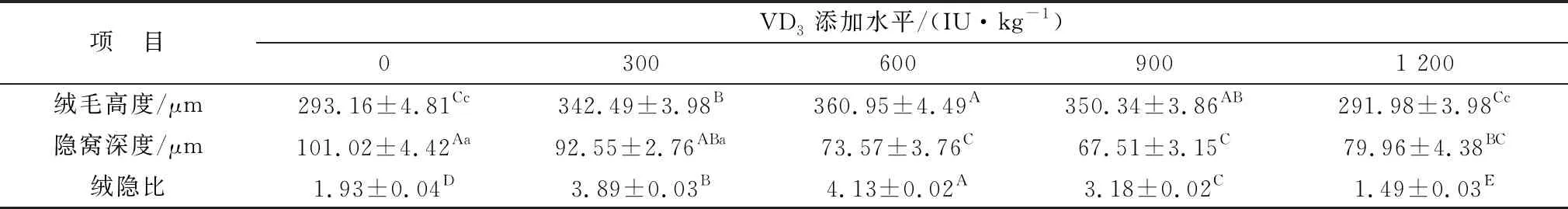
表5 微贮豆秸饲料中添加维生素D对绵羊空肠形态的影响
由表6可知,添加300,600,900 IU/kg VD3可极显著升高回肠绒毛高度且降低隐窝深度(P<0.01);而添加量为1 200 IU/kg时,差异不显著(P>0.05);各试验组均可极显著升高回肠绒隐比(P<0.01),且添加量为600 IU/kg时差异最高(图3)。
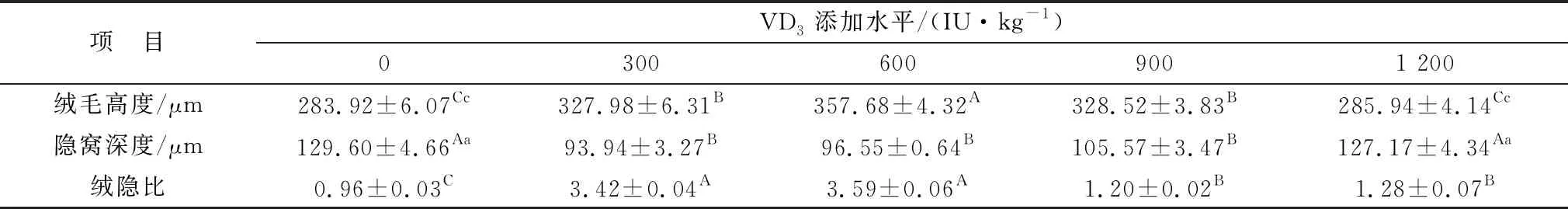
表6 微贮豆秸饲料中添加维生素D对绵羊回肠形态的影响
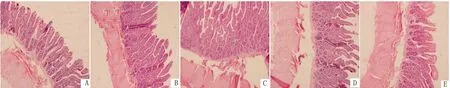
A.对照组;B~E.试验组(VD3添加剂量分别为300,600,900,1 200 IU/kg)
由表7可知,添加300,600,1 200 IU/kg VD3可极显著升高结肠绒毛高度(P<0.01);各试验组均可极显著降低结肠隐窝深度(P<0.01);添加300~900 IU/kg VD3可极显著升高绵羊结肠绒隐比;而添加量为1 200 IU/kg时差异不显著(P>0.05)(图4)。

表7 微贮豆秸饲料中添加维生素D对绵羊结肠形态的影响
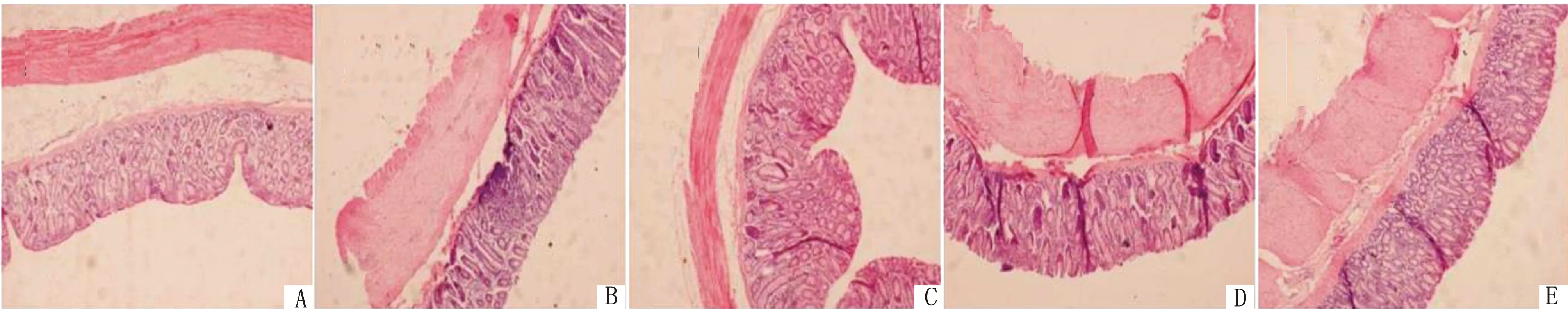
A.对照组;B~E.试验组(VD3添加剂量分别为300,600,900,1 200 IU/kg)
2.2 维生素D对绵羊肠道抗氧化性的影响由表8可知,添加300,900,1 200 IU/kg VD3可显著升高绵羊十二指肠CAT(P<0.05)活性;添加300,600,1 200 IU/kg VD3可极显著升高T-SOD(P<0.01)活性;各试验组均可极显著升高GSH-Px活性,显著降低MDA(P<0.05)活性,且添加量为600 IU/kg时差异最大。
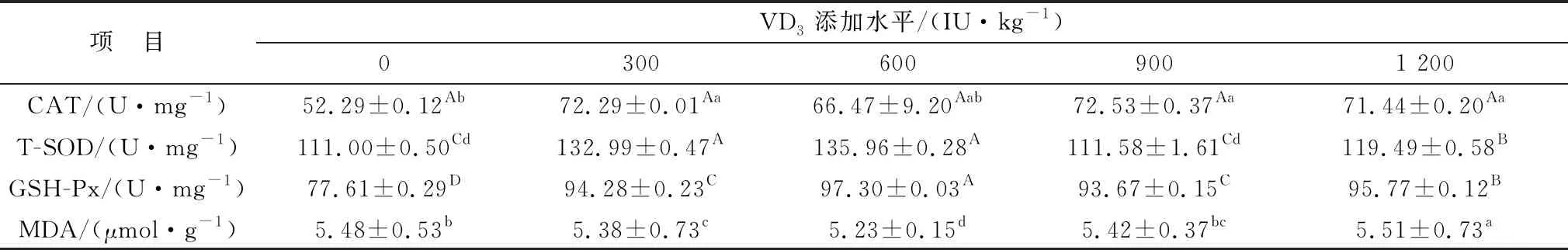
表8 微贮豆秸饲料中添加维生素D对绵羊十二指肠抗氧化性的影响
由表9可知,在空肠中,各试验组均可极显著升高CAT、T-SOD、GSH-Px(P<0.01)活性,且添加量为600 IU/kg时差异最大;添加300,600,900 IU/kg VD3可显著降低MDA(P<0.05)活性,而添加量为1 200 IU/kg VD3时,显著升高MDA(P<0.05)活性。

表9 微贮豆秸饲料中添加维生素D对绵羊空肠抗氧化性的影响
由表10可知,在回肠中,各试验组添加VD3均可极显著升高CAT、T-SOD、GSH-Px(P<0.01)活性,且添加量为600 IU/kg时差异最大;添加量为300,600,900 IU/kg VD3时可极显著降低MDA(P<0.01)活性,而添加量为1 200 IU/kg时差异不显著(P>0.05)。
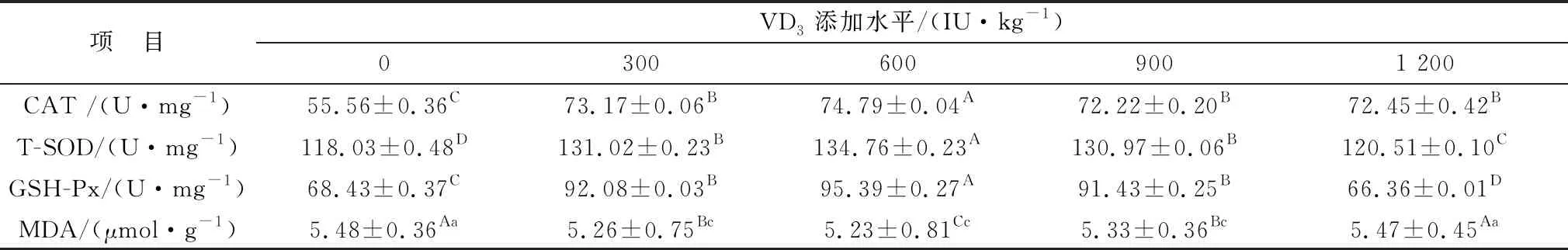
表10 微贮豆秸饲料中添加维生素D对绵羊回肠抗氧化性的影响
由表11可知,在结肠中,添加300,600,900 IU/kg VD3可极显著升高肠道CAT(P<0.01)活性;添加600,900,1 200 IU/kg VD3可极显著升高T-SOD(P<0.01)活性,且添加量为600 IU/kg时,差异最显著;各试验组均可极显著升高GSH-Px(P<0.01)活性,显著降低MDA(P<0.05)活性。
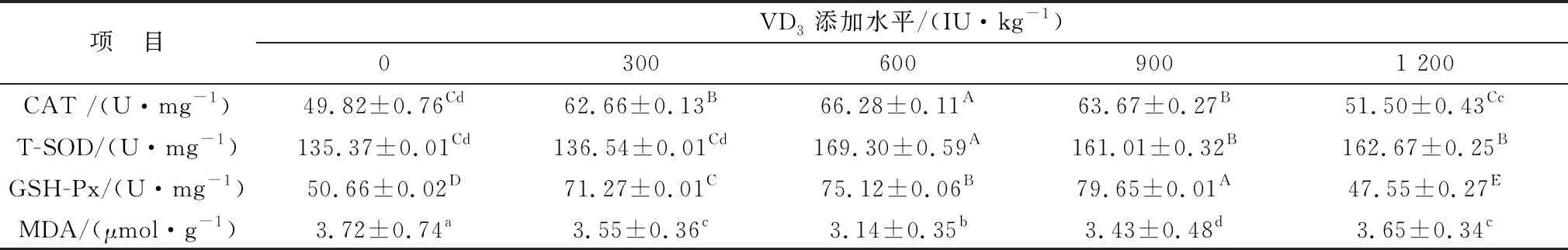
表11 微贮豆秸饲料中添加维生素D对绵羊结肠抗氧化性的影响
2.3 维生素D对绵羊肠道mRNA表达量及NF-κB信号通路的影响由图5可知,添加300,600,900 IU/kg VD3可极显著降低绵羊各肠道TLR4 mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3对结肠TLR4 mRNA表达量的影响差异不显著(P>0.05)。
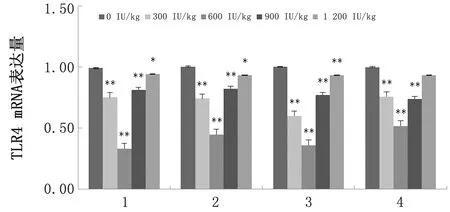
1.十二指肠;2.空肠;3.回肠;4.结肠。*.P<0.05,**.P<0.01。下同
由图6可知,添加300,600,900 IU/kg VD3可极显著降低绵羊各肠道MyD88 mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3对十二指肠、空肠MyD88 mRNA表达量的影响差异不显著(P>0.05)。
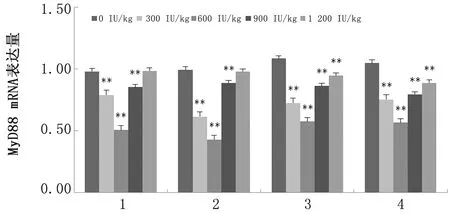
1.十二指肠;2.空肠;3.回肠;4.结肠
由图7可知,添加300,600,900 IU/kg VD3可极显著降低绵羊各肠道TRAF6 mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3对十二指肠TRAF6 mRNA表达量的影响差异不显著(P>0.05)。

1.十二指肠;2.空肠;3.回肠;4.结肠
由图8可知,添加300,600,900 IU/kg VD3可极显著降低绵羊各肠道IL-1β mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3十二指肠IL-1β mRNA表达量的影响差异不显著(P>0.05)。

1.十二指肠;2.空肠;3.回肠;4.结肠
由图9可知,添加300,600,900 IU/kg VD3可极显著降低绵羊肠道VDR mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3对回肠VDR mRNA表达量无显著影响(P>0.05)。
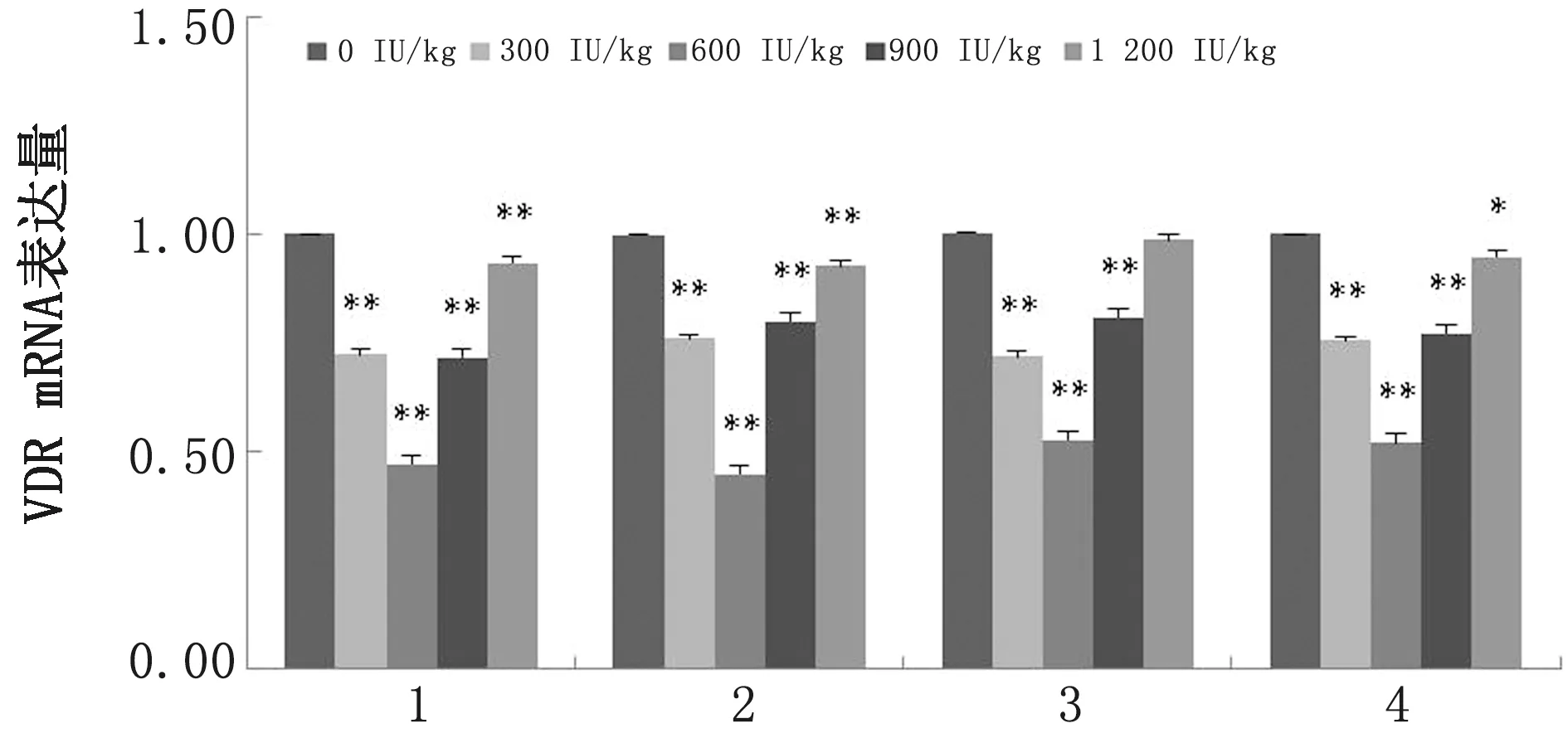
1.十二指肠;2.空肠;3.回肠;4.结肠
由图10可知,添加300,600,900 IU/kg VD3可极显著降低绵羊肠道NF-κB1 mRNA表达量(P<0.01),且添加量为600 IU/kg差异最显著;添加1 200 IU/kg VD3对十二指肠、回肠、结肠NF-κB1 mRNA表达量的影响差异不显著(P>0.05)。

1.十二指肠;2.空肠;3.回肠;4.结肠
3 讨论
3.1 微贮饲料中添加维生素D对绵羊肠道形态的影响本课题组前期的研究表明,微贮处理豆秸可以显著提高绵羊对有机物、粗蛋白、中性洗涤纤维和酸性洗涤纤维的表观消化率,提高肠道抗氧化性[11-12]。本试验研究表明,日粮中适量添加维生素D3可改善绵羊肠道形态,饲粮中添加300~900 IU/kg VD3可显著或极显著升高绵羊各肠段的绒毛高度并且降低隐窝深度,表明微贮豆秸中添加维生素D可以有效改善肠道形态结构、提高肠道消化吸收能力和免疫力。这与下列相关研究一致,CHOU等[13]研究表明,日粮中持续添加维生素D3可提高肉鸡十二指肠和空肠的绒毛长度,降低隐窝深度,增加绒隐比;张振祥[14]研究表明,日粮中添加250 IU/kg VD3时,可显著提高断奶仔猪第7天绒毛高度。研究表明,维生素D在维持肠道屏障的完整性方面具有一定作用[15],肠上皮位于肠道基底膜上黏膜表面,构成肠屏障,在管腔表面,杯状细胞可分泌一层高度糖基化的黏蛋白进一步促进屏障的形成。维生素D可以提高肠道黏膜上皮细胞中紧密连接蛋白Claudin-1、Occludin和ZO-1的表达[16]。此外,VDR信号可通过肌球蛋白轻链激酶(MLCK)参与控制肠道屏障的完整性[17]。因此,适宜浓度的维生素D可通过提高各种紧密连接蛋白的表达而改善动物肠道形态。
3.2 微贮饲料中添加维生素D对绵羊肠道抗氧化性的影响肠道发生氧化应激损伤时,抗氧化防御系统无法从体内去除多余的ROS。彭峰[18]研究表明,1,25(OH)2D3可能通过VDR信号通路抑制高糖诱导的细胞氧化应激。李向等[19]研究表明饲料中添加维生素D3可以显著提高黑鲈肝脏中SOD、CAT活性和总抗氧化能力,显著降低血清中AST活力;王丽丽等[20]也认为,基础日粮中添加VD3,随着添加量的升高,肠道T-SOD活力呈先上升后下降趋势,MDA含量呈下降趋势。本试验研究结果表明,日粮中添加300~900 IU/kg VD3可显著提高各肠段CAT、T-SOD和GSH-Px活性,降低各肠段中MDA含量,表明微贮豆秸中添加适量维生素D能够提高其肠道抗氧化能力,且维生素D添加量为600 IU/kg时达峰值区。这与前人研究结果相似。机体通过新陈代谢不断地产生能量以供机体使用,而帮助能量转换的自由基也由此产生[21]。一方面自由基能够帮助能量转换,另一方面失去了控制的自由基也会对机体产生损害。当自由基失去控制时,体内的抗氧化酶便会清除自由基以维持机体的正常生理活动[22]。本试验结果表明,微贮饲料中添加适宜浓度VD3后,CAT、T-SOD和GSH-Px活性均有所升高,MDA含量有不同程度的降低。这可能是因为VD3在代谢过程中,产生了大量氧自由基,进而提高了肠道的抗氧化能力[23]。
3.3 维生素D与绵羊肠道NF-κB信号通路的关系NF-κB是调节涉及炎症反应的关键基因之一,它诱导了各种炎症标记基因的转录,并通过一系列炎症细胞因子和趋化因子mRNA的表达控制最终的免疫反应。NF-κB通常以p50、p60结合形成的异二聚体形式存在。在细胞质中,与NF-κB抑制蛋白(IKB)结合,并以异寡聚物的形式保持非活性状态[24]。TLR4-MyD88-NF-κB信号通路是作为关联炎性反应的重要通路之一,它的激活可诱导下游炎症因子的释放,诱导产生IL-1、IL-6、肿瘤坏死因子α(TNF-α)等。研究表明,TLR4通过白细胞介素-1(toll interleukin-1 receptor domain,TIR)受体结构域,利用TIR受体结构域接头蛋白、MyD88、IL-1R相关激酶、TRAF6等,诱导通路下游NF-κB的活化,活化的NF-κB暴露出核定位序列,从而进入核内与DNA特定位点结合,产生并释放细胞因子,形成炎症反应[25]。SHEN等[26]研究认为,黄芩苷可以通过调节IKK/IKB/NF-κB 信号通路及凋亡相关蛋白显著抑制氧化应激所致溃疡性肠炎的肠道炎症;MOHAMED等[27]研究表明辅酶Q10可以通过抑制NF-κB/TGF-β/MMP-9通路弱化放射性肠病引起的炎症和纤维变性而维持辐射暴露后肠黏膜的完整性,证明辅酶Q10通过抑制NF-κB弱化辐射诱导的肠炎;PISTOL等[28]研究证明日粮中含有葡萄籽活性物质可以通过抑制MAPKs和 NF-κB信号通路改善右旋糖酐诱导的猪结肠炎的肠道炎症。亦有研究表明,VD3可通过改变NF-κB炎性体途径来减弱小鼠牙龈卟啉单胞菌诱导的牙周炎[29]。已经证明,1,25(OH)2D3能够调节NF-kB信号通路,从而抑制炎症反应。1,25-(OH)2D3通过与VDR结合,增加抑制蛋白IκBa的mRNA表达及减少其磷酸化等途径来抑制NF-κB信号通路[30]。除此经典途径外,1,25-(OH)2D3还通过调节NF-κB上游的其他因子对其进行调控。本试验结果表明,微贮饲料中添加300,600,900 IU/kg VD3均可极显著降低TLR4、MyD88、NF-κB以及通路下游炎症因子TRAF6、IL-1β、NF-κB1、VDR mRNA的表达量,并成剂量依赖关系,因此,日粮中添加适量VD3可抑制绵羊肠道炎性反应的发生。
