睾酮对水牛卵泡颗粒细胞雌激素合成能力的影响
2022-01-25汪浩鑫陈梦佳卢嘉卡石德顺陆凤花
张 俊,汪浩鑫,陈梦佳,闫 茜,卢嘉卡,余 庆,石德顺,陆凤花
(广西大学 动物科学技术学院/亚热带农业生物资源保护与利用国家重点实验室,广西 南宁 530004)
颗粒细胞(granulosa cells,GCs)在卵泡发育和闭锁过程中起至关重要作用,一方面GCs控卵泡闭锁[1-8],另一方面GCs分泌雌激素,雌激素能促进卵泡发育和抑制GCs凋亡,卵泡的发育闭锁与GCs状态密切相关[9-11]。以卵泡内膜细胞分泌雄激素作为底物,在雌激素合成关键酶细胞色素芳香化酶(CYP19A1)作用下,同时在促卵泡素(FSH)调控下,GCs合成雌激素雌二醇促进卵泡生长[12-14]。
卵巢内雄激素主要是雄烯二酮和睾酮,在细胞色素17β羟类固醇脱氢酶(17β-HSD)作用下,雄烯二酮可转化为睾酮。有研究报道睾酮可通过激活PI3K/AKT/FOXO3信号通路诱导小鼠原始卵泡的激活[15]。有研究指出睾酮能促进牛卵巢初级卵泡向次级卵泡的转变,且直接通过睾酮受体发挥其调节作用[16]。也有研究表明睾酮可直接通过其受体发挥作用,通过提高间隙连接蛋白CX37表达促进小鼠卵巢发育[17]。但睾酮对水牛GCs雌激素合成的影响,目前尚未见有报道。本研究通过在水牛GCs培养液中添加睾酮,探讨睾酮对水牛GCs雌激素合成相关基因表达和雌二醇分泌水平的影响,进而研究睾酮对水牛GCs雌激素合成能力的影响,以期从雌激素合成角度为进一步研究水牛卵泡发育雌激素分泌机理奠定基础。
1 材料与方法
1.1 主要试剂及配制睾酮(testosterone,Tes)购自Solarbio公司;DMEM和血清(FBS)购自Gibco公司;其他试剂无特别说明均购自Sigma公司。细胞培养液:DMEM+10%FBS+60 mg/L青霉素+100 mg/L链霉素,并用0.22 μm微孔滤器过滤。
1.2 材料来源及处理
1.2.1水牛卵巢的收集 从南宁市屠宰场收集中国沼泽型水牛卵巢,收集后放置盛有37℃生理盐水的保温瓶,确保2~3 h内送达实验室。用眼科剪刀将卵巢周围的脂肪组织去除,用一次性12号10 mL注射器抽取直径2~6 mm卵泡(大卵泡闭锁比例较高,小卵泡发育程度较低)的卵泡液,将卵泡液移至60 mm玻璃皿,体式显微镜下观察卵泡液中GCs状态,注意只选取来源于健康卵泡的水牛GCs进行后续试验。
1.2.2水牛GCs的分离培养 将抽取卵泡液用孔径40 μm细胞筛过滤,并收集到离心管,1 200 r/min离心5 min,弃上清后用双抗盐酸盐缓冲液(PBS)重悬清洗细胞,离心再用PBS重悬,如此反复1次,最后将清洗干净的水牛GCs接种至60 mm细胞培养皿进行培养。选取第1代生长状态良好水牛GCs,传至12孔板4个孔中,确保每孔细胞贴壁后汇合度至少达到80%,进行后续睾酮处理相关试验。
1.3 细胞免疫荧光将水牛原代GCs接种到四孔板培养,待细胞汇合度达到80%左右,弃去培养液,用PBS清洗3次,再加4%多聚甲醛溶液室温固定30 min;用阻断液(含100 mmol/L甘氨酸和0.3%BSA的PBS)清洗3次,然后加入1%Tritonx-100室温透化15 min;再用5%牛血清白蛋白(BSA)室温封闭2 h;用TBP(Tritonx-BSA-PBS)清洗3次,加入一抗4℃孵育过夜;第2天室温孵育30 min,用TBP清洗3次,加入二抗室温孵育1 h;用TBP清洗3次,然后在荧光显微镜下观察染色结果。
1.4 RNA提取、反转录和实时定量RT-PCR使用TRIzol试剂裂解已收集的水牛GCs,氯仿和异丙醇抽提,75%酒精清洗,DEPC水溶解即得到细胞总RNA。采用反转录试剂盒HiScript Ⅲ RT Super Mix合成cDNA,然后用SYBP Premix Ex TaqTMⅡ试剂进行qRT-PCR。本研究所用引物序列如表1所示,使用GAPDH作为内参基因标准化其他基因表达。

表1 水牛GCs qRT-PCR引物序列及条件反应
1.5 酶联免疫吸附反应采用酶联免疫吸附反应(ELISA)检测水牛GCs培养液中雌激素雌二醇的分泌水平。将水牛GCs培养液收集后,按照ELISA试剂盒说明书(江苏晶美生物科技有限公司)要求进行样品的预处理和后续试验步骤,用酶标仪检测450 nm波长处的吸光度值。根据所做标准曲线图,得出水牛GCs培养液雌二醇的含量。
1.6 试验设计试验1:本试验主要探讨细胞培养液中添加不同浓度睾酮对水牛GCs雌激素合成相关基因表达的影响。将处于相同细胞来源和生长状态的水牛GCs分别在添加不同浓度睾酮(0,10-9,10-7,10-5mol/L)的培养液中均处理48 h,检测水牛GCs雌激素合成相关基因(CYP11A1、CYP19-A1、3β-HSD和17β-HSD)的表达情况。
试验2:本试验主要探讨细胞培养液中添加不同浓度睾酮对水牛GCs雌二醇分泌水平的影响。将处于相同细胞来源和生长状态的水牛GCs分别在添加不同浓度睾酮(0,10-9,10-7,10-5mol/L)的培养液中均处理48 h,检测水牛GCs培养液中雌二醇的分泌水平。
试验3:本试验主要探讨细胞培养液中不同睾酮处理时间对水牛GCs雌激素合成相关基因表达的影响。将处于相同细胞来源和生长状态的水牛GCs分别在添加睾酮浓度10-7mol/L的培养液中处理不同时间(0,24,48,72 h),检测水牛GCs雌激素合成相关基因(CYP11A1、CYP19A1、3β-HSD和17β-HSD)的表达情况。
试验4:本试验主要探讨细胞培养液中不同睾酮处理时间对水牛GCs雌二醇分泌水平的影响。将处于相同细胞来源和生长状态的水牛GCs分别在添加睾酮浓度10-7mol/L的培养液中处理不同时间(0,24,48,72 h),检测水牛GCs培养液中雌二醇的分泌水平。
1.7 数据分析利用SPSS 22.0软件对统计数据进行处理并分析差异显著性,P<0.05表示差异显著,P>0.05表示差异不显著,每个试验至少3次生物学重复(n=3),即同一试验处理中用相互独立的水牛GCs进行至少3次重复。坐标图中柱状图上所标字母不同均表示差异显著(P<0.05),所标字母相同均表示差异不显著(P>0.05)。
2 结果
2.1 水牛卵泡GCs的分离、培养和鉴定选择直径为2~6 mm的水牛卵泡用于分离水牛GCs(图1A)。结果显示:水牛原代GCs贴壁后呈现成纤维细胞状,传代3次后,仍能保持典型GCs形态(图1B);免疫荧光试验表明水牛GCs表达其特异性蛋白FSHR(图1C)。 由此说明,本研究所分离获得细胞为高纯度水牛GCs,可作为后续研究的试验材料。
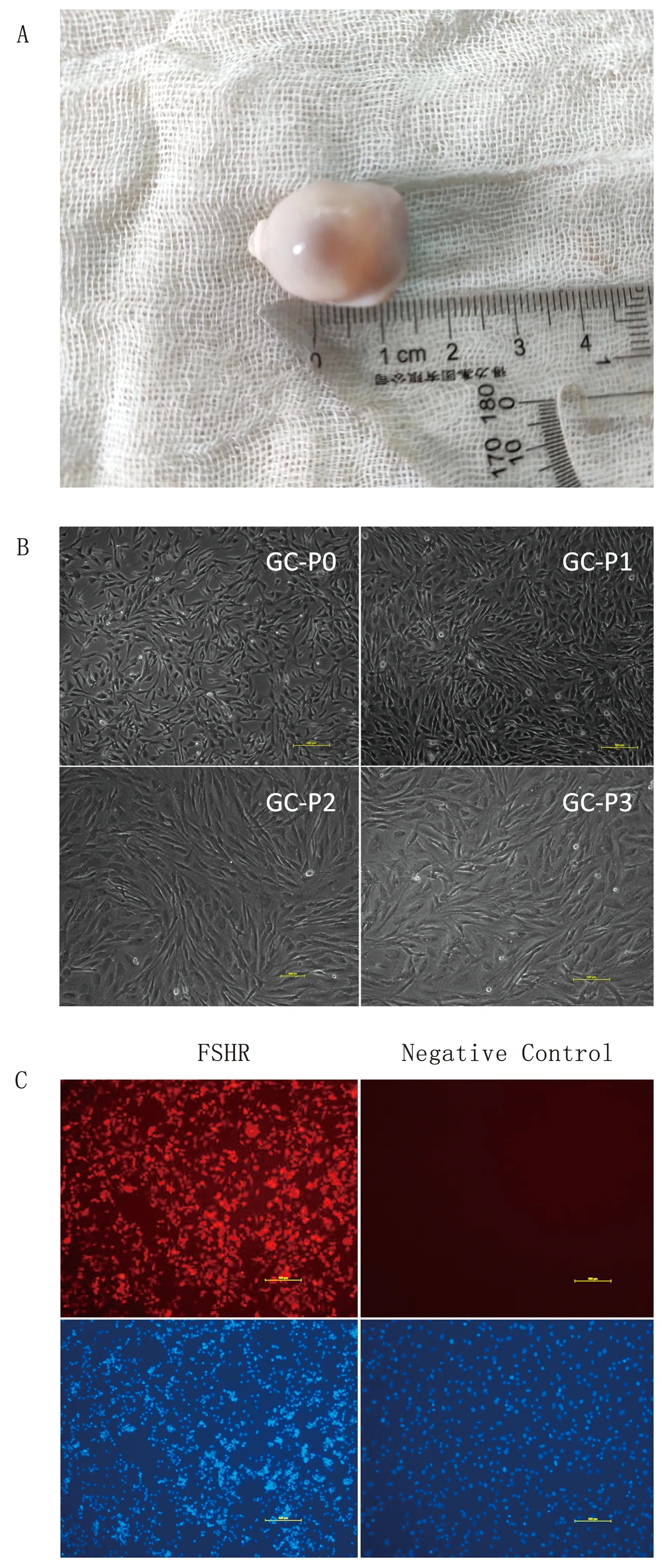
A.直径2~6 mm窦状健康卵泡用于分离水牛GCs;B.原代水牛GCs以及第1~3代水牛GCs贴壁后细胞生长状态;C.细胞免疫荧光试验显示水牛GCs表达其特异性蛋白FSHR
2.2 睾酮处理浓度对水牛GCs雌激素合成相关基因表达的影响水牛GCs分别在添加不同浓度睾酮(0,10-9,10-7,10-5mol/L)的培养液中处理48 h后,qRT-PCR检测水牛GCs雌激素合成相关基因(CYP11A1、CYP19A1、3β-HSD和17β-HSD)表达情况。结果显示(图2):相比对照组(0 mol/L睾酮),10-7mol/L睾酮处理组水牛GCs显著上调雌激素合成相关基因CYP11A1、CYP19A1、3β-HSD和17β-HSD表达(P<0.05),但10-5mol/L睾酮处理组水牛GCs显著下调雌激素合成相关基因CYP19A1、3β-HSD和17β-HSD表达(P<0.05)。由此初步说明,水牛GCs培养液中睾酮处理浓度以10-7mol/L最佳。
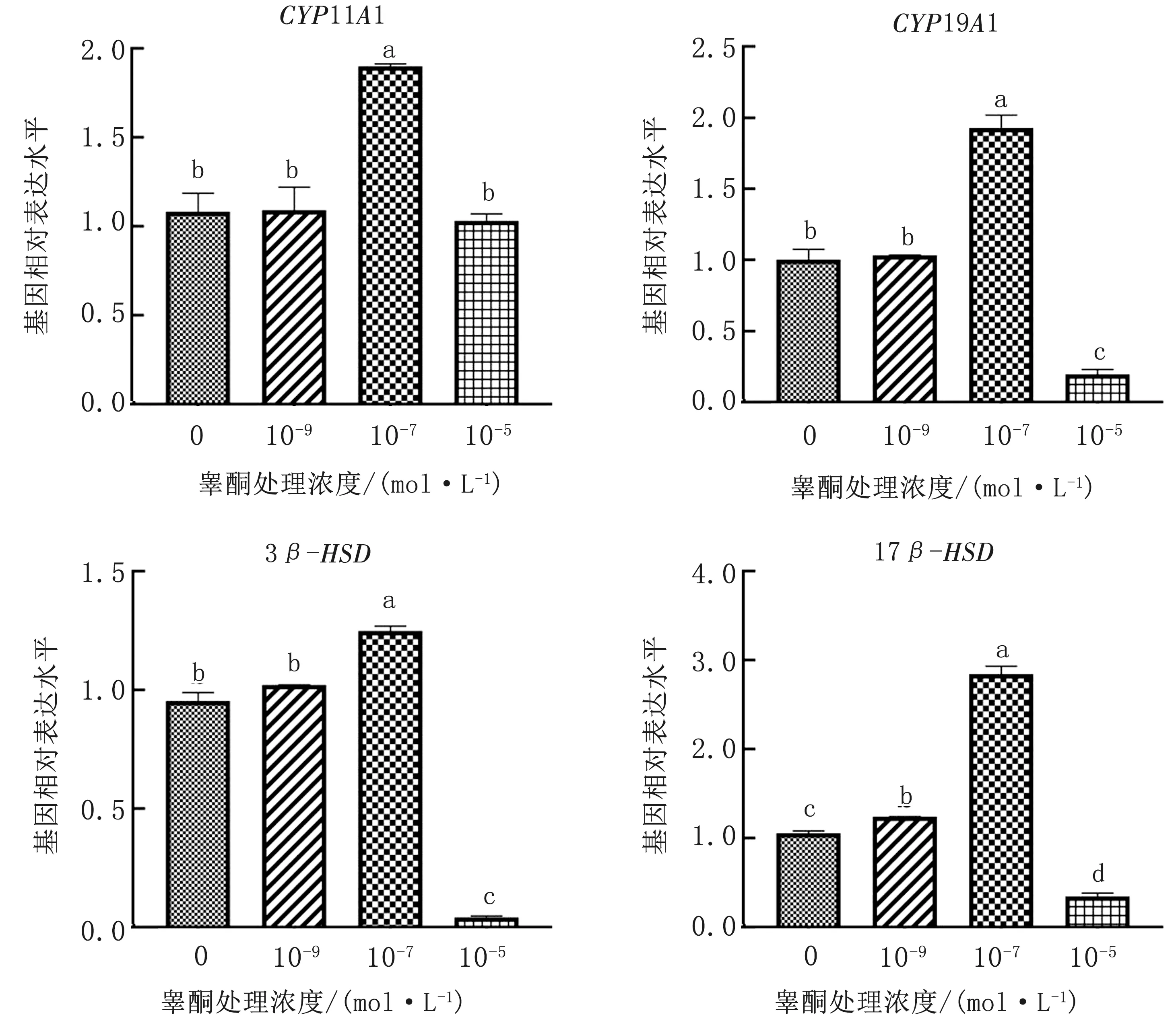
图2 qRT-PCR检测睾酮不同处理浓度对水牛GCs雌激素合成相关基因表达的影响
2.3 睾酮处理浓度对水牛GCs雌激素分泌水平的影响水牛GCs分别在添加不同浓度睾酮(0,10-9,10-7,10-5mol/L)的培养液中处理48 h后,ELISA检测水牛GCs培养液中雌二醇分泌水平情况。结果显示(图3):相比对照组(0 mol/L睾酮),10-7mol/L睾酮处理组显著提高水牛GCs培养液中雌二醇的分泌水平(P<0.05),但10-5mol/L睾酮处理组显著降低水牛GCs培养液中雌二醇的分泌水平(P<0.05)。由此进一步说明,水牛GCs培养液中睾酮最佳处理浓度为10-7mol/L。

图3 ELISA检测睾酮不同处理浓度对水牛GCs培养液中雌二醇分泌水平的影响
2.4 睾酮处理时间对水牛GCs雌激素合成相关基因表达的影响水牛GCs在添加睾酮浓度为10-7mol/L的培养液中处理不同时间(0,24,48,72 h)后,qRT-PCR检测水牛GCs雌激素合成相关基因(CYP11A1、CYP19A1、3β-HSD和17β-HSD)表达情况。结果显示(图4):相比对照组(睾酮处理时间0 h),睾酮处理48和72 h组水牛GCs显著上调雌激素合成相关基因CYP11A1、CYP19A1和3β-HSD表达(P<0.05)。由此初步说明,水牛GCs培养液中睾酮处理时间以48或72 h 最佳。
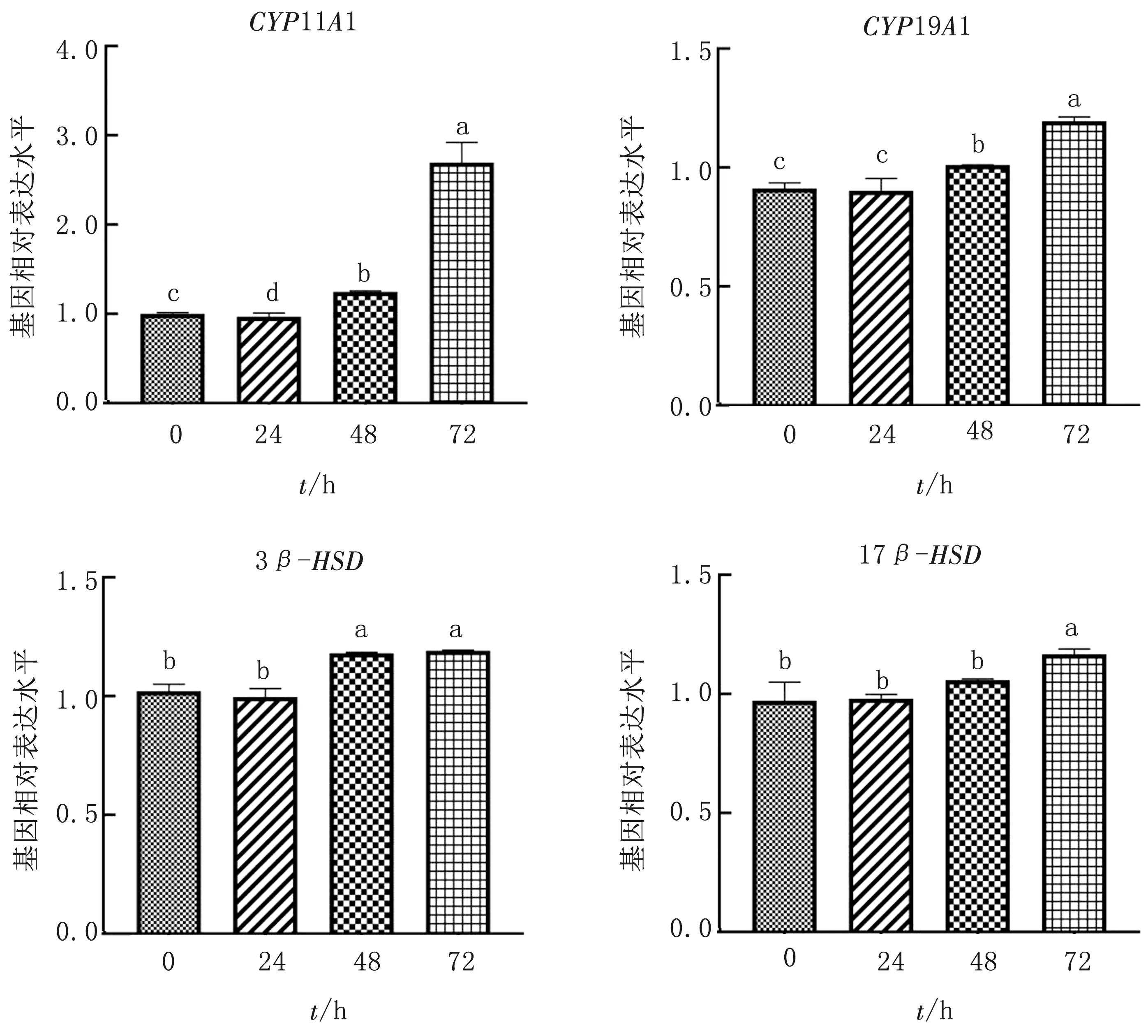
图4 qRT-PCR检测睾酮不同处理时间对水牛GCs雌激素合成相关基因表达的影响
2.5 睾酮处理时间对水牛GCs雌激素分泌水平的影响水牛GCs在添加睾酮浓度为10-7mol/L 的培养液中处理不同时间(0,24,48,72 h)后,ELISA检测水牛GCs培养液中雌二醇分泌水平情况。结果显示(图5):相比对照组(睾酮处理时间0 h),睾酮处理48或72 h组显著提高水牛GCs培养液中雌二醇的分泌水平(P<0.05)。由此进一步说明,水牛GCs培养液中睾酮最佳处理时间是48 或72 h。
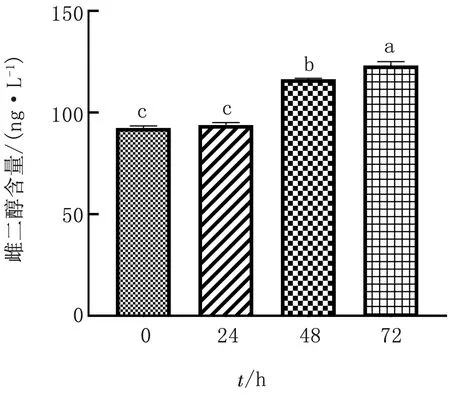
图5 ELISA检测睾酮不同处理时间对水牛GCs培养液中雌二醇分泌水平的影响
综合上述:10-7mol/L睾酮处理水牛GCs 48或72 h有利于提高水牛GCs雌激素的合成能力。
3 讨论
水牛是我国南方主要大家畜之一,因其具有适应性强、耐高温耐高湿、抗病力强、耐粗饲易饲养、乳品价值高和使用年限长等生物学特性,而具有巨大经济效益和社会效益[18-23]。然而目前水牛存在繁殖率低、种群生产性能低下等问题,因此,开展水牛卵泡发育激素分泌机制相关研究可为提高水牛繁殖力以及加快水牛遗传改良步伐等提供基础理论依据。根据双细胞-双促性腺激素理论,卵巢内雌激素主要由GCs分泌,卵泡在促黄体素的作用下,卵泡内膜细胞产生睾酮进入GCs,促卵泡素刺激GCs芳香化酶活性,在该酶催化下睾酮转化为雌二醇。GCs合成雌激素是在促卵泡素调控下,细胞表达雌激素合成相关基因CYP11A1、CYP19-A1、3β-HSD和17β-HSD,其中CYP19A1编码雌激素合成关键限速酶[13,24-28]。本研究结果表明,10-7mol/L睾酮处理水牛GCs 48或72 h,不但提高水牛GCs雌激素合成相关基因CYP11A1、CYP19A1和3β-HSD表达,而且促进水牛GCs培养液中雌二醇分泌水平。该结果说明睾酮能提高水牛GCs雌激素的合成能力,这与内膜细胞条件液影响水牛GCs雌激素合成能力的结果类似[29]。
水牛GCs和内膜细胞互作的最新研究表明,水牛内膜细胞条件液能促进水牛GCs雌激素的合成能力,且水牛内膜细胞主要分泌雄激素睾酮到内膜细胞条件液中[30]。而本研究结果也显示,睾酮能提高水牛GCs雌激素的合成能力,这更进一步证实了水牛GCs和内膜细胞互作的研究结果。但睾酮促进水牛GCs雌激素合成的调控机理仍有待进一步探讨,特别是睾酮添加到水牛GCs培养液中,究竟是通过直接作用即增加了GCs雌激素合成芳香化酶作用的底物进而促进雌激素合成,还是通过间接作用即激活了GCs雌激素合成调控的相关信号通路进而促进雌激素合成,这将是我们下一步重点研究的内容。
同时,本研究指出睾酮能提高水牛GCs雌激素的合成,那么睾酮在水牛卵泡发育过程中,对水牛原始卵泡的体外激活、腔前卵泡的体外培养、卵母细胞的体外成熟甚至早期胚胎的体外发育是否会有影响,以及产生这些影响的调控机制,这些课题是我们更希望探究的。相信随着研究的逐渐深入和系统,雄激素调控卵泡发育的相关研究结果,将为更进一步研究水牛卵泡发育的激素调控规律奠定坚实基础。
