中国荷斯坦奶牛GPR120基因SNP位点鉴定及其与产奶性能的关联分析
2022-01-25邹紫雯李鑫丽王斯琦赵志辉沈冰蕾
邹紫雯,罗 林,刘 娟,韩 硕,李鑫丽,宛 麟,王斯琦,赵志辉,沈冰蕾*
(1.黑龙江八一农垦大学 动物科技学院,黑龙江 大庆 163319;2.广东海洋大学 农学院,广东 湛江 524088)
随着世界人口的剧增,牛奶及牛奶衍生品在世界各地正飞速扩张,牛奶及其衍生品具有人体所需的维生素、矿物质、必需氨基酸等多种营养物质,且物美价廉极容易吸收等特点,显然已成为人类不可或缺的食物。由于全世界对牛奶消费量的激增,产奶量需求增加,相应的牛奶中的营养品质逐渐降低,因此研究人员也在时刻关注牛奶的品质控制与改良,而乳脂是乳品质调控的主要目标性状,也是评价牛奶质量高低反映奶产品行业经济效益的主要指标之一。牛奶中乳脂合成所需的脂肪酸主要来源于以下2个部分:第1部分为乳腺上皮细胞利用乙酸、β-羟丁酸等前体物质在乙酰辅酶A羧化酶1(acetyl-coenzyme A carboxylase alpha,ACC1)和脂肪酸合成酶(fatty acid synthase,FAS)的催化下进行脂肪酸从头合成。第2部分为食物消化吸收的长链脂肪酸,借助载脂蛋白从血液中摄取[1]。而影响乳脂率的因素主要为日粮配方、品种因素、遗传背景、生理病理因素、气候条件等[2]。其中在个体间影响牛奶中乳脂差异的主要因素为乳脂合成及调控相关基因的遗传多态性。
G蛋白偶联受体(G protein-coupled receptors,GPCRs) 作为最大的膜结合受体家族,其家族成员能够与许多激素、神经肽、趋化因子或化学传感器结合而引起信号转导[3]。GPR120是G蛋白偶联受体GPCRs中被较晚发现的一员,其作为受体蛋白能够被内源性和膳食游离脂肪酸(FFA)激活从而参与一系列的代谢反应及炎症过程[4]。在肝脏代谢中,KAZUO等[5]研究表明,通过二十二碳六烯酸(DHA)激活GPR120抑制了饲喂CDAHF(0.1%蛋氨酸和胆碱缺乏高脂肪)小鼠体内炎性细胞因子,并防止了纤维化,预防了非酒精性脂肪性肝炎(NASH)的产生。在癌症方面,GPR120基因可以调控肿瘤细胞的生长增殖、细胞凋亡、侵袭转移和化疗耐药[6]。此外研究者发现,在食道癌组织中GPR120的表达显著高于正常组织,且敲低GPR120后显著降低体外食道癌细胞增殖、克隆形成、迁移和侵袭,并降低体内肿瘤生长[7]。而近年来越来越多的研究表明GPR120在脂代谢中起重要作用。WANG等[8]证实了9-PAHSA(一种内源性哺乳动物脂类)通过激活GPR120来抑制LPS/NF-kB途径从而诱导脂肪细胞的褐变。也有研究指出,GPR120在3T3-L1脂肪细胞中通过Ca2 +和ERK1/2信号途径增加PPARγ的表达来促进脂肪形成[9]。由于GPR120在脂肪代谢多个环节中起重要作用,其受到越来越广泛的关注。近年来,GPR120在脂代谢中的研究多集中在脂肪组织及脂肪细胞,而关于GPR120在奶牛乳脂合成中的作用及GPR120基因多态性的研究仍较少见。
因此,本研究以黑龙江省某规模化牛场的中国荷斯坦奶牛为试验群体,采用PCR-RFLP方法开展GPR120基因单核苷酸多态性位点(single nucleotide polymorphism site,SNP)的鉴定,并对其进行生物信息学分析及产奶性能相关性分析,为奶牛乳脂代谢相关候选分子辅助选择标记的研究提供依据。
1 材料与方法
1.1 样品采集本试验采用来自黑龙江省绥化市某牛场的有效(具备连续3年完整的DHI跟踪数据)中国荷斯坦奶牛518头为试验群体,每头牛尾静脉采血10 mL,并用柠檬酸钠抗凝处理,放于4℃保存。
1.2 基因组DNA提取奶牛血液基因组DNA提取采用DNA试剂盒(北京天根生化有限公司)。用1%琼脂糖凝胶电泳检测DNA提取效果,并用紫外分光光度计法测定DNA浓度,保证DNA浓度在最适范围内,置于-20℃保存。
1.3 引物设计与PCR扩增外显子区域的SNP很大程度上会引起氨基酸结构发生改变,进而改变基因的翻译。根据NCBI数据库中收录的牛(Bostaurus)GPR120基因序列(登录号:NM_001328657.1)设计4段GPR120基因3个外显子的特异性引物,引物信息见表1。引物序列由哈尔滨擎科生物有限公司进行合成。

表1 中国荷斯坦奶牛GPR120基因外显子引物序列
PCR扩增总体系为25.0 μL:DNA混池模板1.0 μL,上、下游引物各1.00 μL,2×Taq Master Mix 12.5 μL,ddH2O补充至体系25.0 μL。PCR反应条件:95℃预变性5 min;35个循环×(94℃变性30 s,57℃退火30 s,72℃延伸30 s);72℃延伸10 min,最后4℃保存。PCR扩增产物用0.1%琼脂糖凝胶电泳0.5 h后用凝胶成像系统进行检测。
1.4 序列测定与分析选择扩增效果良好的 PCR 产物送至哈尔滨擎科生物有限公司进行纯化后双向测序。使用Chromas软件、MEGA6软件对测序结果进行拼接,筛选中国荷斯坦奶牛GPR120基因3个外显子的SNP位点。
1.5 PCR-RFLP分析以每头牛血液的DNA为模板分别进行PCR扩增,扩增后进行RFLP 分析。酶切反应体系:限制性内切酶 1 μL,10×T Buffer 2 μL,0.1% BSA 2 μL,DNA 8 μL,灭菌水 7 μL。30℃下反应1 h。
1.6 数据统计分析等位基因频率计算公式:
PA=(2×AA+AB)/2N;PB=1-PA(PA表示等位基因 A 的频率,A 表示等位基因;PB 表示等位基因 B 的频率,B 表示等位基因;AA 表示该基因型个数,AB 表示 AB 基因型个数;N 表示总数)。
基因型频率的计算公式:基因型频率=(基因型个体数/测定群体总数)×100%。
多态信息含量的计算公式:
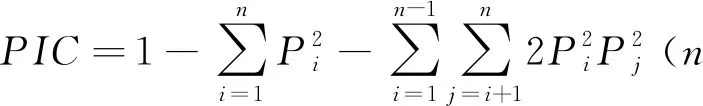
杂合度计算公式:

纯合度计算公式:
Ho=1-He。
有效等位基因数计算公式:

1.7 连锁分析使用 SHEsis 软件检测GPR120基因SNP之间的连锁不平衡(LD)。
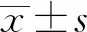
2 结果
2.1 中国荷斯坦奶牛GPR120基因PCR扩增结果图1为GPR120基因第1外显子的PCR扩增结果,以1% 的琼脂糖凝胶电泳检测,其片段长度分别为565,935 bp。图2为GPR120基因第2外显子的PCR扩增结果,其片段长度为375 bp。图3为GPR120基因第3外显子的PCR扩增结果,其片段长度为985 bp。结果显示,扩增产物电泳条带清晰,特异性效果较好,结果与预期片段大小一致,可以用于后续测序分析。
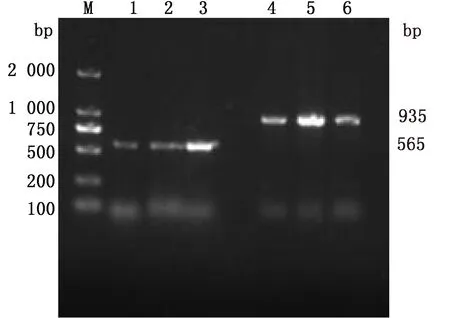
M.DL2000 DNA Marker;1~3. GPR120基因第1外显子片段1;4~6. GPR120基因第1外显子片段2
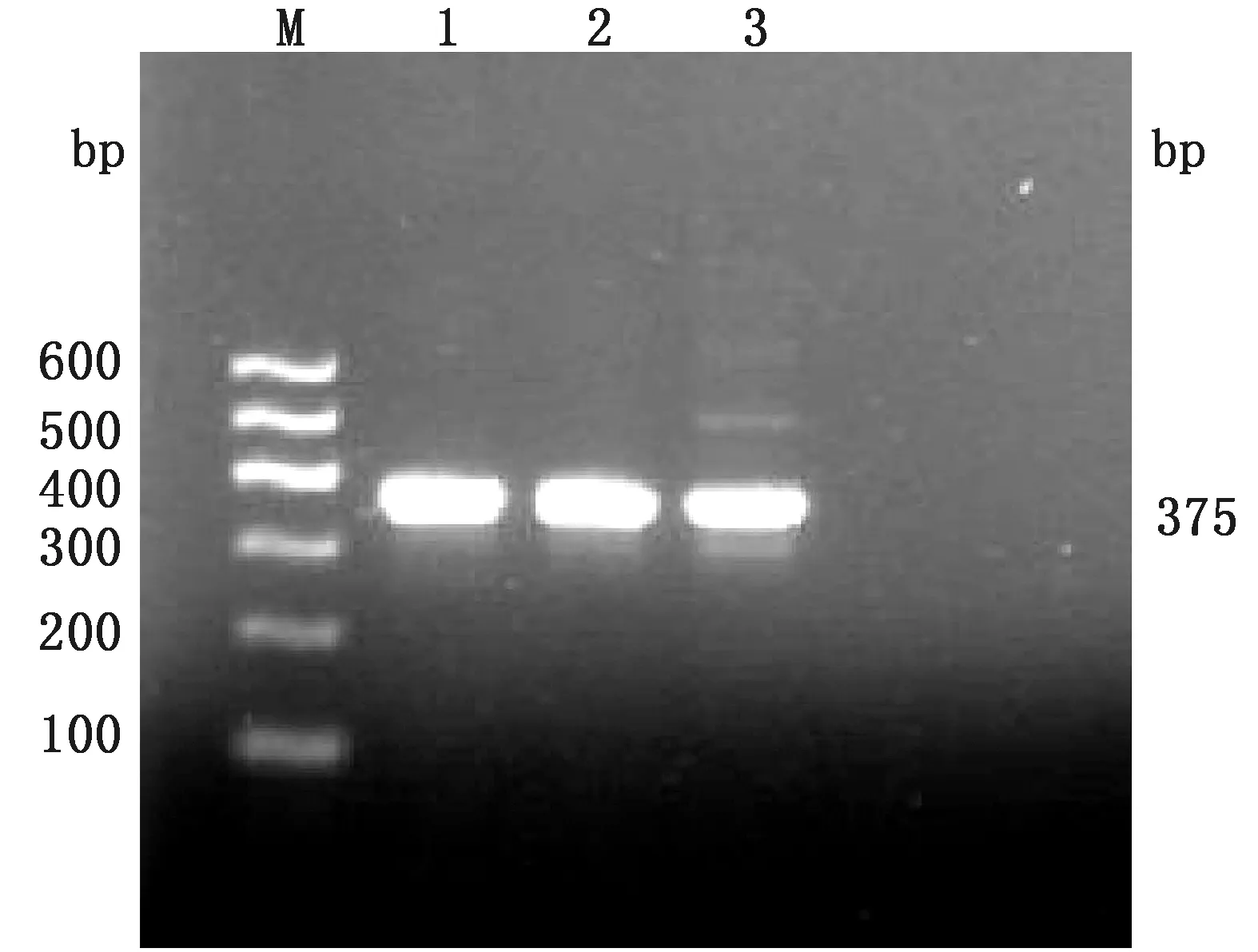
M.DL600 DNA Marker;1~3.GPR120基因第2外显子
M.DL2000 DNA Marker;1~3.GPR120基因第3外显子
2.2 中国荷斯坦奶牛GPR120基因SNP检测利用Chromas软件和MEGA6软件对GPR120第一外显子的测序结果进行拼接,并筛选出SNP位点,结果显示中国荷斯坦奶牛GPR120基因第一外显子存在9个SNP位点,分别为T100G、C196T、G413A、C428T、G713T、C858G、T873G、G903T、C904T,其中T100G由色氨酸(Trp)突变为甘氨酸(Gly),G413A位点使甘氨酸(Gly)突变为谷氨酸(Glu),C428T位点使丝氨酸(Ser)突变为苯丙氨酸(Phe),C904T位点使亮氨酸(Leu)突变为苯丙氨酸(Phe)(图4)。而第二外显子及第三外显子并未鉴定出SNP位点。
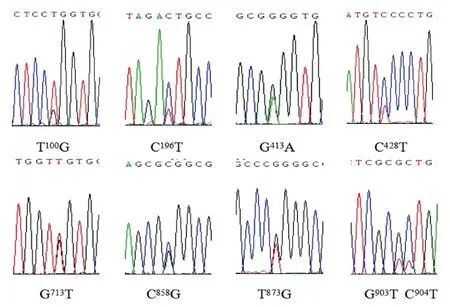
图4 GPR120 基因测序结果及 SNP 位点
2.3 中国荷斯坦奶牛GPR120基因mRNA二级结构预测运用在线程序(RNA fold web server服务器)预测中国荷斯坦奶牛GPR120基因T100G、G413A、C428T、C904T位点的mRNA二级结构。
突变前mRNA二级结构最小自由能为-1 891.17 kJ/mol,而突变后的T100G位点mRNA二级结构最小自由能为-1 904.98 kJ/mol,最小自由能有所降低;G413A位点mRNA二级结构最小自由能为-1 882.80 kJ/mol,最小自由能有所升高;C428T位点mRNA二级结构最小自由能为-1 889.91 kJ/mol,最小自由能有所升高;C904T位点mRNA二级结构最小自由能为-1 904.98 kJ/mol,最小自由能有所降低。如图5所示mRNA的二级结构稳定性可能产生改变,从而对蛋白质的翻译发生影响。
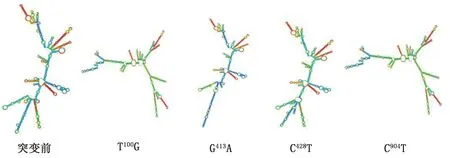
图5 中国荷斯坦奶牛GPR120基因SNP位点二级结构突变前后对比
2.4 中国荷斯坦奶牛GPR120基因蛋白二级结构预测由图6可知中国荷斯坦奶牛GPR120基因的T100G、G413A、C428T、C904T位点为错义突变,运用在线程序(https://npsa-prabi.ibcp.fr/cgi-bin/secpred_sopm.pl)预测发现突变前后蛋白质的二级结构发生轻微改变。
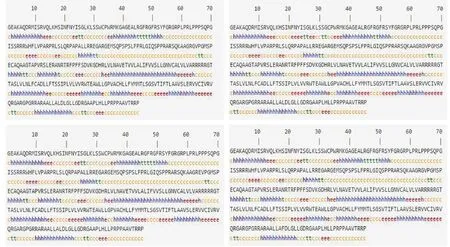
图6 中国荷斯坦奶牛GPR120蛋白二级结构突变前后对比
结果显示,突变前蛋白质二级结构:a-螺旋(h)占34.77%,β-折叠(e)占15.08%,无规则卷曲(c)占44.62%。突变后T100G位点蛋白质二级结构:a-螺旋(h)占35.38%,β-折叠(e)占16.62%,无规则卷曲(c)占42.77%。突变后G413A位点蛋白质二级结构:a-螺旋(h)占34.77%,β-折叠(e)占15.08%,无规则卷曲(c)占44.62%。突变后C428T位点蛋白质二级结构:a-螺旋(h)占35.38%,β-折叠(e)占15.08%,无规则卷曲(c)占43.69%。突变后C904T位点蛋白质二级结构:a-螺旋(h)占34.46%,β-折叠(e)占15.08%,无规则卷曲(c)占44.92%。
由结果可以发现,a-螺旋的蛋白质二级结构T100G、C428T、C904T 3个位点突变前后的含量分别增加了0.61%、增加了0.61%、减少了0.31%。β-折叠仅T100G位点增加了1.54%。无规则卷曲的含量在突变前后T100G位点减少了1.85%,C428T位点减少了0.93%,C904T位点增加了0.30%。无规则卷曲在GPR120基因蛋白质二级结构的编码过程中起到主导作用,当无规则卷曲发生改变后,蛋白质的稳定性就会发生改变。
2.5 PCR-RFLP结果分析经PCR-RFLP分析,G413A位点和T873G位点存在限制性内切酶,因此本试验选择G413A、T873G 2个位点进行后续研究。
G413A位点的限制性内切酶是SacⅡ,识别序列为CCGC/GG。通过单一DNA模板扩增的PCR产物进行RFLP检测后,得到3种条带型基因型GG、GA、AA(图7)。

M.DL2000 DNA Marker;1.AA;2.GA;3.AA;4.AA;5.GA;6.GG;7.GG;8.GG
T873G位点的限制性内切酶是SmaⅠ,识别序列为CCC/GGG。通过单一DNA模板扩增的PCR产物进RFLP检测后,得到3种基因型TT、TG、GG(图8)。

M.DL2000 DNA Marker;1.GG;2.GG;3.TG;4.TT;5.TT;6.TG
2.6GPR120基因SNP位点的基因型频率和等位基因频率分析GPR120基因外显子1片段1的G413A位点基因型频率和等位基因频率如表2所示,其中在群体中占主导地位的基因型为GG,基因型频率为51.0%。在群体中占主导地位的等位基因为G,等位基因频率为66.3%。
GPR120基因外显子1片段2的T873G位点基因型频率和等位基因频率如表2所示,其中在群体中占主导地位的基因型为TT,基因型频率为55.1%。在群体中占主导地位的等位基因为T,等位基因频率为67.3%。

表2 GPR120基因 SNP 位点基因型频率和等位基因频率
2.7GPR120基因SNP位点的遗传参数分析中国荷斯坦奶牛GPR120基因G413A、T873G突变位点的纯合度、杂合度、有效等位基因数,如表3所示,其中G413A、T873G位点多态性信息含量(PIC)分别为0.347和0.343,数值在0.250~0.500之间,表明2个SNP位点为中度多态性。

表3 GPR120基因 SNP 位点在群体中的遗传参数分析
2.8GPR120基因SNP位点与产奶性状的关联分析GPR120外显子1的G413A、T873G突变位点与中国荷斯坦奶牛试验牛群DHI数据中产奶性状(305 d日产奶量、乳脂率、乳蛋白率)之间关联分析结果如表4所示。

表4 GPR120基因SNP位点与中国荷斯坦奶牛DHI产奶性能的相关分析
G413A位点与305 d日产奶量及乳脂率具有显著相关性(P<0.05),与乳蛋白率及体细胞评分呈极显著相关性(P<0.01)。GG基因型在群体中占主导地位,GG基因型与GA基因型的305 d日产奶量、乳蛋白率和体细胞评分具有显著性差异(P<0.05),与AA基因型体细胞评分具有显著性差异(P<0.05)。
T873G位点与305 d日产奶量、乳脂率和乳蛋白率具有极显著相关性(P<0.01)。TT基因型在群体中占主导地位,TT基因型与TG基因型的305 d日产奶量、乳脂率具有显著差异性(P<0.05),与GG基因型的305 d日产奶量具有显著性差异(P<0.05)。
2.9GPR120基因SNP位点连锁分析如图9所示,GPR120外显子1的G413A、T873G突变位点是连锁不平衡(G413A、T873G的D值=0.65)。
图9 GPR120基因连锁不平衡分析
3 讨论
乳脂主要由甘油三酯组成,其以乳脂球 (milk fat globules,MFG) 的形式存在并分泌。乳脂中含有人体所需的所有必需脂肪酸及多种脂溶性维生素,同时乳脂也是决定牛奶品质的重要因素之一[10]。影响乳脂合成的因素有很多,其中遗传因素作为影响乳脂合成的内在因素对乳脂合成具有较大影响。王凯等[11]研究表明TRAPPC9基因rs1100-17379、DGAT1基因rs109421300、ATP1A1基因rs110256520和GHR基因rs41639260作为多态性均对乳蛋白率和乳脂率有显著性影响。张娟等[12]发现EEF1D基因存在2个SNP位点,其中EEF1D-1位点对乳脂率和乳蛋白率性状的效应均达到极显著水平。LIANG等[13]研究确定了中国荷斯坦奶牛ACSL1基因的6个SNP位点(5′UTR-g.20523C>G、g.35446C>T、g.35651G>A、g.35827C>T、 g.35941G>A、g.51472C>T),它们在一定程度上与牛奶产量、牛奶脂肪含量、牛奶蛋白质含量和体细胞评分(SCS)显著相关。
近年来,GPR120基因的研究均集中在癌症,糖尿病及肥胖症等代谢异常疾病。SINZ等[14]研究表明二十碳五烯酸和二十二碳六烯酸(EPA和DHA)对3T3-L1和人皮下培养的脂肪细胞中TNF-α诱导的chemerin产生影响。chemerin是一种促炎性脂肪因子,在肥胖症中会增加,并与肥胖相关的疾病相关。研究发现DHA显著降低3T3-L1和人脂肪细胞中chemerin生成。EPA不影响chemerin的产生,但能减弱TNF-α对chemerin的诱导作用。而用siRNA沉默GPR120可阻断DHA和EPA减少TNF-α诱导的chemerin分泌的能力。为了探究G蛋白偶联受体120在食道癌中的作用,CUI等[7]研究表明,与正常组织相比,在食道癌组织中观察到GPR120的表达显著增加。GPR120基因敲低显著降低了食道癌细胞增殖、克隆形成、迁移和侵袭,并降低了Akt磷酸化和I-κB磷酸化水平、血管内皮生长因子(VEGF)、白介素8(IL-8)等炎症相关的细胞因子的表达水平,同时降低体内肿瘤的生长。据报道GPR120在机体肥胖、胰岛素抵抗以及2型糖尿病等疾病的发生都与GPR120的功能缺陷有密切关联。何晴雯[15]研究发现在妊娠32,37周,妊娠期糖尿病(gestational diabetes mellitus,GDM)组与血糖正常的妊娠组相比,白细胞中GPR120 mRNA及FGF21(成纤维细胞生长因子21) mRNA表达量明显升高,而产后2 d 时,GDM组与血糖正常的妊娠组相比GPR120 mRNA及FGF21 mRNA的表达量差异无统计学意义。因此在妊娠期糖尿病患者体内可能通过调节GPR120表达量升高从而诱导FGF21 mRNA表达量升高,进一步调节GDM的发生和发展。综上结果表明,越来越多的研究者们关注了GPR120,其在不同领域都取得了极大的研究成果。但是关于GPR120基因在家畜群体中SNP位点的研究仍较少见。
SNP即单核苷酸多态性位点是指在基因组上单个核苷酸的变异形成的遗传标记。外显子区域的SNP很大程度上会引起氨基酸结构发生改变, 进而改变基因的转录和翻译。DNA混池(DNA pooling)是将几个或多个个体的DNA按照一定比例混合后再进行PCR扩增,DNA混池与测序技术相结合,不仅在寻找突变位点上能够大大降低试验成本,同时还能满足准确率高、重复性好的要求[16]。FONTANESI等[17]利用高通量离子激流半导体测序技术对猪GPR120基因进行测序,确定了3个SNP位点,其中g.114765469C>T位点与猪的平均日增重存在显著相关。ALAN等[18]对203名儿童中GPR120的3个SNP位点(rs10882273 T>C、rs12243124 T>C和rs11187533 C>T)进行了关联研究,发现rs11187533位点与葡萄糖水平之间存在显著相关。此外,该位点与肝酶丙氨酸氨基转移酶和γ-谷氨酰转移酶显著关联。结果表明rs11187533单核苷酸多态性的纯合子等位基因型可能对伴随肥胖的代谢后果起到保护作用,并且可以在早期识别出代谢健康的肥胖个体。而肥胖也是犬中常见的营养失调疾病,但是尚未在犬中鉴定出遗传因素。MIYABE等[19]对141只犬的GPR120基因突变进行了研究,发现5个同义突变和4个非同义突变。其中在40只犬中发现c.595C>A位点发生突变且c.595C>A位点与代谢率降低有关,因此c.595C>A位点是一个与肥胖相关的候选变异体,可能有助于犬的营养管理。
由于GPR120 SNP位点的研究较少,而关于GPR120基因在奶牛中的SNP研究未见报道。因此本试验为了探究GPR120是否与乳脂等泌乳性状的相关性,采用 PCR-RFLP方法在中国荷斯坦奶牛GPR120基因第1外显子中筛选到9个SNP位点,其中T100G、G413A、C428T、C904T 4个位点为错义突变,导致T100G由色氨酸(Trp)突变为甘氨酸(Gly),G413A由甘氨酸(Gly)突变为谷氨酸(Glu),C428T由丝氨酸(Ser)突变为苯丙氨酸(Phe),C904T由亮氨酸(Leu)突变为苯丙氨酸(Phe),而氨基酸的改变会导致GPR120蛋白的功能发生相应的变化。因为通过二级结构预测结果显示,T100G、C904T SNP位点的自由能相比参考序列有所增加,导致mRNA 二级结构的稳定性降低,可能会影响基因表达效率。中国荷斯坦奶牛GPR120蛋白二级结构中无规则卷曲占主导地位,T100G无规则卷曲由44.62% 减少至49.10%,C428T无规则卷曲由44.62% 减少至43.69%,C904T无规则卷曲由44.62% 增加至44.92%,由于无规则卷曲是构成配体受体结合的活性部位,突变可能会对蛋白质二级结构的稳定性造成影响,从而影响蛋白质三级结构,使蛋白质功能发生变化。
通过PCR-RFLP进一步对GPR120的9个SNP位点所产生的基因型进行分析。在中国荷斯坦奶牛试验群体中G413A、T873G这2个SNP位点均检测到3种基因型,G413A基因型为GG、GA、AA,其优势基因型为GG,优势等位基因为G。T873G基因型为TT、TG、GG,其优势基因型为TT,优势等位基因为T。在试验群体中G413A、T873G位点多态性信息含量(PIC)分别为0.347和0.343,数值在0.250~0.500之间,表明2个SNP位点为中度多态性。将G413A、T873G 2个SNP位点与产奶性能进行关联分析发现,G413A位点与305 d日产奶量及乳脂率呈显著相关(P<0.05),与乳蛋白率及体细胞评分呈极显著相关性(P<0.01)。T873G位点与305 d 日产奶量、乳脂率和乳蛋白率亦呈极显著相关(P<0.01)。由于本试验研究所用的样本量偏少,后期将扩大样本量并对GPR120进行全基因组分析,同时通过奶牛乳腺上皮细胞进一步探索GPR120对奶牛乳腺发育及乳脂合成的分子作用机制。
