玉米赤霉烯酮诱导睾丸细胞线粒体路径的凋亡损伤小鼠生殖能力
2022-01-25易江南陈汉明刘冰贤黎远亮刘莹炜杨必婧黎扬威唐兆新
易江南,陈汉明,刘冰贤,黎远亮,刘莹炜,杨必婧,黎扬威,张 辉,唐兆新,李 英
(华南农业大学 兽医学院,广东 广州 510642)
玉米赤霉烯酮(ZEA)常存于霉变谷物,且不易在加工中降解,易导致动物食物源性慢性中毒。ZEA对神经系统、心脏、肾脏和肝脏具有毒性作用[1-2],并且能引起动物体内生殖内分泌紊乱,影响睾丸激素的合成和分泌,扰乱精子的发生过程,破坏生殖能力[3]。
近年来,不少学者关注于ZEA对雄性动物生殖毒性的作用机制。有研究表明,单次腹腔注射ZEA通过扰乱内分泌系统,抑制睾酮生成,最终导致生殖系统短暂性的损伤[3]。
ZEA能诱导小鼠的睾丸发生氧化应激(ROS),ROS导致电子传输链的损伤,最终导致线粒体功能障碍并诱导促凋亡介质的释放,引起细胞凋亡[4]。自噬是真核生物高度保守的细胞过程,可降解受损的细胞器[5]。有研究发现,ROS可诱导细胞凋亡或自噬,或两者兼而有之[6-7]。
本试验通过灌胃方式建立小鼠ZEA长期染毒模型,分析ZEA对小鼠睾丸和精子损伤,以及凋亡自噬相关蛋白及mRNA表达的影响,以探讨ZEA对雄性小鼠生殖能力影响的机制。
1 材料与方法
1.1 实验动物和处理实验动物采用雄性昆明小鼠(南方医科大学实验动物中心提供),所有小鼠在试验开始前适应环境1周并保持在相对环境中。将20只小鼠随机分为对照组(CON组)和玉米赤霉烯酮处理组(ZEA组),ZEA组小鼠根据20 mg/kg的剂量经口灌服ZEA,CON组小鼠口服相同体积的生理盐水。饲养28 d后,颈椎脱臼处死小鼠后迅速取出睾丸,并迅速取出附睾尾,在缓冲液中制备成精子悬液。
1.2 精子浓度和能动精子百分比将精子悬液置于流式细胞仪上,计算精子浓度。在血细胞计数板上滴1滴精子悬液,在显微镜下对能动精子进行计数,计算能动精子百分比。
1.3 染色质状态评估(SCSA)将精液样品在EK稀释液中稀释至终浓度为1×106个/mL的混悬液,将精液悬浮液200 μL与400 μL Lysis Solution裂解液,混合30 s进行短暂的酸变性并混合含1.2 mL AO溶液,3 min后,将样品吸到流式细胞仪中进行检测。
1.4 线粒体功能的评估将精液样品在EK稀释液中稀释至终浓度为1×106个/mL的混悬液,将10 μL R123溶液加入500 μL稀释精液中,室温黑暗中孵育20 min。500×g离心3 min后,移去上清,再将精子颗粒用500 μL EK溶液重悬,最后加入5 μL的PI上机检测。
1.5 睾丸指数快速采集睾丸并称重,并计算睾丸指数:睾丸指数=睾丸质量(mg)/体质量(g)。
1.6 睾丸组织形态染色及观察用4%多聚甲醛固定睾丸组织,经流水过夜,脱水、透明、浸蜡、包埋处理。组织切片(5 μm)后放入展片台上,55℃烤1 h,再进行HE染色,在显微镜下观察。
1.7 睾丸组织免疫化学染色及观察石蜡切片(5 μm)经脱蜡、复水、抗原修复、H2O2处理、封闭后滴加一抗孵育过夜,随后二抗孵育,滴加DAB显色液。最后用苏木精染核、盐酸酒精分化、脱水、透明、封片。
1.8 Western blot检测蛋白表达用RIPA裂解液从细胞中提取蛋白质。将提取的蛋白样在垂直电泳仪上经SDS-PAGE分离后,5%脱脂奶粉封闭1 h,一抗在4℃下孵育16 h,然后与二抗反应,用ECL试剂盒发光,使用成像相机捕获凝胶图像,并使用Image J分析条带密度。
1.9 RT-qPCR检测基因表达提取组织总RNA,测定浓度后逆转录为cDNA,将逆转录后的cDNA采用染料法进行RT-qPCR反应,以GAPDH为内参照基因。引物序列见表1。

表1 引物序列
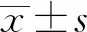
2 结果
2.1 小鼠生殖能力评价ZEA组小鼠附睾中精子数量下降(图1A)、能动精子百分率显著降低(P<0.01)(图1B);未成熟精子比例增高(图1C)、活跃线粒体的活精子比例下降趋势(图1D),但均不显著(P>0.05)。结果提示,连续28 d以20 mg/kg剂量饲喂ZEA的小鼠生殖能力受损。

A.精子浓度;B.能动精子百分数;C.染色质状态评估(SCSA);D.线粒体功能评估。**P<0.01
2.2 ZEA对小鼠睾丸细胞损伤的影响小鼠经20 mg/kg 剂量的ZEA连续28 d染毒后其睾丸指数升高,但差异不显著(P>0.05)(图2A)。睾丸石蜡切片和HE染色后观察发现,ZEA组小鼠睾丸曲精小管中的生精细胞分散、排列紊乱,生精细胞层数减少,并出现空泡变化(图2B)。结果提示本染毒剂量的ZEA处理可导致小鼠睾丸组织损伤。
A.睾丸指数;B.小鼠睾丸组织的HE染色(×400)(箭头1所指示为正常排列的生精细胞;箭头2所指示为排列分散的生精细胞;箭头3指示为空泡变化)
2.3 线粒体路径凋亡相关基因和蛋白的表达免疫组化结果显示,Bax、Cytc阳性表达主要在各级精细胞的细胞质,Bcl-2阳性表达主要在精母细胞的细胞核周围,并且阳性细胞被染成棕色(图3)。从表观上可以发现,与对照组相比,ZEA组睾丸中的Cytc蛋白阳性数量明显提升。

图3 凋亡相关蛋白免疫组化观察 (×400)
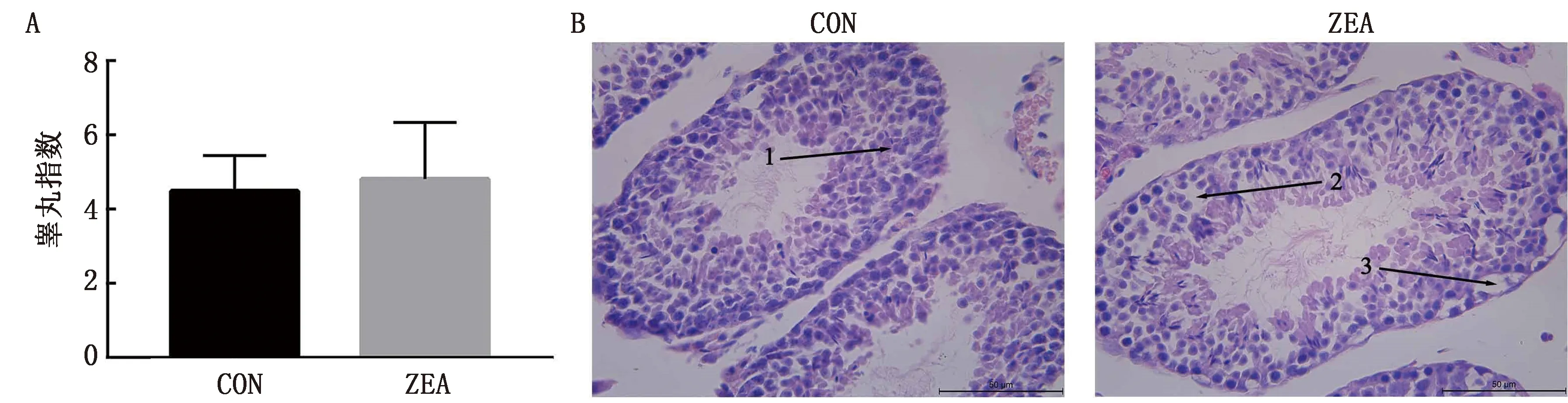
凋亡相关mRNA的表达水平如图4A所示,与对照组相比,ZEA组睾丸组织Bax、Cytc和P53的mRNA水平呈上升的趋势,其中Bax的上升趋势极显著(P<0.01),而Bcl-2的mRNA水平下降。凋亡相关蛋白表达水平检测发现(图4B),与对照组相比,暴露于ZEA后,Bcl-2、Bax、P53的蛋白表达下降,Caspase-3、Cytc蛋白表达上升,其中Cytc的表达上升极显著(P<0.01)。
A.凋亡相关基因表达;B.凋亡相关蛋白表达。**P <0.01
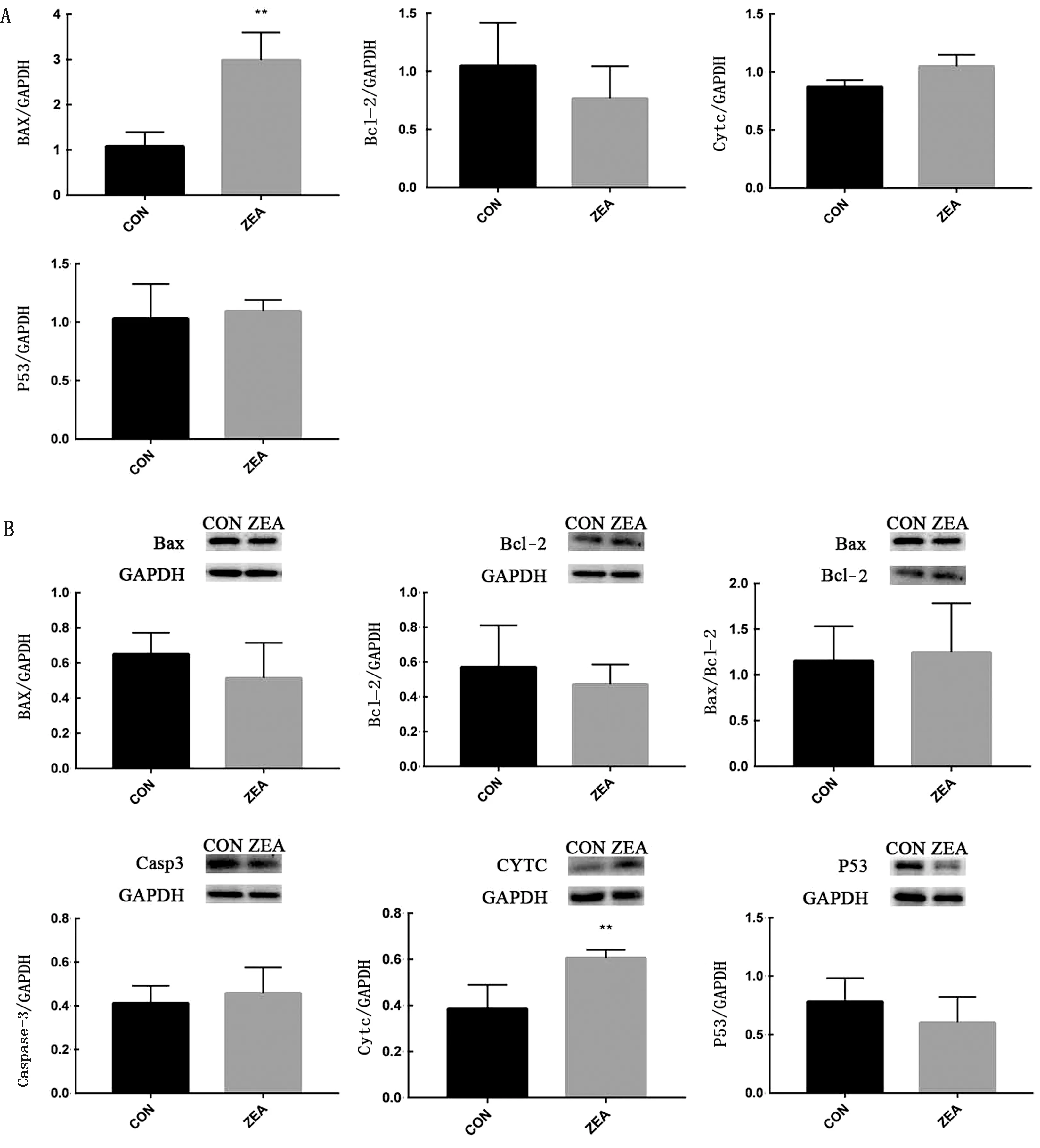
2.4 自噬相关基因和蛋白的表达如图5所示,与对照组相比,ZEA能上调小鼠睾丸组织中ATG5、Beclin1、LC3-Ⅱ和P62的mRNA水平,但并没有显著性的差异(P>0.05);Western blot分析结果显示,ATG5、Beclin1、LC3-Ⅱ和P62的蛋白水平上升,但并没有显著性的差异(P>0.05)。
A.自噬相关基因表达;B.自噬相关蛋白表达
3 讨论
本研究发现20 mg/kg的饲喂剂量下,ZEA能使附睾中未成熟精子的比例升高,并降低能动精子的比例和活跃线粒体的活精子数。通过病理学切片,可以发现小鼠睾丸生精小管中的细胞排列杂乱、生精细胞层数减少、生精细胞分离、并出现空泡变化。结果提示ZEA能造成小鼠睾丸损伤并降低生殖能力。
目前,一些在体内和体外的试验证明,ROS是ZEA诱导细胞毒性的决定性因素[8-9],线粒体是细胞产生ROS的主要部位,ROS介导的线粒体功能障碍是许多疾病的潜在致病要素[10],而在细胞凋亡调控中线粒体发挥重要作用[11]。细胞凋亡受多种蛋白质调节,Bcl-2相关蛋白是凋亡信号进入线粒体并引起细胞凋亡的关键,它与其对立的系列蛋白共同决定细胞的凋亡程序[12]。在受到凋亡刺激因素时,促凋亡蛋白Bax堆积在线粒体,使线粒体膜的通透性发生变化,CytC从线粒体释放到细胞质中,然后激活Caspases途径来诱导细胞凋亡[13]。因此,Bax/Bcl-2的比重是决定细胞存活和死亡的关键因素之一[14]。P53被认为有双重作用:一个是保护细胞,另一个是介导细胞凋亡[15]。在本次试验中,暴露于ZEA后,小鼠睾丸中Bcl-2的蛋白表达量有一定程度的下降,CytC和Caspase-3的蛋白表达上升,其中Cytc上升的趋势极显著(P<0.01)。这提示ZEA暴露能增强睾丸的凋亡水平。有研究表明,在40 mg/kg的剂量下,ZEA能显著提升Bax的蛋白水平[16],而在我们的试验中Bax、P53的蛋白水平呈下降的趋势,Bax/Bcl-2的比例没有明显的变化,可能与ZEA的剂量和暴露时间有关。先前报道显示:在ZEA给药10 d内,大鼠肝脏中的SOD活性增加,而在给药10 d后,大鼠肝脏中的SOD含量没有明显变化[17],提示ZEA的毒性作用与剂量和暴露时间有关。因此,还需要更多的试验来验证不同剂量和时间的ZEA暴露对小鼠睾丸的影响。本研究发现,Bax、Cytc和P53的mRNA水平上升,Bcl-2的mRNA水平下降。这说明在基因水平上,ZEA诱导小鼠睾丸细胞启动内源性线粒体通路介导的凋亡。
自噬与线粒体受损有关,线粒体作为兴奋等信号通路的调节器,对导致自噬的毒素做出适应性反应[18-19]。有研究表明,用0(对照组),0.1,1.0,10.0,20.0,30.0 μmol/L等不同浓度的ZEA处理睾丸支持细胞,细胞自噬增强,且浓度越高差异越显著[20]。而在本试验中,暴露于ZEA会增加小鼠睾丸LC3-Ⅱ、Beclin1、P62和Atg5的蛋白和mRNA表达,但这些结果没有明显的差异,表明自噬途径不参与20 mg/kg的ZEA持续灌胃小鼠诱导的睾丸细胞损伤。
综上所述,ZEA通过诱导睾丸细胞线粒体路径的凋亡,引起睾丸的损伤和生殖能力的下降。
