CCDC134调控人牙髓干细胞成骨分化
2022-01-17徐万田董文睿朱文胤
徐万田,董文睿,朱文胤
南京大学医学院附属口腔医院,南京市口腔医院第三门诊部,江苏 南京(210008)
颌面部骨缺损修复与再生是组织工程与再生医学的研究热点。选择合适的种子细胞,并通过外源性调控使其获得更好的成骨分化功能具有重要意义。
人牙髓干细胞(human dental pulp stem cells,hDPSCs)为牙源性间充质干细胞,具有自我更新能力、多向分化潜能,免疫原性低,可通过拔除的第三磨牙、正畸牙获得,来源较为充足,且与颌面部骨组织具有同源性,因此被视为颌面部骨缺损修复与再生的重要种子细胞[1]。
CCDC134(coiled-coil domain containing 134)是新发现的一种骨调控分子,其表达缺失可影响成骨细胞的骨向分化和骨基质形成,在成骨调控中发挥重要作用[2]。骨形态发生蛋白-2(bone morphogenetic protein-2,BMP-2)/Smad家 族 成 员1(mothers against decapentaplegic homolog 1,SMAD1)信号通路是骨代谢中的重要通路,具有正向调控成骨分化的功能[3]。
本实验拟通过上调/下调CCDC134,观察其对hDPSCs成骨分化的影响,以及CCDC134与BMP-2/SMAD1信号通路的关系,为hDPSCs在颌面部骨缺损修复与再生中的应用提供参考依据。
1 材料和方法
1.1 主要试剂和仪器
α-MEM培养基、胰蛋白酶(Gibco,美国);胎牛血清(四季青,中国);成骨诱导液、细胞聚合体诱导液、ALP染液、茜素红染液(碧云天,中国);Trizol reagent(Invitrogen,美 国);逆 转 录 试 剂 盒(Toyobo,日本);BMP-2、Dorsomorphin、HA/TCP(Sigma,美国);慢病毒(锐博,中国);人Stro-1抗体(ab214086,Abcam,英国);CD105抗体(ab11414,Abcam,英国);CD34抗体(ab187282,Abcam,英国);CD45抗 体(ab25386,Abcam,英 国);人CCDC134抗体(MAB7784-SP,R&D,美国);RUNX2抗体(sc-390351,Santa Cruz,美国);OCN抗体(sc-390877,Santa Cruz,美国);BMP-2抗体(sc-137087,Santa Cruz,美 国)、SMAD1抗 体(sc-7965,Santa Cruz,美国);GAPDH抗体(sc-47724,Santa Cruz,美国);实时定量PCR仪(CFX96,Bio-Rad,美国);流式细胞仪(FACSCanto II,BD,美国)。
1.2 实验分组和方法
1.2.1 hDPSCs分离培养与鉴定 选取就诊患者中需要拔除的新鲜阻生第三磨牙或正畸减数牙,分离牙髓,并将牙髓组织切割为小碎块,采用组织块-酶消化法,配合有限稀释法,分离培养hDPSCs。以P3代细胞进行实验。
本实验获得南京大学医学院附属口腔医院伦理委员会批准(NJSH-2021NL-003)。所有阻生第三磨牙或正畸减数牙来源的患者,均已签署知情同意书。
对分离hDPSCs进行鉴定:①流式细胞仪检测表面标志物Stro-1、CD105、CD34和CD45;②hDPSCs克隆形成检测,将500个细胞接种于5 cm培养皿,14 d后固定细胞,甲苯胺蓝染色;③成骨诱导及碱性磷酸酶(alkaline phosphatase,ALP)染色检测、茜素红染色(详见1.2.4);④成脂诱导及油红染色检测成脂能力(详见1.2.5)。
1.2.2 慢病毒感染hDPSCs与实验分组 以5×104个/mL的密度将hDPSCs接种于6孔培养板中,细胞生长融合至底面积的约80%时加入慢病毒感染。CCDC134低表达慢病毒(shCCDC134)和过表达慢病 毒(CCDC134)的 靶 序 列 分 别 为5′-CTTCCAGAACCCATTTAAA-3′,5′-CAATGCACAGGGCTGCAGTCTAA-3′,病毒滴度>108PFU/mL。6 h后换液,72 h后收集感染细胞。
将hDPSCs分为4组,分别为空白对照组、阴性对照组、CCDC134下调组(shCCDC134)、CCDC134过表达组(CCDC134)。空白对照组细胞不感染任何慢病毒;阴性对照组细胞感染空白质粒慢病毒;shCCDC134组细胞感染CCDC134低表达慢病毒;CCDC134组细胞感染CCDC134过表达慢病毒。
1.2.3 BMP-2信号激活及抑制 hDPSCs感染了CCDC134低表达慢病毒或CCDC134过表达慢病毒后,诱导细胞聚合体形成,在细胞贴壁时将细胞分为4组,分别为:①shCCDC134组,加入等量溶剂;②shCCDC134+BMP-2组,加入BMP-2信号通路激活剂BMP-2(100μM);③CCDC134组,加入等量溶剂;④CCDC134+Dorsomorphin组,加入BMP-2信号通路抑制剂Dorsomorphin(200μM)。
1.2.4 成骨诱导及ALP染色检测、茜素红染色 将1×105个细胞接种于12孔培养板中,待细胞贴壁后更换成骨诱导液,每2 d换液1次,14 d后固定细胞,ALP染液染色15 min,观察染色情况,28 d后固定细胞,茜素红染液染色10 min,PBS缓冲液洗涤染液,显微镜下观察矿化结节形成。
1.2.5 成脂诱导及油红染色检测成脂能力 将1×105个细胞接种于12孔培养板中,待细胞贴壁后更换成脂诱导液,每2 d换液1次,7 d后,固定细胞,油红染液染色10 min,PBS缓冲液洗涤染液,显微镜下观察脂肪滴形成。
1.2.6 qPCR检测相关基因mRNA水平 Trizol法提取hDPSCs总RNA,逆转录获得cDNA(反应条件:37℃,5 min×3;50℃,5 min×3;98℃,5 min),实时定量扩增(反应条件:95℃,3 min;95℃,15 s;60℃,30 s;39个循环)。引物序列见表1。

表1 引物序列Table 1 Primer sequences
1.2.7 Western blot检测相关蛋白水平 超声震荡联合反复冻融法提取总蛋白,BCA法测定蛋白浓度,取等量蛋白于SDS-PAGE凝胶电泳,转膜,5%脱脂牛奶封闭1 h,4℃孵育CCDC134、Runt相关转录因子2(Runt-related transcription factor 2,RUNX2)、骨钙素(osteocalcin,OCN)、BMP-2、SMAD1一抗工作液(1∶500)8 h,PBS洗涤,室温孵育二抗1 h,PBS洗涤,PVDF膜显影。
1.2.8 裸鼠皮下成骨实验 将BMP-2信号激活剂(BMP-2)和抑制剂(Dorsomorphin)分别干预后的CCDC134下调及上调hDPSCs以1×105个/孔接种于12孔培养板中,待细胞贴壁后更换细胞聚合体诱导液,每2 d换液1次,待细胞聚合体形成后,将羟基磷灰石/磷酸三钙颗粒包裹于细胞聚合体中,移植于裸鼠皮下。2个月后,取材脱钙,行HE染色。
1.3 统计学方法
用SPSS19.0统计分析数据,检验数据的正态性和方差齐性,两组间比较采用t检验,多组间比较采用单因素方差分析。P<0.05为有统计学差异。
2 结 果
2.1 hDPSCs的细胞鉴定
hDPSCs高表达间充质来源的表面标志物Stro-1(98.67%)和CD105(98.51%),低表达造血系来源的表面标志物CD34(0.34%)和CD45(0.27%)。hDPSCs可形成细胞克隆,在成骨或成脂诱导条件下,可产生矿化结节或脂肪滴。以上结果说明hDPSCs分离培养成功,可进行后续实验。见图1。

Figure 1 Identification of hDPSCs图1 hDPSCs的鉴定
2.2 成骨诱导条件下hDPSCs中CCDC134的mRNA和蛋白表达水平
成骨诱导条件下,hDPSCs中CCDC134的mRNA水 平(P<0.001)和 蛋 白 表 达 水 平(P=0.021)的表达均上升。见图2。

Figure 2 Expression of CCDC134 in hDPSCs after osteogenic induction图2 成骨诱导条件下hDPSCs中CCDC134的表达水平
2.3 慢病毒感染后hDPSCs中CCDC134的表达水平
与空白对照组相比,阴性对照组的CCDC134的mRNA和蛋白表达水平无明显变化(P=0.364)。与阴性对照组相比,shCCDC134组CCDC134的mRNA水平(P<0.001)和蛋白(P=0.015)水平表达显著降低,而CCDC134组的mRNA(P<0.001)和蛋白(P=0.008)表达量显著升高,见图3。

Figure 3 Expression of CCDC134 in human dental pulp stem cells after lentivirus transfection图3 慢病毒感染后人牙髓干细胞的CCDC134表达水平
2.4 CCDC134对hDPSCs成骨分化功能的影响
与空白对照组相比,阴性对照组的ALP染色和矿化结节形成无明显差异(P>0.05);与阴性对照组相比,shCCDC134组的ALP染色(P<0.001)和矿化结节形成(P=0.001)显著降低;而CCDC134组的ALP染色(P<0.001)和矿化结节形成(P=0.018)显著增加。
与空白对照组相比,阴性对照组的成骨分子RUNX2和OCN的mRNA水平和蛋白表达水平也无明显变化(P>0.05);与阴性对照组相比,shCCDC134组的RUNX2和OCN的mRNA水平(RUNX2:P=0.001,OCN:P<0.001)和蛋白表达水平(RUNX2:P<0.001,OCN:P=0.001)均降低,差异具有统计学意义;而CCDC134组的RUNX2和OCN的 的mRNA水 平(RUNX2:P<0.001,OCN:P<0.001)和蛋白表达水平(RUNX2:P=0.001,OCN:P<0.001)均升高,差异具有统计学意义,见图4。

Figure 4 Effect of CCDC134 on osteogenic differentiation of human dental pulp stem cells图4 CCDC134对人牙髓干细胞成骨分化功能的影响
2.5 CCDC134通过BMP-2/SMAD1信号通路调控hDPSCs成骨分化功能
与空白对照组相比,阴性对照组的BMP-2和SMAD1的蛋白表达水平的表达无显著差异(P>0.05);与阴性对照组相比,shCCDC134组的BMP-2和SMAD1的蛋白表达水平(BMP-2:P=0.036,SMAD1:P=0.039)均降低,差异均具有统计学意义;而CCDC134组的BMP-2和SMAD1蛋白表达水平(BMP-2:P<0.001,SMAD1:P=0.002)均升高,差异具有统计学意义,见图5。
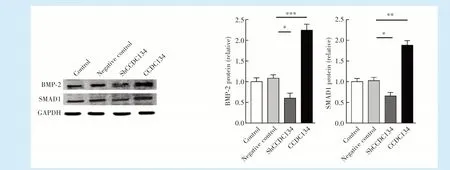
Figure 5 Expression level of BMP-2/SMAD1 signal pathway protein in human dental pulp stem cells after lentivirus infection图5 慢病毒感染人牙髓干细胞后BMP-2/SMAD1信号通路蛋白表达水平
与shCCDC134组相比,shCCDC134+BMP-2组成骨分子RUNX2和OCN的mRNA水平(RUNX2:P<0.001,OCN:P<0.001)与 蛋 白 表 达 水 平(RUNX2:P<0.001,OCN:P<0.001)升高,裸鼠皮下异位成骨增加(P=0.001),差异具有统计学意义;与CCDC134组相比,CCDC134+Dorsomorphin组RUNX2和OCN的mRNA水平(RUNX2:P<0.001,OCN:P<0.001)与蛋白表达水平(RUNX2:P=0.001,OCN:P<0.001)均降低,裸鼠皮下异位成骨减少(P=0.012),差异具有统计学意义,见图6。
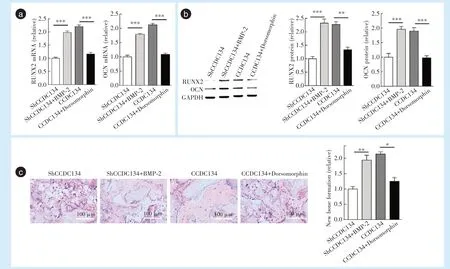
Figure 6 CCDC134 regulates the osteogenic differentiation of human dental pulp stem cells through BMP-2 signaling pathway图6 CCDC134通过BMP-2信号通路调控人牙髓干细胞的成骨分化能力
3 讨 论
hDPSCs是一类重要的牙源性种子细胞,研究表明hDPSCs具有成骨分化潜能[4-5],在骨组织修复与再生中发挥作用[6-10],因此,明确其成骨分化的分子机制对于精准调控种子细胞功能,促进骨组织修复与再生具有重要意义。
CCDC134是新发现的一种高度保守的分子,在胚胎发育过程中参与心脏、脑、肝脏等多种重要组织器官的代谢,其表达缺失可导致这些重要脏器的发育和功能障碍[11]。CCDC134的高度保守性保证了其可以从动物实验延伸至人源性样本的研究。研究表明,过表达CCDC134可以显著改善小鼠关节炎的症状[12]。不仅如此,CCDC134表达缺失可导致多种成骨相关基因的表达异常,进而导致严重的骨发育不全[2]。此外,CCDC134基因突变可造成患Ehlers-Danlos综合征母亲所怀胎儿的骨折,甚至是致死性骨折[3]。以上研究均提示CCDC134在骨发育与代谢中具有关键作用。
本实验首先对进行了hDPSCs鉴定,显示其间充质干细胞表面标志物高表达,造血干细胞表面标志物低表达,同时具有自我更新和多向分化潜能,以确保后续实验的可靠性。其次,发现hDPSCs成骨过程中的CCDC134表达增高,提示其在成骨中起重要作用;并通过慢病毒调控hDPSCs中CCDC134的水平,发现过表达CCDC134可以显著增强hDPSCs的成骨分化能力,为精准调控hDPSCs在骨组织工程中的作用,提供了新的靶点。
研究显示,CCDC134可调控细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)以及丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路在其他骨组织细胞中发挥作用[13-14]。例如,CCDC134突变可以引发ERK1/2磷酸化,抑制成骨相关分子骨桥蛋白(osteopontin,OPN)、Ⅰ型胶原α链(collagen type I alpha 1 chain,COL1A1)的表达,进而导致成骨细胞分化异常[2]。也有研究报道CCDC134不直接调控MAPK信号通路[13],这可能与两项研究选用的疾病模型和细胞种类不同有关。除以上信号通路外,BMP-2/SMAD1信号通路也是参与细胞骨代谢的重要信号通路,可以促进成骨细胞[15-16]、间充质干细胞[17-20]的成骨分化,其与CCDC134的相关研究尚未见报道。本实验结果发现,过表达CCDC134可上调BMP-2/SMAD1信号的表达,而抑制CCDC134则下调该信号的表达,提示BMP-2/SMAD1是CCDC134的下游信号通路。此外,通过BMP-2信号的激活和抑制,可以有效逆转CCDC134低表达慢病毒或过表达慢病毒对hDPSCs的作用,从而明确了CCDC134可通过BMP-2/SMAD1信号通路调控hDPSCs的成骨分化。
辅助性T细胞1(helper T cell 1,Th1)和辅助性T细胞17(helper T cell 17,Th17)是两类重要的免疫细胞,在骨代谢的负向调控中起重要作用,二者的活化直接或间接影响成骨和破骨过程[21-22]。研究显示,CCDC134可以抑制Th1和Th17细胞的功能,并能有效控制骨关节炎的发展[12],这也提示CCDC134调控骨代谢的另一潜在机制。此外,CCDC134还能通过与转录激活因子hADA2a(human alteration/deficiency in activation 2a)相互作用,抑制其诱导的细胞凋亡和细胞周期抑制,发挥保护细胞的作用[23]。另有研究发现,CCDC134通过调控Wnt信号通路,在神经系统发育及运动神经的协调中发挥关键作用,而hDPSCs为神经嵴来源的细胞,与神经系统具有同源性,可能具有类似的信号调控途径[24]。
本实验明确了CCDC134在hDPSCs成骨分化中的作用及相关分子机制,进一步完善了CCDC134调控成骨分化的信号网络,为多方位调控hDPSCs的成骨分化功能,促进其在颌面部骨缺损修复与再生中的应用提供实验依据。
