醋酸氯己定复合介孔二氧化硅改性正畸粘接树脂的体外研究
2022-01-17邓文振田徐腾越李雪微董伟梁永强
邓文振,田徐腾越,李雪微,董伟,梁永强
1.华北理工大学口腔医学院,河北 唐山(063000);2.口腔疾病国家重点实验室 国家口腔疾病临床医学研究中心四川大学华西口腔医学院,四川 成都(610041);3.河北大学附属医院口腔科,河北 保定(071000)
在固定矫治过程中,釉质白斑病损(white spot lesions,WSLs)发生率较高,其主要原因为托槽周围菌斑生物膜发生聚集,菌斑生物膜中产酸菌的浓度升高,如变异链球菌和乳酸杆菌[1],主要症状为在牙齿釉质表层上出现界限不清楚的白垩色、云雾状斑块,为龋坏发生的初始阶段[2]。正畸治疗过程中为降低WSLs的发生,在粘接剂加入多种抗菌材料。
氯己定是牙科领域最常用的消毒剂之一,它具有持久的抗菌活性,有研究表明氯己定漱口液对牙菌斑的形成具有一定的抑制作用[3]。Vallet-Regi等[4]首次将介孔硅与布洛芬进行联合,发现介孔硅材料可以作为药物载体,并具有缓释药物的能力。大量研究表明介孔二氧化硅作为药物载体呈现出较好的负载能力。Zhang等[5]将质量分数为0%、3%、5%、6.4%的醋酸氯己定(chlorhexidine acetate,CHA)包封于二氧化硅纳米粒子(mesoporous silica nanoparticles,MSNs)中形成CHA@MSNs复合物,以CHA@MSNs替代复合树脂中硅烷化材料,探讨含有不同质量分数的CHA@MSNs对继发龋的抑制效果,发现CHA@MSNs在保证材料机械性能及表面完整性的前提下,可抑制口腔生物膜。但CHA@MSNs能否改性正畸3M粘接树脂的抗菌性能和粘接强度尚不清楚,本实验以介孔二氧化硅负载0%、3%、5%、6.4%质量分数的CHA,比较其对菌斑的抑制效果及粘接强度的影响,为临床应用提供实验依据。
1 材料和方法
1.1 材料与仪器
介孔二氧化硅(先丰纳米,中国);CHA(98%氯己定,Aladdin,美国);3M Z350XT流体树脂、3M Transbond XT粘接剂(3M,美国);37%磷酸牙釉质酸蚀剂(天津市合成材料工业研究所,中国);上颌第二前磨牙金属直丝弓托槽(杭州新亚齿科材料有限公司,中国);傅里叶红外光谱仪(Vector-33,Bruker,美国);扫描电镜(S-4800,日立,日本)。
1.2 负载CHA的介孔二氧化硅纳米粒子的制备与检测
称取1g SBA-15、0.3M CHA、15 mL无水乙醇置入30 mL试剂瓶中。在25℃、600 r/min恒温磁力搅拌机上搅拌72 h。用PTFE滤膜过滤后,在15 mL无水乙醇中分散,重复3次。设置电热真空干燥箱温度为90℃,时间为2 h,获得白色粉末状样品。用傅里叶红外光谱仪和扫描电镜对实验所得样品进行表征分析。
1.3 实验分组
将3M Z350XT流动树脂分为4组,分别为3M+CHA@MSNs(0%)(A组),3M+CHA@MSNs(3%)(B组),3M+CHA@MSNs(5%)(C组)以 及3M+CHA@MSNs(6.4%)(D组),分别添加质量分数为0%、3%、5%、6.4%的CHA@MSNs,各组样品总重量为3 g。
1.4 改性正畸粘接剂抗剪切强度测定与粘接剂残留指数计分
选取华北理工大学口腔医学院附属医院口腔颌面外科18~22岁因正畸治疗而拔除的48颗双尖牙,分为4组,每组12颗。纳入标准:无釉质脱矿、龋坏、氟斑牙、四环素牙、釉质发育不全。本实验经华北理工大学伦理委员会审核批准,且患者已签署知情同意书。
将离体牙置于去离子水中,用超声波清洗机清洗30 min。用气枪将离体牙牙面吹干,35%磷酸酸蚀剂酸蚀牙面,酸蚀时间为20 s,用气枪吹干牙面,直至呈白垩色,用小毛刷将预处理剂涂布到酸蚀处,光固化5 s,在离体牙颊面临床冠中心放置上颌第二前磨牙金属直丝弓托槽,加压后去除托槽周围粘接剂,在托槽龈方、方、近中和远中固化10 s[6]。将离体牙依次置于生理盐水、37℃恒温水浴箱中各24 h,对离体牙用冷热循环仪进行冷热循环1 000次,每次在55℃、5℃循环各30 s,转移时间为5 s,后用超硬石膏将其根部包埋。将其固定于万能电子材料试验机上,调节剪切刀刃,使刀刃切缘平行于托槽方两个金属翼与底板间的区域,且垂直正对于托槽底板与方托槽翼距离的中央,移速为0.5 mm/min,记录托槽被剪切下瞬间的最大值和断裂值,计算出抗剪切强度。计算公式如下:剪切强度(MPa)=最大载荷(N)/托槽底网面积(mm2)[7]。
10倍放大镜观察托槽上粘接剂的残留量,用托槽粘接剂残留指数(adhesive remnant index,ARI)计分[8]。换算方法如下:0分:牙釉质上无残留粘接剂;1分:牙釉质上有粘接剂残留,面积小于粘接总面积的50%;2分:牙釉质上有残留粘接剂且大于总粘接面积的50%;3分:牙釉质上粘接面全部残留有粘接剂。
1.5 抗菌性能的检测
将4组改性粘接树脂铺于96孔板封盖上凹槽底部,光固化20 s,形成厚0.5 mm、直径8 mm的树脂片,用紫外线将树脂片双面各照90 min,灭菌备用。
本实验所使用的变异链球菌由华北理工大学口腔医学基础实验室提供。-80℃冰柜中取出变异链球菌菌种,置入4℃冰柜解冻30 min,在BHI培养基中放入菌种(比例为1 000∶1),在恒温震荡培养箱中培养,温度为37℃、转速为180 r/min,至菌悬液在600 nm处OD值为0.8时,保留部分菌种,-80℃冰箱中保存。
取4个24孔板,实验组各取3个灭菌后树脂片,当菌悬液在600 nm处OD值为1时,各孔隙分别加入1.5 mL菌悬液,放入恒温箱中培养,温度为37℃,时间为48 h,形成变异链球菌生物膜,将其转移到新24孔板中,标本用2.5%戊二醛固定,4℃冰箱过夜,分别依次置入25%,50%,75%,90%和100%乙醇中,进行梯度脱水,自然晾干,随机夹取少量变异链球菌生物膜,放置在载物台的导电胶上,离子溅射仪喷金后用扫描电镜扫描。
实验组每孔加1.5 mL过夜培养的菌悬液,37℃恒温箱中培养48 h,形成变异链球菌生物膜。将变异链球菌生物膜连同树脂片转移到新的24孔板中,然后每孔中加入将1 mL MTT染料。37℃恒温箱培养1 h,变异链球菌将黄色的MTT还原为紫色的甲臜,再将其转移到新的24孔板中,每孔加DMSO的量为1 mL,以溶解甲臜晶体。在智能脱色摇床避光摇20 min后每孔取200μL液体于24孔板中,测量540 nm处的OD值,生物膜活性越高,OD值越大[9]。
1.6 统计学方法
数据用SPSS 23.0软件进行统计学处理。剪切强度和菌液OD540值结果用表示,两两比较采用LSD检验,多组间比较采用方差分析。ARI计分结果采用χ2检验,多组间比较采用Kruskal WallisH多组秩和检验,以P<0.05,表示差异具有统计学意义。
2 结 果
2.1 傅里叶红外光谱分析结果
MSNs为典型的二氧化硅结构,在1 082 cm-1出现Si-O-Si基团的特征峰,在CHA与MSNs搅拌混合之后,在3 326.5 cm-1处出现-C=N-的特征吸收峰;在2 927.7 cm-1和2 854.7 cm-1处出现-CH2-的特征吸收峰,且在CHA@MSNs红外光谱中也出现了MSNs的特征峰,表明CHA已成功负载于MSNs之上。见图1。
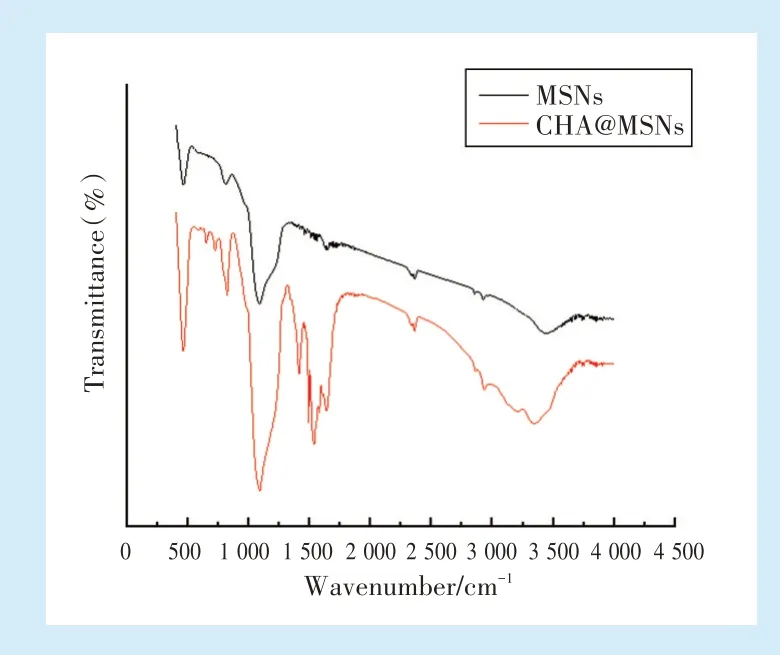
Figure 1 Infrared spectroscopic analysis of CHA@MSNs图1 CHA@MSNs的红外光谱分析图
2.2 CHA@MSNs扫描电镜结果
MSNs扫描电镜结构特征为MSNs成簇聚集形成长杆状结构,长杆之间界限较为分明。当CHA与MSNs结合后,其结构发生变化,界限较为模糊且聚集为层状结构,可能是由于CHA吸附于MSNs微孔结构之中。见图2。

Figure 2 SEM images of MSNs and CHA@MSNs图2 MSNs与CHA@MSNs扫描电镜图
2.3 各组抗剪切强度比较
3M树脂中所含CHA@MSNs质量分数越大,其抗剪切强度不断下降,且与A组相比,差异均具有统计学意义(B组:P<0.001;C组:P<0.001;D组:P<0.001);其中以D组抗剪切强度最低,与B、C两组比较,差异具有统计学意义(B组:P=0.011;C组:P=0.008);B、C两组其抗剪切强度无显著性差异(P=0.896)。见表1。
表1 各组正畸粘接剂托槽抗剪切强度比较Table 1 Comparison of the shear strength of the orthodonticadhesive brackets ±s

表1 各组正畸粘接剂托槽抗剪切强度比较Table 1 Comparison of the shear strength of the orthodonticadhesive brackets ±s
CHA@MSNs:CHA was encapsulated in MSNs;MSNs:mesoporous silica nanoparticles;CHA:chlorhexidine acetate;Group A:3M+CHA@MSNs(0%);group B:3M+CHA@MSNs(3%);group C:3M+CHA@MSNs(5%);group D:3M+CHA@MSNs(6.4%);a:compared with group A,P<0.05;b:compared with group B,P<0.05;c:compared with group C,P<0.05
Group(n=12)Group A Group B Group C Group D FP Shear strength/MPa 12.339±1.570 7.542±1.397a 7.626±1.243a 5.847±1.950abc 38.254<0.001
2.4 各组ARI计分比较
在添加不同质量分数的CHA@MSNs后,牙釉质表面其粘接剂的残留量差异无统计学意义,但A组其粘接剂残留指数主要分布于3分之间,在加入不同质量分数的CHA@MSNs后,其粘接剂残留量明显下降。见表2。
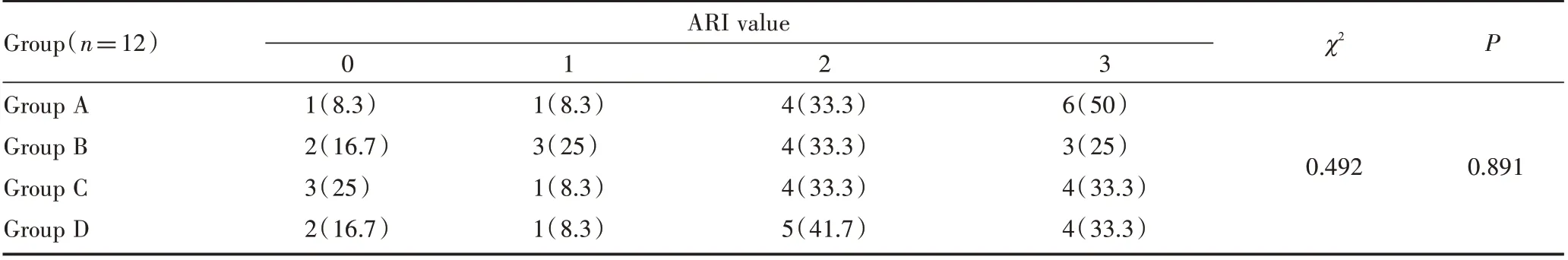
表2 各组正畸粘接剂的粘接剂残留指比较Table 2 Comparison of ARIof orthodontic adhesives in each group n(%)
2.5 变异链球菌生物扫描电镜结果
A组变异链球菌菌落较为致密,且形态较为规则,细胞膜较为圆滑,在加入CHA@MSNs后,可见B、C、D组菌落稀疏,形态较不规则,出现失去细胞内容物的细胞膜,细胞膜较为干瘪,出现褶皱。见图3。

Figure 3 Electron microscopy images of each group of Streptococcusmutans biofilms(×2 000)图3 各组变异链球菌生物膜的电镜图(×2 000)
2.6 各组菌液OD540值比较
添加的CHA@MSNs的质量分数越大,变异链球菌的OD540值越小,B、C、D三组菌液OD540值与A组相比,差异具有统计学意义(B组:P=0.037;C组:P<0.001;D组:P<0.001)。与B组相比,在C、D两组的菌液OD540值显著下降,差异具有统计学意义(C组:P=0.018;D组:P=0.010),而B、C两组比较,差异无统计学意义(P=0.934)。见表3。
表3 各组变异链球菌菌液OD540值的比较Table 3 Comparison of OD540 value of Streptococcus mutans in each group ±s

表3 各组变异链球菌菌液OD540值的比较Table 3 Comparison of OD540 value of Streptococcus mutans in each group ±s
Group A:3M+CHA@MSNs(0%);group B:3M+CHA@MSNs(3%);group C:3M+CHA@MSNs(5%);group D:3M+CHA@MSNs(6.4%);a:compared with group A,P<0.05;b:compared with group B,P<0.05;CHA@MSNs:CHA was encapsulated in MSNs;MSNs:mesoporous silica nanoparticles;CHA:chlorhexidine acetate
Group(n=12)Group A Group B Group C Group D FP OD540 value 1.106±0.299 0.905±0.157a 0.676±0.197ab 0.653±0.235ab 10.483<0.001
3 讨 论
固定矫治常导致食物残渣滞留及增加日常口腔卫生保健难度,从而使口腔固有环境发生改变,有研究表明正畸治疗会使与牙龈炎相关的口腔微生物群发生显著变化[10]。因此,对正畸粘接剂改性应在保证其粘接强度的前提下,使细菌在托槽周围粘附量少及抑制口腔微生物生长。
氯己定为阳离子表面活性剂,是一种广谱抗微生物剂,其作用机制为破坏微生物细胞膜。氯己定可与皮肤、黏膜结合,在与口腔内黏膜结合后可在唾液中停留5 h,口腔黏膜上停留12 h。在低浓度下,氯己定会导致Ca2+和Mg2+的置换以及细胞壁中K+的损失,从而产生抑菌效果[11]。氯己定漱口液已被广泛应用于口腔感染辅助治疗[12-13]。
研究表明,在粘接树脂中直接加入氯己定会导致树脂粘接强度下降、对水的吸附性增加和CHA释放后形成多孔表面,且氯己定呈现爆发式释放[14-15]。研究发现,介孔二氧化硅材料具有孔径大小均匀(介于2~50 nm)、高孔隙率、孔径可调的以及高负载腔的特点,可提供有效的封装,然后控制释放,以上特点决定其具有作为无机药物载体的条件[16-17]。
本实验选择将CHA负载于MSNs中,而不选择氯己定或葡萄糖酸氯己定,原因是三者中氯己定分子量最小,其最易负载于MSNs中,但氯己定微溶于醇,用物理方法将其包封在MSNs中的量微乎其微,而葡萄糖酸氯己定分子量较大,MSNs介孔直径约为1 mm,不利于大量负载,CHA完全溶于醇,水溶性较氯己定好,在MSNs负载CHA之后容易析出,由于致龋菌在糖酵解过程产酸,可更好地发挥抗菌作用。
本实验中,随着改性树脂中CHA@MSNs比例的增加,其抗剪切强度下降。在CHA@MSNs添加质量分数为6.4%时,其剪切强度为(5.847±1.950)MPa,而7~9 MPa为正畸托槽粘接所需具备的剪切强度[18],其已不满足临床粘接要求,而质量分数为5%的CHA@MSNs的剪切强度为(7.626±1.243)MPa,可以满足临床需要。
ARI评分能够量化釉质表面上残留的粘接剂,添加不同质量分数的CHA@MSNs实验组与对照组的ARI计分主要集中在2分与3分之间,且不同质量分数的CHA@MSNs不会影响托槽脱落后牙面的ARI计分,所以在去除托槽时,不会增加损伤牙釉质的风险。
在扫描电镜下将变异链球菌放大2 000倍,可以观察到在加入CHA后,变异链球菌形态发生改变,说明CHA的加入有一定的抗菌作用。牙菌斑生物膜的结构被假设是由特定的类群间物理和化学相互作用驱动的。环境压力包括氧气张力与宿主因子,宿主因子主要包括促生长因子、抑制生长的因子以及其他免疫介质[19]。变异链球菌分泌的葡糖基转移酶外酶与白色念珠菌细胞表面结合并合成葡聚糖[20]。
变异链球菌在葡聚糖的介导下聚集于牙面形成菌斑生物膜,细菌产酸使牙面脱矿破坏,CHA的加入可以破坏其菌斑生物膜。通过测量不同质量分数的CHA@MSNs组菌液OD540值可以间接地反映各组粘接剂的抗菌性能。OD540值表示样本的抗菌性,两者之间的关系为反比例。OD540值下降说明随着CHA@MSNs的加入,其抗菌性能明显增强。当加入CHA@MSNs质量分数为6.5%、5%时的抗菌性能较好,两者差异无统计学意义。
综上所述,3%CHA@MSNs与5%CHA@MSNs均能满足临床粘接强度,但5%CHA@MSNs抗菌效果优于3%CHA@MSNs。而5%、6.4%质量分数的CHA@MSNs抗菌效能较好,但6.4%CHA@MSNs不能满足临床粘接强度要求。5%CHA@MSNs在满足粘接强度的情况下,其抗菌性能良好,且去除托槽时,牙釉质损伤的风险不会增加。本实验为CHA@MSNs改性粘接剂用于托槽的粘接提供可能性,但其控释效能还有待研究。
