Toll样受体-4抑制剂TAK-242对大鼠重度牙周炎骨吸收的影响
2022-01-17魏媛朱雅男杨卫东
魏媛,朱雅男,杨卫东
南京大学医学院附属口腔医院,南京市口腔医院牙体牙髓病科,江苏 南京(210008)
重度牙周炎是目前牙齿缺失的主要原因。目前临床上基础治疗与手术治疗的效果仍不理想,重度牙周炎需要增加新的辅助治疗手段。Toll样受体-4(Toll like receptor-4,TLR-4)是连接固有免疫和适应性免疫的关键桥梁[1],在重度牙周炎发生发展中起双刃剑的作用:疾病初期维护牙周组织的健康,炎症后期加速牙周组织的破坏[2]。TAK-242是一种TLR-4信号的特异性抑制剂,通过与TLR-4胞内结构域中Cys747结合,抑制MyD88和TRIF途径,抑制下游核因子-κB(nuclear factor kappa-B,NFκB)信号激活,抑制下游细胞因子的释放。众多关于TLR-4调控的相关疾病的动物研究如风湿性关节炎、新生儿缺氧缺血性脑病、内毒素相关的骨骼肌萎缩均采用TAK-242作为TLR-4抑制剂,发现TAK-242通过抑制TLR-4/MyD88/NF-κB信号通路对疾病的症状起到缓解作用,具有作为药物的开发潜力[3-5]。但TAK-242对牙周炎的疗效尚不明确。本研究通过尾静脉注射TLR-4抑制剂TAK-242观察其对大鼠重度牙周炎骨质吸收的影响,为重度牙周炎辅助治疗提供实验基础。
1 材料和方法
1.1 材料
1.1.1 实验动物 18只3周龄雄性Wistar大鼠,体质量(200±10)g,购于四川大学华西实验动物中心(合格证号:SCXK(川)2009-009)。
1.1.2 主要材料和仪器P.gingivalisATCC33277(口腔疾病研究国家重点实验室提供);甲基绿试剂盒(Sigma,美国);抗酒石酸酸性磷酸酶试剂盒(Sigma,美国);TAK-242(MCE,美国);氯化血红素;维生素K;酵母提取物;TSB培养基(成都达硕实验有限公司,中国);5-0无菌医用丝线;Quantum FXμCT仪器(Perkin Elmer,美国);光学显微镜(IX70-141,Olympus,日本);显微摄像系统(Olympus,日本)。
1.2 实验方法
1.2.1 大鼠重度牙周炎建模及尾静脉注射TAK-242 将复苏的牙龈卟啉单胞菌(P.gingivalis)ATCC33277接种至含有氯化血红素(5μg/mL)、维生素K(0.5μg/mL)、酵母提取物(1 mg/mL)、5%无菌脱纤维羊血的TSB平板,37℃厌氧培养(10%H2+10%CO2+80%N2)5~7 d,挑取单克隆接种至上述TSB液体培养基中,厌氧培养过夜后将菌液稀释至600 nm处光密度值(OD600)为0.1,加入5-0丝线厌氧培养至OD600为1,取丝线备用结扎。
18只三周龄雄性Wistar大鼠饲养于无菌(SPF级)环境中,1周适应性饲养后随机分为3组(n=6),分别为:对照组、牙周炎组、TAK-242组。将牙周炎组及TAK-242组大鼠以5%水合氯醛溶液(剂量5 mL/kg)腹腔注射麻醉,取仰卧位,固定于鼠板,用含有P.gingivalisATCC33277菌的5-0丝线结扎大鼠双侧上颌磨牙牙颈部两圈行重度牙周炎建模(图1)。TAK-242组从丝线结扎第1天起,通过尾静脉隔天注射1次溶于DMSO的TAK-242(2 mg/kg),对照组及牙周炎组则注射相同体质量比例的DMSO溶剂。第8周末脱颈处死大鼠,获取大鼠上颌骨标本,4%多聚甲醛固定。本实验已获得四川大学实验动物伦理委员会的批准(批准号:WCCSIRB-D-2015-104)。
1.2.2 牙槽骨micro-CT三维影像学分析 参照已有研究的方法[6]在扫描体素分辨率为10μm下对标本进行micro-CT扫描重建。测量上颌第一磨牙区6个位点釉牙骨质界(cementoenamel junction,CEJ)与牙槽骨嵴顶(alveolar bone crest,ABC)之间的距离。将牙体长轴与Y轴平行,近远中向长轴与X轴平行,颌面与Z轴平行。由于腭侧骨板较多,骨质较完整,分别测量第一磨牙腭侧面近中根近中尖、近腭尖、近中腭沟3个位点的平均值与远中根远中尖、远腭尖、远中腭沟3个位点的平均值分别作为近远中根CEJ-ABC的值。选取上颌第一磨牙根分叉区骨质作为兴趣区(region of interest,ROI),CT-Analyser1.13软件分析,进行三维重建及伪彩色编码[7]。测量骨质参数:骨密度(mg/cm)、骨体积/总体积分数(%)、骨小梁数目(1/mm)、骨小梁分离度(mm)、骨小梁厚度(mm)和骨小梁结构模式指数(structure model index,SMI)。
1.2.3 牙槽骨HE染色组织学观察 取固定的上颌骨标本常规脱钙、脱水、浸蜡、包埋处理,制作硬组织切片,行HE染色,光学显微镜下观察各组牙槽骨吸收的情况。
1.2.4 甲基绿染色与抗酒石酸酸性磷酸酶(TRAP)染色定量分析 制备好的上颌骨切片行MG染色观察骨组织吸收情况。TRAP染色观察破骨细胞分布情况。光学显微镜下观察,紫色多核巨细胞(细胞核3个及以上)即为破骨细胞,染色结果采用Image-Pro Plus 6.0进行定量分析。
1.3 统计学分析
使用SPSS 18.0软件进行统计分析,所有计量资料数据用表示。组间差异使用独立样本t检验,单因素方差分析(one-way analysis of variance ANOVA)及Tukey's方法进行检验比较(P<0.05)。
2 结 果
2.1 Micro-CT扫描结果
通过micro-CT扫描上颌骨后的三维重建可以清晰地看到:牙周炎组的上颌第一磨牙牙槽骨骨缺损量都是最高的,TAK-242组牙槽骨的丧失显著降低(图2a~2c)。矢状位切面图显示了上颌第一磨牙根分叉区牙槽骨的形态,各组之间根分叉区牙槽骨骨吸收变化呈现三维图的相同趋势(图2d~2f)。

Figure 2 Three-dimensional reconstruction of alveolar bone by micro-CT图2 牙槽骨micro-CT三维重建图像
定量分析显示:TAK-242组大鼠上颌第一磨牙近、远中根吸收位点的骨丧失相对牙周炎组均显著减轻,各组近中根位点吸收差异具有统计学意义(P<0.05)。通过micro-CT进行的骨参数分析显示,与牙周炎组比较,TAK-242组骨矿物质密度显著增加(P<0.05),骨体积分数显著高于牙周炎组(P<0.01),而骨小梁数量与牙周炎组比较无显著差异,骨小梁厚度值显著增加(P<0.01),骨小梁分离度显著下降(P<0.01),骨小梁结构模式指数降低,但差异无统计学意义。见表1。
表1 各组micro-CT测量参数值Table 1 The micro-CT measure parameter values in each group ±s,n=6

表1 各组micro-CT测量参数值Table 1 The micro-CT measure parameter values in each group ±s,n=6
MP:mesial palatal root;DP:distal palatal root;BMD:bone mineral density;BV/TV:bone volume/total volume fraction;Tb.N.:number of trabeculae;Tb.Th.:trabeculae thickness;Tb.Sp.:trabecular separation;SMI:structure model index;P1:control group vs.periodontitis group;P2:control group vs.TAK-242 group;P3:periodontitis group vs.TAK-242 group
Group Bone loss/mm BMD/(mg/cm)BV/TV Tb.N./(1/mm)Tb.Th./mm Tb.Sp./mm SMI P1 P2 P3 MP DP Control 1.170±0.162 0.661±0.102 977.28±29.09 0.630±0.058 6.990±1.187 0.152±0.029 0.094±0.018 0.68±0.92 Periodontitis 1.685±0.068 1.600±0.200 868.25±32.09 0.389±0.116 7.559±1.100 0.099±0.009 0.130±0.039 1.32±0.90 TAK-242 1.464±0.114 1.362±0.144 951.01±59.85 0.576±0.065 8.188±1.813 0.117±0.008 0.077±0.013 0.88±1.38<0.001 1.878<0.001 0.001 0.409 0.002 0.062 0.031 0.011 3.241 0.356 0.162 0.066 0.016 0.089 0.743 0.011 0.062 0.014 0.006 0.308 0.004 0.009 0.130
2.2 骨小梁结构重建结果
ROI区域内区骨小梁结构三维重建伪彩色编码分析图(骨小梁厚度图与离散图)如图3所示。图中蓝色/绿色表示骨小梁厚度图中较小的厚度和骨小梁离散图中较小的离散度,红色表示骨小梁厚度图中的较大厚度和骨小梁分散图中较大的离散度。与对照组和TAK-242组的板状骨小梁结构相比,牙周炎的骨小梁呈现疏松多孔的蜂窝状结构。骨小梁厚度图中牙周炎组高质量厚度的骨小梁红色区域不明显,TAK-242组骨小梁厚度红色区域分布显著增多;与此相反,骨小梁离散图中牙周炎组紧密排列的骨小梁绿色区域分布松散,密度低,TAK-242组绿色区分布致密,密度高。由以上结果可见,牙周炎组骨小梁厚度降低,骨小梁间距增加,小梁骨结构恶化;TAK-242组牙槽骨骨质微结构改善,骨量改善,骨小梁分布相对更致密,骨小梁结构与对照组更相似。
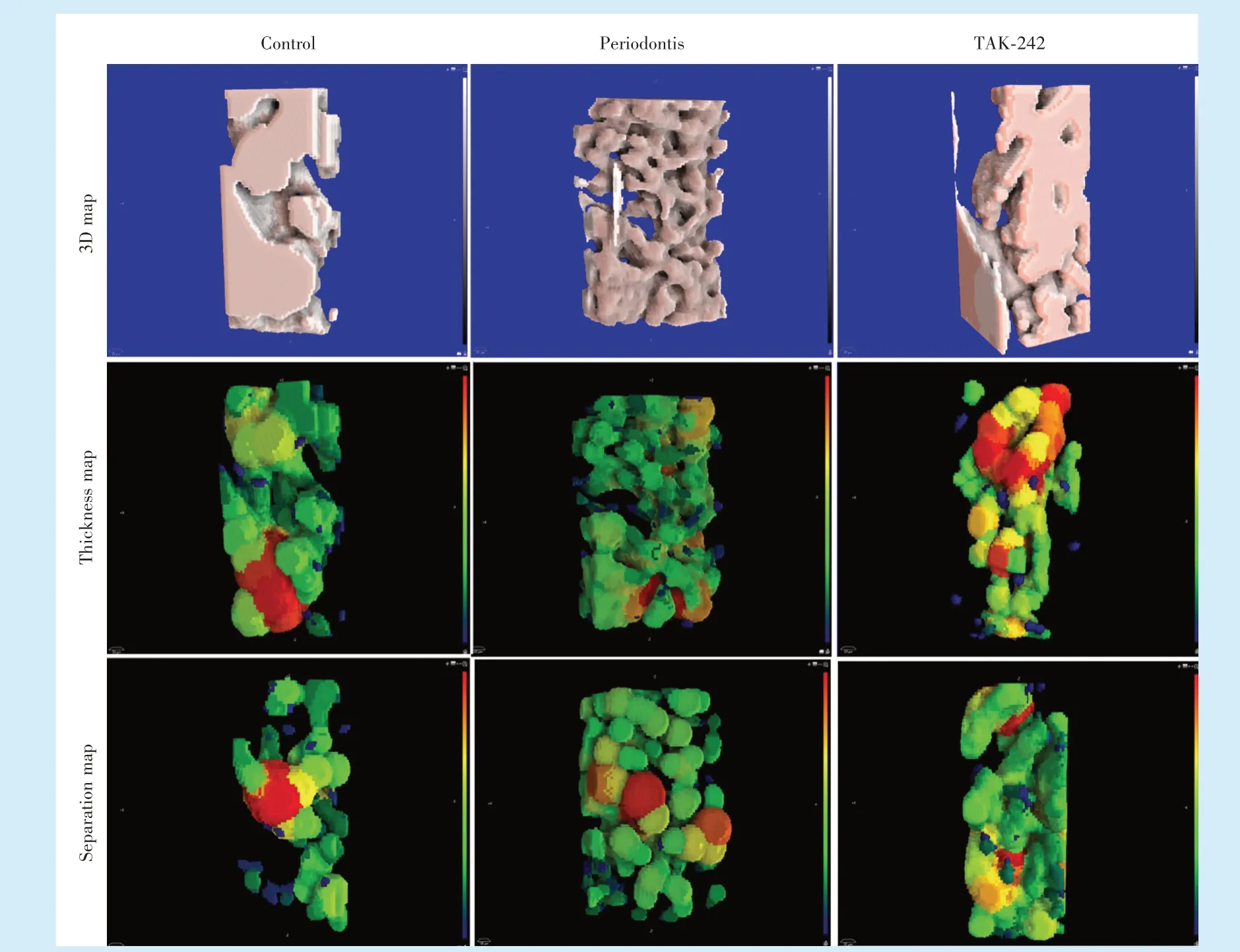
Figure 3 Three-dimensional reconstruction pseudocolor coding map of the microstructure of alveolar bone trabecular bone in ROI图3 ROI区域骨小梁结构三维重建伪彩色编码图
2.3 HE染色结果
HE染色后的组织病理切片显示对照组结合上皮位于釉牙骨质界处,无明显炎性细胞浸润,牙槽嵴未见吸收。牙周炎组大鼠牙龈结合上皮向根方增殖,附着丧失,炎性细胞浸润,牙槽嵴高度降低,牙槽骨吸收明显,表明牙周炎模型建模成功。而与牙周炎组相比,牙周炎TAK-242处理组牙周附着丧失与牙槽嵴吸收高度均降低。见图4。

Figure 4 Pathological observation of each group of periodontal tissue by HE staining(×40)图4 HE染色观察各组牙周组织病理学改变(×40)
2.4 甲基绿染色与TRAP染色定量分析结果
甲基绿染色结果显示对照组大鼠根分叉区牙槽骨形态规则,由完整连续的纤维连接牙根部,骨边缘光滑完整,边界清晰,未见明显吸收陷窝。相较对照组,牙周炎组大鼠根分叉区牙槽骨吸收至根尖,仅见根尖1/3处分布少量牙槽骨,形态不规则,边缘界限不规则,明显的骨吸收陷窝和更丰富的骨髓腔结构。TAK-242组牙槽骨高度降低程度减轻,骨吸收在根上1/3,骨边缘尚规整,界限清晰,骨吸收局限。见图5。

Figure 5 Observation of alveolar bone resorption in the root furcation zone in each group by Methyl Green staining图5 甲基绿染色观察各组根分叉区牙槽骨吸收情况
TRAP染色显示牙周炎组骨吸收弥散分布,骨吸收陷窝、骨髓腔间隙和牙周膜附着的骨表面均观察到活跃的破骨细胞。TAK-242组可见骨吸收陷窝,少量破骨细胞浸润,炎性细胞浸润少。定量分析显示:与牙周炎组相比,TAK-242组破骨细胞数量显著减少,差异具有统计学意义(P<0.001)。见图6。

Figure 6 Observation and quantitative analysis of osteoclasts on the bone resorption site in each group by TRAPstaining图6 抗酒石酸酸性磷酸酶染色观察和定量分析各组破骨细胞分布情况
3 讨 论
牙周致病菌通过LPS-TLR-4途径长期刺激机体,一方面促进牙周组织细胞与免疫细胞表面核因子κB受体活化因子(receptor activator of nuclear factor-κB,RANK)的表达;同时介导细胞反应释放的促炎因子如白细胞介素-1(interleukin-1,IL-1)、白细胞介素-6(interleukin-6,IL-6)和肿瘤坏死因子α(tumor necrosis factor-α,TNF-α),进一步促进T细胞与B细胞表达核因子κB受体活化因子配体(receptor activator of nuclear factor-κB ligand,RANKL),显著增加局部RANKL的表达。RANKL与破骨细胞或破骨细胞表面的RANK结合激活破骨细胞,引起骨吸收。研究发现TLR-4通过调节CD45+细胞浸润、RANKL/骨保护素(osteoprotegerin,OPG)及炎性因子的产生,参与调控种植体周围炎[8]。在动物实验研究中,TLR-4基因敲除小鼠的根尖周炎的颌骨吸收减少,TLR-4功能缺陷小鼠实验性牙周炎引起的牙槽骨吸收相对减少[9-10]。本实验采用P.gingivalis菌液培养的丝线结扎构建重度牙周炎模型,P.gingivalis菌液培养的丝线促进局部菌斑的聚集并维持长期脂多糖(lipopolysaccharide,LPS)-TLR-4反应,有利于构建重度牙周炎模型。
TLR-4不仅存在于单核细胞、巨噬细胞、中性粒细胞等免疫细胞,也存在于牙龈成纤维细胞、牙周膜细胞、间充质干细胞、成牙骨质细胞、成骨和破骨细胞表面,表明TLR-4调控炎性反应骨吸收是涉及多种机制的复杂过程。TLR-4信号途径不仅通过调控RANKL/RANK信号通路促进骨吸收,也通过免疫细胞如T细胞和B细胞双向调控炎性反应中的破骨活动[11]。首先T细胞与B细胞均是牙周炎中RANKL的主要来源,干扰RANKL/OPG的比例,同时T细胞释放和募集的抗炎因子,抑制局部过度免疫反应,促进组织稳态恢复。体内研究表明牙周炎性位点募集大量的T细胞,降低局部炎性破坏,限制骨吸收,促进局部稳态的建立[12]。研究证实在固有免疫和适应性免疫反应中P.gingivalis表面LPS通过激活TLR-4,诱导小鼠B10细胞的扩增和IL-10的分泌[13]。在小鼠牙周炎模型中,局部炎症与骨吸收的控制与诱导组织局部B10细胞IL-10的分泌有关[14]。TLR-4激活不仅影响着破骨过程,也改变了成骨向性能。研究发现牙周膜干细胞(periodontal ligament stem cells,PDLSCs)表达有活性的TLR-4,TLR-4过度激活Wnt/β-catenin通路与NF-κB通路,减弱炎症来源的PDLSCs成骨向分化过程与成骨能力。体外阻断上述通路后,PDLSCs的成骨能力可以部分恢复;体内阻断NFκB通路,LPS诱导的牙周骨缺损降低,牙周组织成骨能力增强,破骨向无显著差异,提示NF-κB通路与牙周组织成骨能力有关[15]。近期研究也发现TLR-4介导的免疫反应释放的细胞因子转化生长因子-β(transforming growth factor-β,TGF-β),通过调控免疫反应与细胞外基质代谢,促进牙骨质和牙槽骨重建。炎症性骨吸收位点形成的低pH环境,通过破骨细胞分泌蛋白激酶活化大量的TGFβ,活化的TGF-β通过Smad2/3信号通路募集骨髓间充质干细胞迁移至骨改建区,诱导其成骨向分化[16]。而体外研究TLR-4激活后促进骨髓间充质干细胞增殖,减弱其迁移能力,对其成骨与免疫调节能力影响不大[15]。由此可见TLR-4通路调控成骨向活动亦是涉及多因子的复杂的双向调控。
TAK-242作为特异性的TLR-4小分子抑制剂,选择性抑制TLR-4下游信号通路和炎性因子的释放,具有广泛抗炎作用,在多种疾病研究中均发现TAK-242具有一定的药物开发潜力。研究发现TAK-242在体外对卵巢癌细胞与急性髓系白血病癌细胞增殖具有抑制作用[17-18]。同时动物实验研究也发现,TAK-242通过抑制TLR-4/NF-κB信号通路,可缓解过敏性鼻炎小鼠的嗅觉功能障碍[19],减轻挤压损伤诱导的大鼠急性肾损伤[20]。TAK-242对于TLR-4信号通路参与调控的疾病是一个很有价值的方向。
本研究发现TLR-4抑制剂TAK-242对大鼠重度牙周炎骨质吸收有显著的影响,micro-CT系统定量分析骨质参数显示:与对照组相比,牙周炎组骨密度、骨体积/总体积分数、骨小梁厚度均下降,骨小梁分离度增加,而骨小梁数目变化不大,提示牙周炎骨吸收可能是破骨向主导骨吸收,导致骨板质量下降所致;与牙周炎组相比,TAK-242组骨体积/总体积分数与骨密度,骨小梁厚度均增加,骨小梁数目相对增加不显著,骨小梁分离度显著缩小,表明新生骨小梁不增加,骨质密度增加是由于骨小梁骨板厚度的增加,腔隙的缩小改变所致。
通过骨小梁色彩编码定性分析发现牙周炎组骨小梁结构严重变形,连接性显著下降,排列紊乱,骨质结构紊乱恶化。骨小梁主要有3种显微结构:杆状、板状和球形结构。骨小梁结构模式指数是用于评估杆状和板状结构比值的参数。牙周炎组骨小梁结构模式指数的增加表明骨小梁形态从板层向杆状骨转变,该种病理学改变导致骨力学功能的降低。炎症后期骨质可能无法承受正常的咬合力,诱发压力性骨丧失。TAK-242可以减少炎症中板层骨断裂,减少力学性能较低的低质量的杆状骨、锥形骨的形成,改善炎症骨的力学结构与性能。HE染色结果显示,牙周炎组与TAK-242组牙周附着丧失与牙槽骨吸收较对照组显著;甲基绿染色结果显示,与牙周炎组相比,TAK-242组骨吸收减轻;TRAP染色显示破骨细胞浸润减少,骨吸收改善,TAK-242减轻重度牙周炎骨吸收。以上结果提示在炎性骨吸收中,TLR-4抑制剂TAK-242可能主要通过调控牙周组织破骨向能力影响骨吸收。
总之,本实验通过构建大鼠重度牙周炎模型,发现TAK-242可能通过降低牙周异常增强的破骨向活动减轻牙周骨缺损,促进骨质改建,延缓牙周组织破坏,具有辅助治疗重度牙周炎的潜力。TAK-242在骨质结构的改变中成骨与破骨向活动具体的主导机制及TLR-4的阻断效果及其下游信号通路的调控机制仍需进一步研究。
