甜菜褐斑病菌分离培养及病程分子鉴定
2022-01-13王录红周翔李王胜兴旺谭文勃
王录红,周翔,李王胜,兴旺,谭文勃
(1.黑龙江大学国家甜菜种质中期库,哈尔滨 150080;2.黑龙江大学现代农业与生态环境学院/黑龙江省普通高等学校甜菜遗传育种重点实验室,哈尔滨 150080)
0 引言
由植物病原真菌引起的病害,约占植物病害的70%~80%[1]。在一种作物上可同时发生几种真菌病害,严重影响着农作物的产量和质量。其中,由甜菜生尾孢菌(Cercospora beticola)引起的褐斑病是世界范围内最具破坏性的甜菜叶部病害,严重影响着三分之一以上的甜菜种植区[2]。发病叶片最初呈现褐色或紫色小圆斑,以后斑点逐渐扩大,直径达2~5 mm,斑点周围呈褐色边缘。后期病斑中央呈现灰白色霉层,即为病菌的分生孢子丛。病斑因发病程度、叶片大小而不同,每片病叶上病斑可达数十个至上千个,病斑连片后,叶片干枯死亡。一般褐斑病先侵染外层生理成熟的叶片,逐渐向中层叶片发展,发病重的外层、中层叶片陆续枯死,影响甜菜的光合作用和养分输送,导致植株生长势衰弱,甜菜块根产量下降,含糖降低,块根中灰分和有害氮增加,原料产量和质量下降[3]。在中国,甜菜褐斑病一般可使块根减产15%~20%,含糖率下降0.8~2.0个百分点,病情指数每增加1个单位,根重减少1.3 g,含糖率降低0.046个百分点[4]。使用杀菌剂抗病,在生产中不仅需要多种杀菌剂联合轮换使用,而且在病害严重区域需要多次喷施杀菌剂处理,大量长期地使用药剂势必增加经济成本并污染环境。甜菜抗褐斑病的遗传育种研究一直是科学家们关注的重点。1997 年,SMITH 和GASKILL 明确提出甜菜对甜菜生尾孢菌的抗性是数量遗传的,主要由4~5 个主要基因控制[5-6]。甜菜的高度抗性和低产基因型相关,将高抗性和高产结合起来非常困难,品种的抗性研究有一定局限性[7]。但是,经过科研工作者的不懈努力,已经获得了高抗性的单胚和细胞质雄性不育系等,为进一步的遗传育种研究奠定了基础。因此,从分子生物学入手,通过挖掘真菌病害抗性基因,分子辅助培育抗褐斑病甜菜品种,具有重要的理论意义与经济价值。
针对甜菜褐斑病给制糖产业带来的巨大损失,科研工作者一直致力于防治甜菜褐斑病的研究。分子生物学辅助育种需要明确甜菜褐斑病的发病机理、甜菜生尾孢菌的效应因子和甜菜对病原的免疫反应。为高效开展以上研究,需在实验室环境中建立一套成熟的甜菜生尾孢菌产孢和发病体系。在目前的研究中,关于诱导甜菜生尾孢菌产生分生孢子和甜菜褐斑病发病的方法比较模糊,缺乏具体的科学描述和数据支撑。在本研究中,针对甜菜生尾孢菌的产孢条件和接种及发病方法进行探索,成功建立甜菜褐斑病发病模型,为通过分子生物学技术研究甜菜褐斑病防治方法奠定基础。
1 材料与方法
1.1 试验材料
甜菜生尾孢菌株HL001分离纯化来自于黑龙江大学呼兰校区试验田的甜菜褐斑病叶,供试甜菜材料为‘IVms33’。
1.2 试验方法
1.2.1 甜菜生尾孢菌的分离培养
将取自田间的甜菜褐斑病叶置于体式显微镜下,用解剖针挑取病斑部位的孢子。取无菌离心管,加入0.5 mL无菌去离子水,将挑取分离的孢子收集于离心管中。用移液器将收集的孢子悬液滴加在马铃薯葡萄糖琼脂培养基上,在25 ℃恒温条件下培养观察。将得到的单孢培养物转接,得到纯培养。
1.2.2 甜菜生尾孢菌的产孢条件试验
西红柿培养基:将500 g西红柿切块之后放在粉碎机中进行充分粉碎,将得到的西红柿汁用150 mL的去离子水进行稀释,用8 层纱布进行过滤。每100 mL的滤液中加入0.3 g CaCO3、2.0 g琼脂,121 ℃灭菌15 min备用。V8 培养基:每100 mL V8 培养基包含20 mL V8 蔬菜汁、0.3 g CaCO3、2.0 g 琼脂,去离子水定容后121 ℃灭菌15 min备用。
取直径为1 cm 的菌饼置于培养基上,用涂抹法将菌丝涂满整个培养基表面,放入恒温光照培养箱中,在25 ℃、14 h 光照/10 h 黑暗光周期条件下培养。每种培养基分别进行3 次重复。培养72 h 后,培养基上出现白色菌丝。取10 mL 浓度为0.05%的Tween 80溶液,加到培养基上,用三角涂棒刮取菌丝,将悬浮液移入10 mL离心管中,放在平板振荡器上高速振荡15 min,振荡后放在试管架上静置10 min,吸取上层悬浮液进行多次离心,制备成孢子悬浮液。将孢子悬浮液制片后,用光学显微镜观察。
1.2.3 甜菜褐斑病的发病条件试验
将孢子浓缩液倒入喷雾瓶中,加入4 mL浓度为0.05%的Tween 80溶液,充分混合后喷洒于盆栽生长的甜菜叶片的正反面。盆栽病原接种试验进行3次重复。将甜菜植株放置于植物光照培养箱中进行培养,培养条件为:温度28 ℃,湿度90%,光周期为14 h光照/10 h黑暗。培养72 h后将植株置于常规环境条件进行培养。
1.2.4 科赫氏法则验证
将发病的盆栽甜菜叶片取下,在体式显微镜下挑取孢子至马铃薯葡萄糖琼脂培养基进行培养。当菌落扩展至整个平板时,刮取菌丝体,提取菌丝基因组DNA。采用引物ITS1 和ITS4,利用菌丝基因组DNA 为模板,进行PCR 反应。反应结束后,对真菌的内源转录间隔区(ITS)扩增产物进行测序,得到测序结果后通过比对进行分子生物学鉴定。
2 结果与分析
2.1 甜菜生尾孢菌分生孢子的产生
甜菜生尾孢菌HL001 培养72 h 后,菌苔呈黑灰色,边缘不规则;气生菌丝稀疏,呈灰白色;在西红柿和V8 培养基上HL001的形态特征无明显差异(图1)。

图1 甜菜生尾孢菌HL001在西红柿培养基上的形态Fig.1 Morphology of Cercospora beticola HL001 on tomato culture medium
在西红柿培养基上,经25 ℃光照培养72 h 得到的甜菜生尾孢菌在显微镜下可以观察到大量分生孢子。在V8 培养基上培养的甜菜生尾孢菌,没有分生孢子产生。甜菜生尾孢菌HL001 的分生孢子梗密集成簇,基部颜色较深,上端颜色变浅,有隔膜,不分枝,笔直或略弯曲,前端比较尖。分生孢子单生、透明、披针状、笔直或略弯曲,隔膜处无缩缢,顶端钝状或尖锐状(图2)。
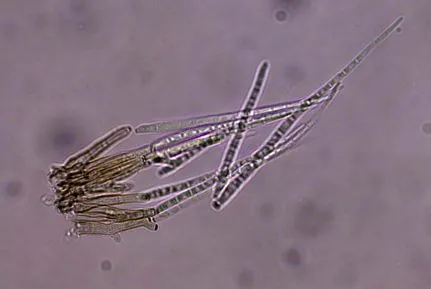
图2 甜菜生尾孢菌HL001的分生孢子和孢子梗形态Fig.2 Morphology of conidia and conidiophore of Cercospora beticola HL001
2.2 甜菜褐斑病发病条件的建立
接种甜菜生尾孢菌HL001 的孢子10 d 后,甜菜叶片上开始出现直径约3 mm 的圆形斑点,中心为灰色,周围为深褐色(图3A)。随着病情的发展,病斑数量不断增加,最终连结在一起,使得整片叶子干枯并收缩(图3B 和3C)。病斑从接种叶片逐渐扩散发展到植株的其他叶片,最终导致整个植株患病(图3D),甜菜褐斑病发病条件成功建立。

图3 接种甜菜尾孢菌HL001后发病症状Fig.3 Symptom after inoculation of Cercospora beticola HL001
2.3 病原真菌的分子生物学鉴定
测序结果表明:通过PCR 反应,得到了长度为509 bp 的内源转录间隔区序列(图4)。序列比对结果表明:此段序列与接种菌株甜菜生尾孢菌HL001 的内源转录间隔区序列相似度为100%,这表明盆栽甜菜叶片褐斑病发病是由接种甜菜生尾孢菌HL001引起的,符合病原学科赫氏法则。

图4 发病叶片病原真菌的ITS序列Fig.4 ITS sequence of pathogenic fungus from diseased leaf
3 讨论与结论
尾孢菌是在农业生产中普遍存在的重要病原,危害大豆、玉米等主要粮食作物以及甜菜等多种经济作物。通过分子生物学研究,阐释病原与作物互作及免疫过程的基因通路,进而对作物进行分子基因辅助育种,是作物病害防治的有效手段。进行以上试验研究的基础是建立一套成熟的病原真菌产孢及接种、发病条件体系,因此植物保护研究人员一直在这方面进行不断的探索。已有研究表明引起玉米灰斑病的玉蜀尾胞菌在玉米叶粉碳酸钙琼脂和玉米琼脂培养基上可以产生大量孢子,大豆尾孢菌在利马豆琼脂培养基上产孢量较高[8-9]。此外,光照和黑暗条件也是影响尾孢菌产孢的重要条件[10-11]。本研究发现,西红柿培养基适合甜菜生尾孢菌产孢。用西红柿培养基光照条件下培养甜菜生尾孢菌72 h就可产生分生孢子而且孢子数量可以满足接种和发病的研究需要。研究表明玉米灰斑病菌分生孢子的最适萌发温度为25 ℃[12-13],变灰尾孢菌和黄草褐斑病菌的分生孢子在水滴中即可萌发,最适萌发温度也为25 ℃[11,14]。本研究发现,高温度和湿度是甜菜生尾孢菌孢子萌发并致病的关键因素,当接种后前期温度为28 ℃,湿度90%时能够导致发病,且后续表现出明显的甜菜褐斑病发病症状。
本研究采用甜菜生尾孢菌HL001在西红柿培养基上使用涂抹方法接种,经25 ℃光照培养72 h可以得到大量分生孢子。分生孢子单生、透明、披针状、笔直或略弯曲,隔膜处无缩缢,顶端钝状或尖锐状。用孢子悬浮液喷洒接种甜菜叶片,温度28 ℃、湿度90%、光照培养72 h 转入常规培养,接种10 d 后叶片开始发病并迅速蔓延到整个植株。本方法可以成功建立甜菜褐斑病发病条件,为进一步利用分子生物学技术研究甜菜褐斑病防治奠定基础。
