新型苯并[b]氮杂-查尔酮杂合物的设计、合成及抗肿瘤活性研究
2022-01-12邓胜松喻明军姚日生
杨 瑞, 邓胜松, 喻明军, 姚日生
(合肥工业大学 食品与生物工程学院,安徽 合肥 230000)
以天然产物的母体结构作为基本骨架进行结构修饰和优化是新药或先导化合物的重要来源之一[1]。查尔酮是一类广泛存在于甘草、明日叶等药用植物中的多酚类黄酮物质[2],其母体结构是由α,β-不饱和酮连接两个芳环而成[3](Chart 1),具有较大的柔性,能与多种受体结合,表现出广泛的生物活性,如抗肿瘤[4]、抗氧化[5]、抗炎[6]等。此外,查尔酮还具有结构简单、易于合成等优点[7]。然而,活性低和细胞选择性差等缺点限制了其作为药物应用[8-11]。近年来,研究发现用各种氮杂环结构取代查尔酮的芳环,能够有效的提高查尔酮的抗肿瘤活性[12]。例如,Mirzaei[13]等用吲哚基取代查尔酮的芳环结构获得了一系列吲哚查尔酮衍生物,其中化合物1(Chart 1)对癌细胞株A549具有很强的抑制活性(IC50=4.3 μg/mL)。Kim[14]等用吡啶取代查尔酮的芳环结构获得了一系列吡啶查尔酮衍生物,其中化合物2(Chart 1)对癌细胞Huh7和293T具有很强的抑制活性(IC50分别为8.4 μmol·L-1和8.2 μmol·L-1)。Yin等[15]用哌嗪环取代查尔酮的芳环结构获得了一系列哌嗪查尔酮衍生物,其中化合物3(Chart 1)对癌细胞株MCF-7、A549和B16-F10具有很强的抑制活性(IC50分别为0.32 μg/mL、 0.54 μg/mL和0.44 μg/mL)。但是,迄今为止仍未有查尔酮类衍生物进入临床研究。
氮杂环结构因其环上的氮原子可以参与生物体中氢键的形成, 增加药物与受体的亲和力和选择性,近年来常被用于新型药物的研发[16-17]。其中,苯并氮杂(Chart 2)也就是俗称的苯并氮杂七元环,它是由一个苯环和含氮的七元环稠合在一起形成的母体结构[18],如常见的苯并[b]氮杂,1,5-苯并二氮杂等。由于其具有特殊的结构类型和电子云分布,使得苯并氮杂结构被广泛应用于抗肿瘤[19]、抗高血压[20]、抗炎[21]等药物的设计中,目前其骨架已被评定为药物化学领域的特权结构[22],特别是在抗肿瘤领域,苯并氮杂常被作为与肿瘤密切相关激酶(如PLKI、 VEGF-R2、 CDKs、 Cyclins等)抑制剂的骨架结构(Chart 2),用于抗肿瘤药物的设计[23-24]。
为了提高查尔酮的抗肿瘤活性和细胞选择性,本文基于分子杂交的策略[25]将苯并[b]氮杂结构引入查尔酮的母体结构中获得了新型的骨架结构(Chart 3),并对新骨架结构的B环及B环上的取代基(R)进行修饰,用氮杂环吡啶替换B环,探究氮杂环的引入对化合物生物活性的影响;B环上引入吸电子基团[4-Cl、 4-N(CH3)2等]和供电子基团(4-OCH3、 4-CH3等),探究电子云密度对化合物生物活性的影响,设计了12个未见文献报道的苯并[b]氮杂-查尔酮杂合物(7a~7l)。以苯胺为原料,经N-烷基化、羰基化、水解、环化和Claisen-Schmidt缩合反应合成了这12个目标化合物(Scheme1),其结构经1HNMR,13CNMR 和 HR-MS(ESI)表征。在化学工作的基础上,采用MTT法初步评价了目标化合物7a~7l对三种选定的人癌细胞(HGC-27, HepG2和A549)和一株人正常细胞(GES-1)的体外抗增殖活性,并进一步探究了活性最优化合物的抗肿瘤机制,以期获得一种高效、低毒的新型抗肿瘤先导化合物。
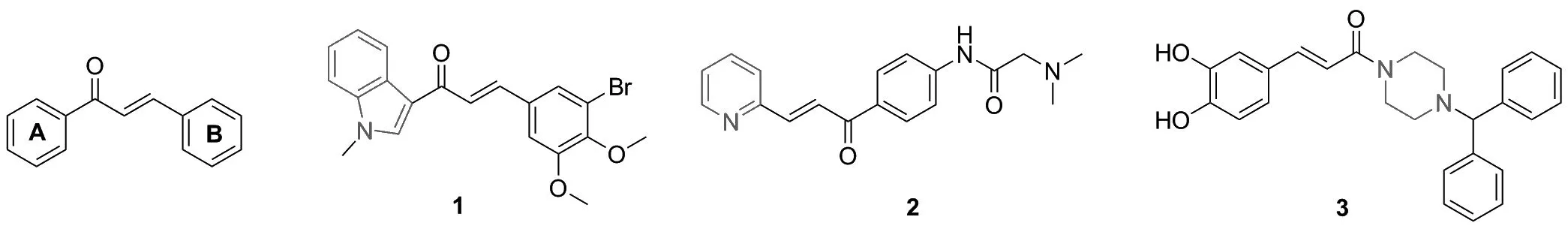
Chart 1

Scheme 1

Chart 2
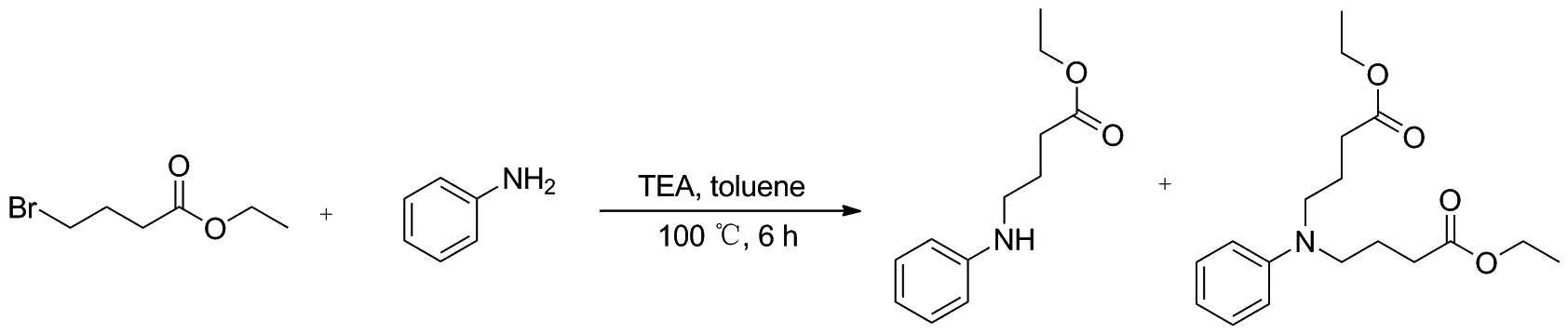
Scheme 2
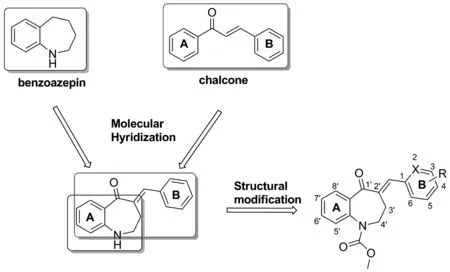
Chart 3
1 实验部分
1.1 仪器与试剂
WRX-4型显微熔点仪;Bruker 600 MHz型核磁共振仪(DMSO-d6,TMS为内标);AB SCIEX Triple TOFTM 5600型质谱仪;Epoch型连续波长酶标仪。
苯胺,4-溴丁酸乙酯,氯甲酸甲酯,无水三氯化铝和氯化亚砜,国药集团;人胃癌细胞(HGC-27)、人肝癌细胞(HepG2)、人非小细胞肺癌细胞(A549)和人正常胃黏膜上皮细胞(GES-1),美国细胞保存中心(ATCC);其余所用试剂均为分析纯。
1.2 合成
(1) 4-(苯基氨基)丁酸乙酯(2)的合成
将苯胺10.24 g(0.11 mol)、三乙胺45.80 mL(0.33 mol)和甲苯(33 mL)加入250 mL三口烧瓶中,加热至100 ℃,将4-溴丁酸乙酯20.46 mL(0.143 mol)溶于甲苯(30 mL),缓慢滴加入烧瓶,滴毕(60 min),于100 ℃下搅拌6 h(TLC监测)。反应液过滤、减压浓缩除溶剂得淡红色油状物。冰水静置结晶,过滤,石油醚洗涤,干燥的淡红色片状结晶28.42 g,收率82.3%;1H NMR(600 MHz, DMSO-d6)δ: 7.24(t,J=7.2 Hz, 2H), 6.74(d,J=7.7 Hz, 2H), 6.69(t,J=6.8 Hz, 1H),5.73(s, 1H), 4.24(q,J=6.5 Hz, 2H), 3.20(d,J=6.1 Hz, 2H), 2.57(t,J=7.1 Hz, 2H), 2.02~1.95(m, 2H), 1.38~1.33(m, 3H)。
(2) 4-(N-甲氧羰基苯胺基)丁酸(4)的合成
将中间体28.42 g(0.041 mol)、碳酸钠(Na2CO3) 5.194 g(0.049 mol)和甲苯(80 mL)加入250 mL三口烧瓶中,冷却至0 ℃,缓慢滴加氯甲酸甲酯 4.5 mL(0.058 mol),滴毕(5min),反应液在0 ℃下搅拌1 h(TLC监测)。反应完成后加水(2×100 mL)萃取,有机层减压浓缩得棕黄色油状液体3,加水(60 mL)、甲醇(40 mL)和氢氧化钠(NaOH) 3.28 g(0.082 mol),在65 ℃下搅拌2.5 h(TLC监测)。反应液减压浓缩除甲醇并用乙酸乙酯(2×50 mL)萃取,水层维持温度在20 ℃以下,用5%的稀盐酸调pH至1~2,用二氯甲烷(DCM)(2×100 mL)萃取,有机层用无水硫酸钠(Na2SO4)干燥和减压浓缩得油状液体,经硅胶柱层析[洗脱剂:V(石油醚)/V(二氯甲烷)=1/10]纯化得黄色油状液体45.75 g,收率68.3%;1H NMR(600 MHz, DMSO-d6)δ: 7.36(t,J=7.8 Hz, 2H), 7.27~7.21(m, 3H), 3.65(t,J=7.3 Hz, 2H), 3.55(s, 3H), 2.23(t,J=7.4 Hz, 2H), 1.73~1.64(m, 2H)。
(3) 1-甲氧羰基-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(6)的合成
将中间体45.75 g(0.024 mol)、无水DCM(50 mL)和N,N-二甲基甲酰胺(DMF)(2 mL)加入100 mL三口烧瓶中,冷却到0 ℃,控制温度在0 ℃缓慢滴加二氯亚砜2.55 mL(0.036 mol),滴毕(5 min),反应液温度上升至10 ℃下搅拌1.5 h(TLC监测)。反应液减压浓缩得油状液体5,用DCM(25 mL)溶解,直接用于下一步反应。
将无水DCM(120 mL)和无水三氯化铝(AlCl3)12.79 g(0.096 mol)加入到250 mL的三口烧瓶中,加热至35 ℃,将上一步含酰氯的DCM溶液,缓慢滴加到三口烧瓶中,滴毕(30 min),在35 ℃下搅拌3 h(TLC监测)。冷却至10 ℃,滴加预冷的5%稀盐酸(80 mL),滴毕,继续搅拌15 min,之后静置30 min,有机层分离、无水Na2SO4干燥并减压浓缩得粗产品,经硅胶柱层析[洗脱剂:V(石油醚)/V(二氯甲烷)=1/20] 纯化得棕黄色液体63.09 g,收率53.8%;1H NMR(600 MHz, DMSO-d6)δ: 7.43~7.31(m, 2H), 7.27~7.22(m, 2H), 3.67~3.61(m, 2H), 3.55(d,J=6.3 Hz, 3H), 2.31(t,J=7.4 Hz, 1H), 2.22(t,J=7.4 Hz, 1H), 1.74~1.60(m, 2H)。
(4)7a~7l的合成通法
将中间体60.219g(1 mmol)、不同取代的苯甲醛(1.2 mmol)、乙醇(6 mL)和氢氧化钾(KOH)0.11 g(2 mmol)加入50 mL单口烧瓶中,室温下搅拌6 h(TLC监测)。直接过滤得固体粗品,并将固体粗品用[V(石油醚)/V(二氯甲烷)=1/20]重结晶得纯化的目标化合物(7a~7l)。
(E)-1-甲氧羰基-4-(4-氯亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7a): 白色固体,收率52.3%, m.p.175~177 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.70~7.64(m, 3H), 7.61~7.58(m, 2H), 7.56~7.50(m, 3H), 7.39(d,J=7.8 Hz, 1H), 3.95(s, 2H), 3.53(d,J=37.0 Hz, 3H), 2.71(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.46, 155.56, 136.79, 136.38, 133.83, 133.55, 133.47, 131.36, 129.35, 129.18, 128.94, 128.39, 52.89, 47.19, 26.02; HR-MS(ESI)m/z: Calcd for C19H16NO3Cl{[M+H]+}342.0891, found 342.0886。
(E)-1-甲氧羰基-4-(4-甲氧基亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7b): 类白色固体,收率57.4%, m.p.173~175 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.68~7.62(m, 3H), 7.57(d,J=8.5 Hz, 2H), 7.50(t,J=7.5 Hz, 1H), 7.37(d,J=7.8 Hz, 1H), 7.05(d,J=8.4 Hz, 2H), 3.96(s, 2H), 3.81(s, 3H), 3.48(s, 3H), 2.75(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.67, 160.25, 155.64, 147.33, 138.03, 136.88, 133.23, 133.07, 131.78, 129.36, 129.11, 128.38, 126.97, 114.54, 55.37, 52.90, 47.35, 39.52, 26.17; HR-MS(ESI)m/z: Calcd for C20H19NO4{[M+H]+}338.1387, found 338.1396。
(E)-1-甲氧羰基-4-(4-(叔丁基)亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7c): 白色固体,收率53.2%, m.p.156~158 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.69~7.64(m, 3H), 7.54~7.49(m, 5H), 7.38(d,J=7.8 Hz, 1H), 3.97(s, 2H), 3.49(s, 3H), 2.74(s, 2H), 1.31(s, 9H);13C NMR(151 MHz, DMSO-d6)δ: 194.62, 155.57, 152.11, 138.05, 136.67, 134.65, 133.31, 131.82, 129.61, 129.35, 129.13, 128.36, 125.78, 52.86, 47.32, 39.52, 34.57, 30.94, 26.15; HR-MS(ESI)m/z: Calcd for C23H25NO3{[M+H]+}364.1907, found 364.1912。
(E)-1-甲氧羰基-4-(4-(二甲氨基)亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7d):黄色固体,收率58.6%, m.p.158~160 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.61(dd,J=18.2, 10.8 Hz, 3H), 7.49(t,J=9.5 Hz, 3H), 7.34(d,J=7.6Hz, 1H), 6.78(d,J=8.4 Hz, 2H), 3.96(s, 2H), 3.47(s, 3H), 2.99(s, 6H), 2.77(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.42, 155.62, 151.03, 138.94, 137.45, 132.79, 132.01, 129.73, 129.28, 128.94, 128.23, 121.53, 111.98, 52.81, 46.09, 39.66, 39.52, 26.39; HR-MS(ESI)m/z: Calcd for C21H22N2O3{[M+H]+}351.1703, found 351.1707。
(E)-1-甲氧羰基-4-(4-(甲基磺酰基)亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7e): 白色固体,收率52.7%, m.p.204~206 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.02(d,J=8.3 Hz, 2H), 7.80(d,J=8.3 Hz, 2H), 7.69(ddd,J=9.1, 8.4,4.8 Hz, 3H), 7.53(td,J=7.6, 0.7 Hz, 1H), 7.40(d,J=7.7 Hz, 1H), 3.96(s, 2H), 3.50(s, 3H), 3.27(s, 3H), 2.72(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.43, 155.58, 140.70, 139.88, 138.08, 136.32, 136.15, 133.70, 130.23, 129.43, 129.31, 128.48, 127.46, 127.08, 52.97, 47.19, 43.45, 39.52, 26.06; HR-MS(ESI)m/z: Calcd for C20H19NO5S{[M+H]+}386.1057, found 386.1692。
(E)-1-甲氧羰基-4-(3-氯亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7f): 淡灰色固体,收率58.4%, m.p.132~135 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.72~7.65(m, 2H), 7.63(s, 1H), 7.57(s, 1H), 7.54~7.47(m, 4H), 7.39(d,J=7.8 Hz, 1H), 3.92(s, 2H), 3.50(s, 3H), 2.70(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.47, 155.61, 136.98, 136.64, 136.29, 133.63, 133.57, 130.80, 129.40, 129.28, 129.15, 128.94, 128.48, 127.79, 52.97, 47.21, 39.52, 26.07; HR-MS(ESI)m/z: Calcd for C19H16ClNO3{[M+H]+}342.0891, found 342.0864。
(E)-1-甲氧羰基-4-(吡啶-2-亚甲基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7g): 类白色固体,收率56.5%, m.p.153~155 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.73(d,J=4.1 Hz, 1H), 7.89(td,J=7.7, 1.7 Hz, 1H), 7.74~7.64(m,3H), 7.52(dd,J=13.9, 6.4 Hz, 2H), 7.43~7.34(m, 2H), 3.97(s, 2H), 3.46(s, 3H), 3.35~3.12(m, 2H);13C NMR(151 MHz, DMSO-d6)δ:195.35, 155.55, 153.91, 149.83, 138.89, 137.17, 136.10, 134.66, 133.49,129.49, 129.24, 128.27, 128.04, 123.81, 52.77, 47.05, 39.52, 26.16; HR-MS(ESI)m/z: Calcd for C18H16N2O3{[M+H]+}309.1234, found 309.1208。
(E)-1-甲氧羰基-4-((5-溴吡啶-2-基)亚甲基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7h): 白色固体,收率49.7%, m.p.200~202 ℃;1H NMR(600 MHz, DMSO-d6)δ: 8.85(d,J=2.0 Hz, 1H), 8.16(dd,J=8.3, 2.3 Hz, 1H), 7.68(dd,J=18.6,7.8 Hz, 3H), 7.55~7.48(m, 2H), 7.37(d, J=7.8 Hz, 1H), 3.95(s, 2H), 3.46(s, 3H), 3.20(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 195.23, 152.65, 150.55, 139.77, 139.68, 135.94, 133.60, 133.43, 129.51, 129.46, 129.29, 128.32, 128.32, 120.41, 52.80, 46.86, 39.52, 26.20; HR-MS(ESI)m/z: Calcd for C18H15BrN2O3{[M+H]+}387.0339, found 387.0285。
(E)-1-甲氧羰基-4-(4-溴亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7i): 白色固体,收率55.3%, m.p.185~187 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.68(t,J=9.1 Hz, 4H), 7.63(s, 1H), 7.51(dd,J=7.4, 4.9 Hz, 3H), 7.39(d,J=7.7 Hz, 1H), 3.94(s, 2H), 3.49(s, 3H), 2.70(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.46, 155.55, 136.89, 136.38, 136.14, 133.90, 133.48, 131.87, 131.59, 131.28, 129.37, 129.19, 128.40, 122.61, 52.90, 47.17, 39.52, 26.01; HR-MS(ESI)m/z: Calcd for C19H16BrNO3{[M+H]+}386.0386, found 386.0314。
(E)-1-甲氧羰基-4-(4-甲基亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7j): 白色固体,收率52.2%, m.p.143~146 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.69~7.64(m, 3H), 7.50(ddd,J=22.7, 11.3, 4.4 Hz, 3H), 7.38(d,J=7.7Hz, 1H), 7.30(d,J=7.9 Hz, 2H), 3.95(s, 2H), 3.49(s, 3H), 2.73(s, 2H), 2.35(s, 3H);13C NMR(151 MHz, DMSO-d6)δ: 194.56, 155.54, 139.15, 138.16, 136.66, 134.51, 133.26, 131.77, 129.70, 129.53, 129.31, 129.09, 128.32, 52.83, 47.32, 39.52, 26.09, 20.97; HR-MS(ESI)m/z: Calcd for C20H19NO3{[M+H]+}322.1438, found 322.1388。
(E)-1-甲氧羰基-4-(2-甲氧基亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7k): 白色固体,收率58.2%, m.p.173~175 ℃;1H NMR(600 MHz, DMSO-d6)δ:7.86(s, 1H), 7.67~7.63(m, 2H), 7.53~7.48(m, 1H), 7.44~7.35(m, 3H),7.11(d,J=8.3 Hz, 1H), 7.06(t,J=7.5 Hz, 1H), 3.92(s, 2H), 3.83(s, 3H), 3.50(s, 3H), 2.61(s, 2H);13C NMR(151 MHz, DMSO-d6)δ: 194.44, 157.92, 155.58, 136.94, 134.87, 134.63, 133.23, 130.96, 129.26, 129.02, 128.36, 123.33, 120.53, 111.41, 55.59, 52.88, 47.58, 39.52, 26.18; HR-MS(ESI)m/z: Calcd for C20H19NO4{[M+H]+}338.1387, found 338.1367。
(E)-1-甲氧羰基-4-(4-丙氧基亚苄基)-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(7l): 类白色固体,收率53.2%, m.p.110~113 ℃;1H NMR(600 MHz, DMSO-d6)δ: 7.68~7.62(m, 3H), 7.56(d,J=8.7 Hz, 2H), 7.50(td,J=7.5, 0.7 Hz, 1H), 7.37(d,J=7.7 Hz, 1H), 7.04(d,J=8.7 Hz, 2H), 3.98(t,J=6.5 Hz, 4H), 3.48(s, 3H), 2.75(s, 2H), 1.78~1.70(m, 2H), 0.98(t,J=7.4 Hz, 3H);13C NMR(151 MHz, DMSO-d6)δ: 194.56, 159.66, 155.57, 137.99, 136.86, 133.13, 132.92, 131.72, 129.30, 129.04, 128.29, 126.77, 114.91, 69.11, 52.81, 47.32, 39.52, 26.14, 21.96, 10.36; HR-MS(ESI)m/z: Calcd for C22H23NO4{[M+H]+}366.1700, found 366.1676。
1.3 体外抗增殖活性评价
将待测化合物和阳性对照顺铂(cisplatin)用DMSO溶解并稀释成所需的5种浓度(100、 20、 4.0、 0.8和0.16μmol·L-1)。取对数生长期的癌细胞(HGC-27、 A549和HepG2)和正常细胞(GES-1)以每孔5000个接种到96孔板中,孵育12 h。将不同浓度的供试化合物(100、 20、 4.0、 0.8、 0.16、 0 μmol·L-1)添加到每个孔中,并孵育48 h。将10 μL的MTT(5 mg/mL)添加到每个孔中,孵育4 h,除去培养基并添加DMSO(200 μL),轻轻的摇晃15 min,用酶标仪测定490 nm波长的吸光度。计算各组对癌细胞的存活率。将数据导入GraphPad Prism软件中计算IC50值,所有试验在相同条件下重复3次[26]。
1.4 细胞凋亡实验
HGC-27细胞(每孔30万)接种在6孔板中,孵育12 h。将不同浓度的供试化合物(5、1、 0.2、 0μmol·L-1)添加到每个孔中,并孵育24 h,收集细胞。PBS洗涤(4 ℃),然后离心(1200 r/min),去除上清液,加入Binding buffer(200 μL)、Annexin V-FITC(5 μL)和PI(10 μL)染料混合,避光孵育(25 ℃, 5 min),流式细胞仪分析染色细胞,所有实验在相同条件下重复3次[27]。
1.5 细胞凋亡实验
细胞孵育与加药同1.4细胞凋亡实验,收集细胞用预冷的70%乙醇溶液(1 mL)固定12 h(4 ℃),离心(1000 r/min, 5 min),弃去70%乙醇溶液,PBS冲洗。每管加入0.5 mL氧化丙啶染色液[氧化丙啶染色液(20×)/RNase A(50×)=50/2.5/1),重悬,避光孵育(30 min),使用流式细胞仪分析细胞周期,相同条件下重复实验3次[28]。
1.6 蛋白印迹法实验
HGC-27细胞(每孔100万)接种在6孔板中,孵育12 h,将不同浓度的供试化合物(0、 0.5和1.0μmol·L-1)添加到每个孔中,并孵育48 h。收集细胞裂解(冰上),离心(12000 r/min,30 min, 4 ℃),弃去沉淀,加入蛋白上样缓冲液(37 μL),用水浴锅(100 ℃, 10 min)煮,变性后裂解液在SDS-PAGE中分离,并将其转移到PVDF膜上,加入一抗(抗Bax、抗Bcl-2)在4 ℃下孵育18 h,然后用二抗孵育,洗涤后检测目标蛋白[29]。
2 结果与讨论
2.1 合成
合成中间体4-(苯基氨基)丁酸乙酯(2)时,在碱性条件下,苯胺与4-溴丁酸乙酯易发生N-烷基化反应(Scheme 2)。但是,由于N-单烷基化产物上的氨基受到相连烷基的作用,氨基活性得到了提高,常伴有双烷基化的副产物产生,导致反应收率下降,通过文献调研[30-31]和实验探究发现了最佳的反应条件[投料比:4-溴丁酸乙酯/苯胺=1.3/1,溶剂:甲苯,缚酸剂和用量:三乙胺(3eq.), 温度和时间:100 ℃和6 h],有效的减少了双烷基化副产物的生成,使反应产率达到了80%~85%。
合成中间体1-甲氧羰基-5-氧代-2,3,4,5-四氢-1H-苯并[b]氮杂(6)时,选用了2种催化剂进行傅克酰基化反应。(1)以多聚磷酸(PPA)做催化剂[32],1,1,2,2-四氯乙烷做溶剂,在110 ℃下反应6 h,可使原料直接从羧酸(4)得到中间体(6),收率为42.6%;(2)以路易斯酸AlCl3做催化剂[33],首先以N,N-二甲基甲酰胺(DMF)为催化剂,用价格便宜的二氯亚砜将羧酸(4)酰氯化转化为酰氯(5),以酰氯为酰化剂时,用路易斯酸AlCl3做催化剂,以无水二氯甲烷做溶剂,35 ℃下反应3 h可获得中间体(6),收率为53.8%。其中PPA具有粘稠性高、易吸潮且价格高等缺点,同时在110 ℃时,才能溶解在溶剂1,1,2,2-四氯乙烷中,所以反应温度必须维持在110 ℃左右才能维持均相体系,考虑到催化剂的价格、产物的收率及操作的难易程度,最终选用路易斯酸AlCl3做催化剂合成中间体6。
在合成目标化合物(7a~7l)时,选用了2种方法合成。(1)酸法[34]:以浓硫酸做催化剂,冰醋酸做溶剂,在60 ℃下反应6 h获得目标化合物,收率约为40%。(2)碱法[35]:以强碱KOH做催化剂,乙醇做溶剂,在室温下反应6 h获得目标化合物,收率约为55%。考虑到碱法相比于酸法具有条件温和、操作简单、成本低和收率高等优点,选择碱法合成目标化合物7a~7l。
2.2 体外抗增殖活性评价
采用MTT法对所合成的12个新型苯并[b]氮杂-查尔酮杂合物进行了体外抗增殖活评价。以标准药物顺铂做为阳性对照,评价了目标化合物7a~7l对3种人癌细胞(HGC-27、HepG2和A549)的体外抗增殖活性,结果见表1。由表1可知,目标化合物对HGC-27细胞具有较强的抗增殖活性(IC50=0.78~20 μmol·L-1),对HepG2和A549细胞表现出中等的抗增殖活性(IC50=9.73~35 μmol·L-1)。其中化合物7b(IC50=0.80 μmol·L-1)和7d(IC50=0.78 μmol·L-1)对HGC-27细胞的抗增殖活性优于阳性对照顺铂(IC50=7.38 μmol·L-1)。

表1 化合物7a~7l对3种癌细胞的抗增殖活性
比较化合物7a~7l对HGC-27细胞的抗增殖活性(除化合物7b外)可知,在苯并[b]氮杂-查尔酮杂合物的B环上引入吸电子基团(增加电子云密度)会显著提高化合物的抗增殖活性。比较化合物7a(4-Cl,IC50=4.90 μmol·L-1)与7f(3-Cl, IC50=6.30 μmol·L-1)和化合物7b(4-OCH3), IC50=0.80 μmol·L-1) 与7k(2-OCH3), IC50=12.13 μmol·L-1) 对HGC-27细胞的抗增殖活性可知,当R取代基位于B环C-4位置有利于提高化合物的抗增殖活性。比较化合物7h(IC50=6.89 μmol·L-1)与7i(IC50=7.12 μmol·L-1) 对HGC-27细胞的抗增殖活性可知,当用杂环吡啶替代苯并[b]氮杂-查尔酮杂合物的B环时对化合物的抗增殖活性影响不大。
选择对HGC-27细胞具有有效抗增殖活性的化合物7b和7d,检测其对人正常胃粘膜上皮细胞GES-1的毒性,结果见表2。由表2可知,化合物7d(IC50=22.77 μmol·L-1)对人正常细胞GES-1的毒性比化合物7b(IC50=7.40 μmol·L-1)和顺铂(IC50=9.51 μmol·L-1)弱。然而化合物7d(IC50=0.78 μmol·L-1, SI=29.19)对人胃癌细胞HGC-27的毒性比化合物7b(IC50=0.80 μmol·L-1, SI=9.25)和顺铂(IC50=7.38 μmol·L-1, SI=1.29)强。结果表明,化合物7d在肿瘤细胞和正常细胞之间具有良好的选择性。因此,选择化合物7d进一步探究其抗肿瘤机制。

表2 化合物7b和7d对HGC-27细胞和GES-1细胞的抗增殖活性
2.3 化合物7d诱导HGC-27细胞凋亡
采用流式细胞术探究了化合物7d对癌细胞HGC-27的细胞凋亡影响,结果见图1。由图1可知,不同浓度的化合物7d处理HGC-27细胞后,早期凋亡(0.2 μmol·L-1: 14.04%; 1 μmol·L-1: 20.13%; 5 μmol·L-1: 32.89%)和晚期凋亡(0.2 μmol·L-1: 13.06%; 1 μmol·L-1: 16.69%; 5 μmol·L-1: 17.80%)的比例都明显高于空白对照组(7.61%; 8.24%),同时随着给药浓度的增加,早期凋亡和晚期凋亡的比例明显增加。结果表明,化合物7d显著诱导了HGC-27细胞的凋亡,且细胞凋亡呈浓度的依赖性。

Concentration/μmol·L-1
2.4 化合物7d诱导HGC-27细胞G2/M期阻滞
采用流式细胞术探究了化合物7d对癌细胞HGC-27细胞周期分布的影响,结果见图2。由图2可知,不同浓度的化合物7d处理HGC-27细胞后,G2/M期的细胞比例(0.2 μmol·L-1: 22.52%; 1 μmol·L-1: 67.99%; 5 μmol·L-1: 77.28%)明显高于空白对照组(9.06%)且G0/G1期的细胞比例(0.2 μmol·L-1: 70.33%; 1 μmol·L-1: 22.00%; 5 μmol·L-1: 16.94%)明显低于空白对照组(79.08%),同时随着给药浓度的增加,G2/M期的细胞比例明显增加且G0/G1期的细胞比例明显减少。结果表明,化合物7d能以浓度依赖性的方式对HGC-27细胞在G2/M期引起明显的细胞周期阻滞。

Concentration/μmol·L-1
2.5 化合物7d调控凋亡相关蛋白Bax和Bcl-2的表达
采用蛋白印迹法在蛋白水平上探究了化合物7d诱导HGC-27细胞凋亡的机制,结果见图3。由图3可知,不同浓度的化合物7d处理HGC-27细胞后,与对照组相比,促凋亡蛋白Bax表达量增加,抗凋亡蛋白Bcl-2的表达量减少,且二者均具有剂量的依赖性。结果表明,7d是通过调控凋亡相关蛋白的表达来诱导HGC-27细胞的凋亡。

图3 7d对HGC-27细胞中凋亡相关蛋白表达的影响a
通过将苯并[b]氮杂结构与具有抗肿瘤活性的天然产物查尔酮母体结构杂交,设计并合成了12个新型的苯并[b]氮杂-查尔酮杂合物(7a~7l)。初步的体外抗增殖活性实验发现,目标化合物对HGC-27细胞展现出了较强的抗增殖活性,尤其是化合物7d对HGC-27细胞的抗增殖活性最强(IC50=0.78 μmol·L-1),优于阳性对照顺铂(IC50=7.38 μmol·L-1),同时其对正常细胞GES-1的毒性较低(IC50=22.77 μmol·L-1, SI=29.19),弱于阳性对照顺铂(IC50=9.51 μmol·L-1, SI=1.29)。进一步抗肿瘤机制研究发现,化合物7d能够将癌细胞HGC-27的细胞周期阻滞在G2/M期,并通过增加促凋亡蛋白Bax和降低抗凋亡蛋白Bcl-2的表达来诱导HGC-27细胞的凋亡。以上研究获得了一种高效、低毒的先导化合物7d为查尔酮衍生物类抗肿瘤药物的研发提供了新的骨架结构,具有进一步开发为新型抗胃癌药物的潜力。
