新型异噁唑-三氟甲基螺环氧化吲哚类化合物的合成及其抗白血病活性
2022-01-12潘博文韩晓雪田又平刘雄利
潘博文, 韩晓雪, 石 洋, 田又平*, 刘雄利
(1. 贵州中医药大学 药学院,贵州 贵阳 550025; 2. 贵州大学 西南药食两用资源开发利用技术国家地方联合工程研究中心,贵州 贵阳 550025)
“多样性导向合成”(DOS)概念由哈佛大学Schreiber教授于2000年提出, 它以一种“高通量”的方式产生“类天然产物”的化合物库。[1-5]开发多样性导向合成策略合成新的生物活性相关骨架杂化分子是药物化学的一个重要课题。[6-10](1)异噁唑骨架普遍存在于天然产物和药物分子中[11-14],如Cloxacillin, Muscimol, Leflunomide和Isoxicam等,吸引了药物化学工作者的广泛关注;(2)螺环氧化吲哚也广泛存在天然产物和合成生物活性分子中,[15-18]例如,Pteropodine, Satavaptan 和Alstonisine。由于氟原子半径小,电负性高,在生物活性分子中引入三氟甲基可以提高药物受体的结合亲和力,因此,将CF3和异噁唑骨架拼接到螺环氧化吲哚骨架上,合成一系列具备潜在生物活性的未见文献报道的异噁唑-三氟甲基螺环氧化吲哚类化合物,可以为后续生物活性筛选提供化合物源,在新药创制领域具有重要的潜在价值。
本文以靛红衍生的三氟甲基亚胺(1)与硝基异噁唑苯乙烯(2)为起始原料[19],在有机碱三乙胺的催化作用下,发生Michael加成环化反应,得到了12个未见文献报道的异噁唑-三氟甲基螺环氧化吲哚类化合物3a~3l,产率73%~89%,dr值10/1~>20/1, 其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,通过单晶进一步进行了确定化合物3e的相对构型。该类骨架化合物含有连续4个立体中心,其中包含一个螺环季碳中心,可以为后续生物活性评价提供化合物源。
1 实验部分
1.1 仪器与试剂
WRS-1B型数字熔点仪;Bruker-400 MHz型核磁共振仪(CDCl3为溶剂,TMS为内标); MicroTMQ-TOF型高分辨质谱仪。
所用试剂均为分析纯。
1.2 3a~3l的合成(以3a为例)
在反应管中依次加入72.6 mg靛红衍生的三氟甲基亚胺1a(0.30 mmol), 4.0 mg催化剂Et3N(20 mol%, 0. 04 mmol),58.0 mg硝基异噁唑苯乙烯2a(0.20 mmol) 和1.0 mL二氯甲烷溶液,在室温中搅拌反应2 d(TLC检测)。经硅胶柱层析[洗脱剂:V(石油醚)/V(乙酸乙酯)=4/1,V/V]纯化得91.5 mg化合物3a。
用类似的方法合成3b~3l。
3a: 淡黄色固体,m.p.192.3~193.8 ℃;产率86%, >20/1dr;1H NMRδ: 2.19(s, 3H), 2.71(br s, 1H), 3.11(s, 3H), 3.75(s, 3H), 3.83(s, 3H), 4.33~4.38(m, 1H), 4.63~4.67(m, 1H), 4.75(d,J=11.2 Hz, 1H), 6.62(d,J=7.6 Hz, 1H), 6.73(d,J=8.8 Hz, 1H), 6.83~6.86(m, 1H), 6.98~7.01(m, 3H), 7.11~7.14(m, 1H);13C NMRδ: 10.2, 25.5, 46.2, 53.8, 54.8, 55.0, 63.5(q,JC,F=30.6 Hz), 68.3, 107.4, 109.9, 110.4, 119.4, 122.0, 123.5(q,JC,F=270.0 Hz), 123.7, 126.6, 127.7, 129.1, 142.2, 147.8, 148.4, 154.7, 169.0, 177.8; HR-MS(ESI-TOF)m/z: Calcd. for C25H23N4O6F3Na{[M+Na]+}555.1462, found 555.1467。
3b: 淡黄色固体,m.p.117.6~119.1 ℃;产率87%, 15/1dr;1H NMRδ: 1.19~1.22(m, 3H), 2.17(s, 3H), 2.18(s, 3H), 2.37(s, 3H), 2.68(br s, 1H), 3.56~3.61(m, 1H), 3.71~3.76(m, 1H), 4.57~4.62(m, 1H), 4.70~4.75(m, 1H), 4.84(d,J=10.8 Hz, 1H), 6.65(d,J=8.0 Hz, 1H), 6.81~6.87(m, 2H), 6.99~7.02(m, 2H), 7.09~7.13(m, 1H), 7.56(d,J=8.0 Hz, 1H);13C NMRδ: 10.2, 11.1, 18.2, 19.9, 34.1, 41.1, 53.9, 64.5(q,JC,F=30.2 Hz), 68.3, 107.5, 121.8, 123.8, 123.9(q,JC,F=270.7 Hz), 126.8, 129.1, 130.5, 130.8, 135.9, 136.4, 141.5, 154.7, 169.3, 177.6; HR-MS(ESI-TOF)m/z: Calcd. for C26H25N4O4F3Na{[M+Na]+}537.1720, found 537.1720。
3c: 淡黄色固体,m.p.172.1~173.6 ℃;产率72%, >20/1dr;1H NMRδ: 2.10(s, 3H), 2.23(s, 3H), 2.73(br s, 1H), 4.35~4.40(m, 1H), 4.66~4.69(m, 1H), 4.79(d,J=10.8 Hz, 1H), 4.90(d,J=16.4 Hz, 1H), 5.24(d,J=16.4 Hz, 1H), 6.72~6.76(m, 1H), 6.80(d,J=7.6 Hz, 1H), 6.86(d,J=7.2 Hz, 1H), 7.10(d,J=7.6 Hz, 2H), 7.16-7.20(m, 1H), 7.23~7.27(m, 2H), 7.34~7.40(m, 4H);13C NMRδ: 9.0, 16.3, 43.4, 44.9, 52.4, 62.5(q,JC,F=30.7 Hz), 66.5, 118.0, 120.0, 120.5, 120.9, 123.4, 125.1, 125.7, 126.7, 127.3(q,JC,F=270.5 Hz), 127.6, 130.1, 131.9, 133.3, 134.7, 138.4, 153.5, 167.5, 177.9; HR-MS(ESI-TOF)m/z: Calcd. for C29H21N4O4BrClF3Na{[M+Na]+}683.0279, found 683.0278。

Scheme 1
3d: 淡黄色固体,m.p.172.1~173.6 ℃;产率73%, >20/1dr;1H NMRδ: 1.37(s, 9H), 2.25(s, 3H), 2.97(br s, 1H), 4.17~4.30(m, 2H), 4.33~4.38(m, 1H), 4.50~4.57(m, 1H), 4.8(d,J=11.6 Hz, 1H), 6.40~6.43(m, 1H), 6.81~6.86(m, 1H), 6.99~7.02(m, 1H), 7.29(d,J=8.8 Hz, 2H), 7.39(d,J=8.8 Hz, 2H);13C NMRδ: 10.4, 27.0, 41.2, 46.1, 53.7, 63.6(q,JC,F=31.0 Hz), 68.6, 82.2, 108.4(d,JC,F=8.0 Hz), 112.3(d,JC,F=25.1 Hz), 115.5(d,JC,F=24.2 Hz), 121.5, 128.5, 128.6, 127.0(q,JC,F=270.0 Hz), 128.7, 130.6, 131.4, 133.6, 136.7, 154.9, 158.2(d,JC,F=242.3 Hz), 164.8, 166.4, 176.8; HRMS(ESI-TOF)m/z: Calcd. for C28H25N4O6BrF4Na{[M+Na]+}691.0786, found 691.0788。
3e: 淡黄色固体,m.p.231.4~232.9 ℃;产率84%, 16/1dr;1H NMRδ: 2.19(s, 3H), 2.24(s, 6H), 2.45(s, 3H), 2.71(br s, 1H), 3.17(s, 3H), 4.65~4.68(m, 1H), 4.75~4.80(m, 1H), 4.86(d,J=10.8 Hz, 1H), 6.57(d,J=8.0 Hz, 1H), 6.82(s, 1H), 6.93(s, 1H), 6.97(d,J=8.0 Hz, 1H), 7.06(d,J=8.0 Hz, 1H), 7.62(d,J=8.0 Hz, 1H);13C NMRδ: 10.2, 18.3, 19.8, 19.9, 25.5, 40.8, 52.4, 54.1, 64.5(q,JC,F=30.9 Hz), 68.4, 107.1, 123.1(q,JC,F=271.0 Hz), 124.2, 126.5, 126.9, 129.3, 130.5, 130.9, 131.7, 135.9, 136.4, 140.0, 154.7, 169.5, 178.0; HR-MS(ESI-TOF)m/z: Calcd. for C26H25N4O4F3Na{[M+Na]+}537.1720, found 537.1723。
3f: 淡黄色固体,m.p.116.7-118.2 ℃;产率77%, 10/1dr;1H NMRδ: 2.14(s, 3H), 2.21(s, 3H), 2.67(br s, 1H), 3.09(s, 3H), 3.76(s, 3H), 3.84(s, 3H), 4.32~4.38(m, 1H), 4.62~4.67(m, 1H), 4.73(d,J=11.2 Hz, 1H), 6.51(d,J=7.6 Hz, 1H), 6.73~6.78(m, 2H), 6.91~6.93(m, 1H), 6.99~7.01(m, 2H);13C NMRδ: 10.2, 19.8, 25.5, 46.1, 53.8, 54.8, 55.0, 63.8(q,JC,F=30.2 Hz), 68.4, 107.1, 109.4, 110.7, 119.7, 122.2, 123.3(q,JC,F=270.0 Hz), 124.7, 127.6, 127.9, 129.3, 142.5, 147.9, 148.5, 154.8, 169.1, 177.8; HR-MS(ESI-TOF) m/z: Calcd. for C26H25N4O6F3Na{[M+Na]+}569.1618, found 569.1615。
3g: 淡黄色固体,m.p.193.5~195.0 ℃;产率76%, 13/1dr;1H NMRδ: 2.25(s, 3H), 2.68(br s, 1H), 3.12(s, 3H), 4.37~4.42(m, 1H), 4.65~4.71(m, 1H), 4.75(d,J=10.8 Hz, 1H), 6.53(d,J=8.4 Hz, 1H), 7.08(s, 1H), 7.19~7.23(m, 1H), 7.26~7.30(m, 3H), 7.46(d,J=7.2 Hz, 2H);13C NMRδ: 10.2, 25.6, 46.1, 53.8, 63.5(q,JC,F=30.4 Hz), 68.3, 108.8, 114.6, 124.2(q,JC,F=270.2 Hz), 127.0, 127.2, 127.3, 128.2, 128.5, 132.0, 135.1, 141.4, 154.8, 168.5, 177.3; HR-MS(ESI-TOF)m/z: Calcd. for C23H18N4O4BrF3Na{[M+Na]+}573.0356, found 573.0357。
3h: 淡黄色固体,m.p.230.3~231.84 ℃;产率75%, >20/1dr;1H NMRδ: 2.27(s, 3H), 2.66(br s, 1H), 3.13(s, 3H), 4.34~4.39(m, 1H), 4.63~4.69(m, 2H), 6.54(d,J=8.4 Hz, 1H), 7.04(s, 1H), 7.25~7.30(m, 3H), 7.40(d,J=8.8 Hz, 2H);13C NMRδ: 10.2, 25.6, 45.5, 53.6, 63.4(q,JC,F=30.1 Hz), 68.2, 108.9, 114.7, 127.0, 124.4(q,JC,F=270.5 Hz), 128.2, 128.5, 128.6, 132.1, 133.3, 133.7, 141.4, 154.9, 168.3, 177.3; HR-MS(ESI-TOF) m/z: Calcd. for C23H17N4O4BrClF3Na{[M+Na]+}606.9966, found 606.9964。
3i: 淡黄色固体,m.p.233.5~235.0 ℃;产率73%, >20/1dr;1H NMRδ: 2.27(s, 3H), 2.66(br s, 1H), 3.12(s, 3H), 4.33~4.38(m, 1H), 4.64~4.69(m, 2H), 6.54(d,J=8.4 Hz, 1H), 7.03(s, 1H), 7.27~7.30(m, 1H), 7.34(d,J=8.4 Hz, 2H), 7.41(d,J=8.4 Hz, 2H);13C NMRδ: 10.2, 25.6, 45.6, 53.6, 64.0(q,JC,F=30.3 Hz), 68.2, 108.9, 114.7, 121.4, 125.2(q,JC,F=270.0 Hz), 126.9, 128.2, 128.9, 131.4, 132.1, 134.2, 141.4, 154.9, 168.3, 177.3; HR-MS(ESI-TOF)m/z: Calcd. for C23HN417O4Br2F3Na{[M+Na]+}650.9461, found 650.9465。
3j: 淡黄色固体,m.p.163.4~164.9 ℃;产率86%, >20/1dr;1H NMRδ: 2.19(s, 3H), 2.23(s, 3H), 2.38(s, 3H), 2.65(br s, 1H), 3.12(s, 3H), 4.58~4.63(m, 1H), 4.68~4.73(m, 1H), 4.78(d,J=10.4 Hz, 1H), 6.53(d,J=8.4 Hz, 1H), 6.88(s, 1H), 7.00(d,J=8.0 Hz, 1H), 7.05(s, 1H), 7.25~7.27(m, 1H), 7.54(d,J=8.0 Hz, 1H);13C NMRδ: 10.2, 18.3, 19.9, 25.6, 40.7, 54.0, 64.3(q,JC,F=30.4 Hz), 68.2, 108.8, 114.6, 125.0(q,JC,F=270.3 Hz), 125.9, 126.9, 128.5, 129.8, 130.5, 130.6, 131.9, 136.0, 136.6, 141.4, 154.8, 169.0, 177.6; HR-MS(ESI-TOF)m/z: Calcd. for C25H22N4O4BrF3Na{[M+Na]+}601.0669, found 601.0665。
3k: 淡黄色固体,m.p.187.1~188.6 ℃;产率76%, >20/1dr;1H NMRδ: 2.26(s, 3H), 2.68(br s, 1H), 3.12(s, 3H), 3.77(s, 3H), 3.84(s, 3H), 4.31~4.37(m, 1H), 4.63(s, 1H), 4.72(d,J=10.8 Hz, 1H), 6.52(d,J=8.4 Hz, 1H), 6.74(d,J=8.0 Hz, 1H), 6.97~6.99(m, 2H), 7.09(s, 1H), 7.27~7.29(m, 1H);13C NMRδ: 10.2, 25.6, 46.0, 53.8, 54.8, 55.0, 63.5(q,JC,F=30.5 Hz), 68.2, 108.8, 109.9, 110.5, 114.6, 119.4, 127.2(q,JC,F=270.2 Hz), 127.4, 128.6, 132.0, 141.3, 147.9, 148.4, 154.8, 168.6, 177.3; HR-MS(ESI-TOF)m/z: Calcd. for C25H22N4O6BrF3Na{[M+Na]+}633.0567, found 633.0563。
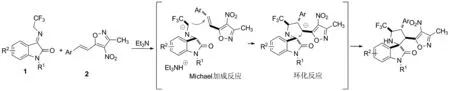
Scheme 2
3l: 淡黄色固体,m.p.117.4~118.9 ℃;产率89%, 12/1dr;1H NMRδ: 1.17~1.21(m, 3H), 2.20(s, 3H), 2.58(br s, 1H), 3.55~3.60(m, 1H), 3.69~3.72(m, 1H), 3.75(s, 3H), 3.83(s, 3H), 4.33~4.39(m, 1H), 4.61~4.68(m, 1H), 4.78(d,J=10.8 Hz, 1H), 6.64(d,J=8.0 Hz, 1H), 6.73(d,J=8.8 Hz, 1H), 6.82~6.85(m, 1H), 6.98~7.02(m, 3H), 7.09~7.13(m, 1H);13C NMRδ: 10.3, 11.1, 34.1, 46.3, 53.6, 54.8, 55.0, 63. 5(q,JC,F=30.3 Hz), 68.3, 107.5, 109.9, 110.4, 119.4, 121.8, 123.9(q,JC,F=270.8 Hz), 126.8, 127.8, 129.1, 129.8, 141.4, 147.8, 148.4, 154.7, 169.0, 177.4; HR-MS(ESI-TOF)m/z: Calcd. for C26H25N4O6F3Na{[M+Na]+}569.1618, found 569.1621。
2 结果与讨论
2.1 合成
对底物通过扩展,该反应活性较高,TLC检测2 d基本能反应完全, 目标化合物3产率为75%~89%,dr值10/1~>20/1。硝基异噁唑苯乙烯2取代基为甲基,甲氧基时,产率较高,可能因为原料的溶解性较好, 溶解性较差的底物后续可以适当增加溶剂量提高产率。
2.2 化合物3e的单晶制备
在无水乙醇溶剂中对化合物3e进行了单晶培养,分析确证白色晶体3e(CCDC: 2104259)的结构。图1为化合物3e的单晶结构图。由图1分析可知,化合物3e属triclinic晶系,P-1空间群,晶胞参数a=9.0057(6)Å,b=10.4750(6)Å,c=14.2786(9)Å,α=78.843(5)°,β=72.211(6)°,γ=73.123(5)°。
2.3 反应机理
基于文献[20-22]报道,推测该反应可能机理如下图2所示:靛红衍生的三氟甲基亚胺1在有机碱三乙胺的催化作用下,与硝基异噁唑苯乙烯2发生Michael加成环化反应, 获得目标产物异噁唑-三氟甲基螺环氧化吲哚类化合物3。
2.4 抗肿瘤活性[19-21]
表1为3a~3l对K562的体外抗肿瘤活性,阳性对照药顺铂IC50为23.1 μmol·L-1。由表1可见,化合物3c,3d,3h和3i对K562具有一定的抑制活性, 由于在已有的12个抗肿瘤体外活性数据中,很难总结出抗肿瘤的构效关系,但可说明异噁唑-三氟甲基螺环氧化吲哚骨架可以作为抗肿瘤先导化合物进一步研究。

表1 3a~3l的体外抗肿瘤活性
合成了12个未见文献报道的异噁唑-三氟甲基螺环氧化吲哚类化合物3a~3l,产率73%~89%,dr值10/1~>20/1,其结构经1H NMR,13C NMR和HR-MS(ESI-TOF)表征,通过单晶进行了确定化合物3e的相对构型。基于共同的反应机理,其它产物的相对构型依此类推。该类化合物含连续4个立体中心,其中包含一个螺环季碳中心,可以为后续生物活性筛选提供物质基础。采用MTT法研究了3a~3l对人白血病细胞(K562)的体外抗肿瘤活性。结果表明,化合物3c,3d,3h和3i对K562具有一定的抑制活性, 说明异噁唑-三氟甲基螺环氧化吲哚骨架可以作为抗肿瘤先导化合物进一步研究。
