磷酸催化的3-芳基吲哚酮与联烯酰胺的加成反应
2022-01-12李红亮
杨 帆, 曹 阳,2*, 李红亮*
(1. 天津大学 药物科学与技术学院, 天津 300072; 2. 江苏海洋大学 江苏省海洋药物筛选重点实验室, 江苏 连云港 222005)
3′3-二取代吲哚酮骨架作为一类重要的有机合成中间体,是许多天然生物碱或者药物的结构母核[1-4],比如口服活性强效生长激素促泌剂(SM-130686),在以培养的大鼠垂体细胞为研究对象的实验中发现其具有很强的活性, 并在大鼠体内表现出良好的药代动力学特征[5]。具有3-氨基吲哚酮结构的强效胃泌素/CCK-B受体拮抗剂AG-041R,加压素VIb受体拮抗剂SSR-149415作为候选药物而备受关注[6-8],十字花科植物抗毒素(S)-(-)-spirobrassinin具有良好的抗菌活性[9](Chart 1)。联烯酰胺作为联烯的官能化衍生物是一类重要的有机合成中间体,其中联烯酰胺作为底物参与的加成反应成为近十几年研究的热点之一[10,11]。联烯酰胺的加成反应总结起来可以分为以下七类:1)加氢-烷羟基化反应[12];2)加氢烷氧基化反应[13];3)氢胺化反应[14];4)烯烃化反应[15];5)芳烃C—H键活化反应[16];6)氰和硼酰化反应[17];7)硅烷锡烃化反应[18]。
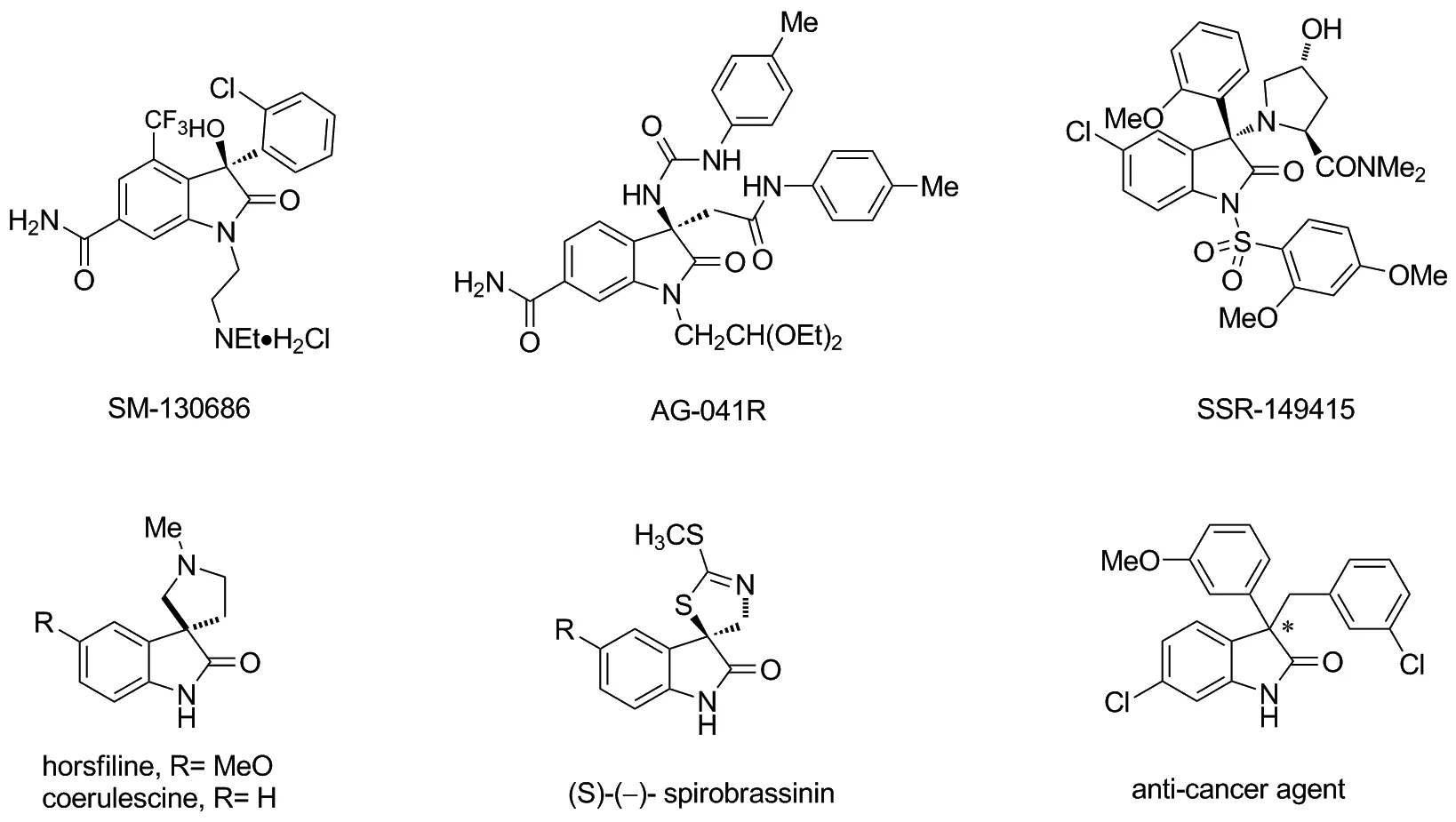
Chart 1
本文使用简单的联萘磷酸作为催化剂,高效的实现了3-芳基吲哚酮与联烯酰胺之间的加成反应, 以较好的收率合成了一系列3′3-二取代吲哚酮类化合物(Scheme 1)。通过对反应条件的优化, 确定了催化剂、反应温度、反应时间、溶剂等参数, 并进一步研究了反应的底物适用范围和机理, 将联烯酰胺的加成反应拓展至3′3-双取代吲哚酮的合成之中。

Scheme 1
1 实验部分
1.1 仪器与试剂
Bruker Avance Ⅲ 400 MHz型核磁共振仪(CDCl3为溶剂, TMS为内标);Q Exactive HF液质联用仪(ESI离子源)。
所用试剂均为化学纯或分析纯。
1.2 合成
(1)3的合成[19-24]
向250 mL圆底烧瓶中依次加入靛红11.47 g(10 mmol)、无水四氢呋喃20 mL降温至-15 ℃并用氩气保护。加入氢化钠60%(溶解于矿物油中)0.6 g(15 mmol),于-15 ℃搅拌0.5 h。缓慢滴加苯基溴化镁(1.0 M溶解于四氢呋喃)20 mL(20 mmol),移至室温环境下反应1 h后, 用氯化铵水溶液淬灭反应。用50 mL乙醚萃取三次, 分液后合并溶液, 所得溶液用饱和食盐水洗涤, 最后用无水硫酸钠干燥,过滤,旋干得橘黄色固体,用少量二氯甲烷洗涤,过滤,滤饼用浓盐酸和冰醋酸(30 mL/2 mL)的混合溶剂溶解,室温下加入二氯化锡2.25 g(10 mmol),回流反应4 h。冷却至室温,用20 mL水稀释,用乙酸乙酯萃取, 合并有机相, 加入饱和碳酸钠溶液,分液,有机相依次用饱和食盐水洗涤,无水硫酸钠干燥,过滤,滤饼旋干得淡黄色固体化合物21.88 g。将所得固体加入至250 mL烧瓶中,加入过量无水碳酸钠3.0 g,二碳酸二叔丁酯4.4 g(20 mmol),无水四氢呋喃100 mL,氩气保护下室温反应24 h。反应液用少量水洗,无水碳酸钠干燥,过滤,旋干,剩余固体用硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=30/1,V/V)纯化得白色固体产物31.98 g,收率64%。
2)N-苯基-N-(丙-1,2-二烯-1-基)乙酰胺(6)的合成[25-27]
向250 mL圆底烧瓶中加入氢化钠60%(溶解于矿物油中)0.6 g(15 mmol),氩气保护下将N-乙酰苯胺41.35 g(10 mmol)的无水四氢呋喃(50 mL)溶液缓慢加入烧瓶中,滴加3-溴丙炔(80%,甲苯)1.28 mL(12 mmol),滴毕,搅拌下反应过夜。用饱和氯化铵溶液淬灭反应,分液,有机相旋干,残余物用硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/1)纯化得淡棕色固体产物51.08 g,收率63%。将5346 mg(2 mmol)与叔丁醇钾22 mg(0.2 mmol)置于50 mL圆底烧瓶中,氩气保护下加入无水四氢呋喃5 mL,反应1 h。反应结束后用饱和氯化铵水溶液淬灭反应,乙酸乙酯萃取,有机相用无水硫酸钠干燥,过滤,滤液旋干,残余物经硅胶柱层析(洗脱剂:石油醚/乙酸乙酯=20/1,V/V)纯化得黄色油状液体,于-20 ℃冷冻过夜得黄色固体6228 mg,收率66%。
(3) 磷酸催化的3-芳基吲哚酮与联烯酰胺加成反应
活化4 Å分子筛后将化合物30.05 mmol,联烯60.1 mmol,磷酸催化剂1.7 mg(0.005 mmol)和50 mg分子筛4 Å加入试管中。氩气保护下加入无水四氯化碳2 mL,于室温反应24 h。反应结束后直接用柱层析(洗脱剂:石油醚/乙酸乙酯=10/1,V/V)纯化得目标产物7a~7l。
2-氧代-3-苯基-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7a): 无色油状液体,收率67%;1H NMR(400 MHz, CDCl3)δ: 7.92(d,J=8.2 Hz, 1H), 7.36~7.23(m, 10H), 7.17(t,J=7.5 Hz, 1H), 7.08(d,J=7.0 Hz, 1H), 6.76(d,J=6.4 Hz, 2H), 3.91(dd,J=14.3 Hz, 7.2 Hz, 1H), 3.20(dd,J=13.2 Hz, 7.0 Hz, 1H), 2.80(dd,J=13.3 Hz, 8.5 Hz, 1H), 1.75(s, 3H), 1.60(s, 9H);13C NMR(100 MHz, CDCl3)δ: 200.3, 176.2, 168.2, 149.2, 139.8, 139.0, 132.1, 130.5, 129.8, 128.5, 128.4, 127.6, 127.1, 125.0, 124.5, 119.8, 114.9, 107.5, 84.2, 57.5, 39.6, 28.0; HR-MS(ESI)m/z: Calcd for C30H30N2O4Na{[M+Na]+}505.2098, found 505.2090。
3-(4-氯苯基)-2-氧代-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7b): 亮黄色油状液体,收率65%;1H NMR(400 MHz, CDCl3)δ: 7.92(d,J=8.1 Hz, 1H), 7.38~7.28(m, 5H), 7.24(d,J=3.5 Hz, 3H), 7.21(dd,J=5.1 Hz, 1.9 Hz, 1H), 7.17(dd,J=7.5 Hz, 1.0 Hz, 1H), 7.05(dd,J=7.5 Hz, 0.9 Hz, 1H), 6.76(d,J=6.2 Hz, 2H), 3.94~3.78(m, 1H), 3.13(dd,J=13.7 Hz, 7.6 Hz, 1H), 2.76(dd,J=13.2 Hz, 8.3 Hz, 1H), 1.75(s, 3H), 1.59(s, 9H);13C NMR(100 MHz, CDCl3)δ: 175.8, 168.3, 149.1, 139.8, 139.5, 137.5, 133.7, 132.3, 129.9, 129.8, 128.7, 128.6, 128.5, 128.4, 124.9, 124.7, 115.1, 106.9, 84.4, 57.0, 39.8, 28.0, 23.1; HR-MS(ESI)m/z: Calcd for C30H29N2O4ClNa{[M+Na]+}539.1708, found 539.1710。
5-氟-2-氧代-3-苯基-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7c): 无色油状液体,收率70%, m.p.118~120 ℃;1H NMR(400 MHz, CDCl3)δ: 7.92(dd,J=9.0 Hz, 4.6 Hz, 1H), 7.37~7.22(m, 9H), 7.02(td,J=8.9 Hz, 2.7 Hz, 1H), 6.88~6.79(m, 2H), 6.79~6.75(m, 1H), 3.98~3.74(m, 1H), 3.17(dd,J=13.7 Hz, 7.8 Hz, 1H), 2.81(dd,J=13.4 Hz, 8.0 Hz, 1H), 1.76(s, 3H), 1.59(s, 9H);13C NMR(100 MHz, CDCl3)δ: 175.7, 168.3, 159.8(d,J=244.1 Hz), 149.2, 139.6, 138.4, 135.8(d,J=2.2 Hz), 132.5, 132.4, 132.3, 129.9, 128.7, 128.4, 127.9, 127.0, 116.3(d,J=7.8 Hz, 1H), 114.9(d,J=22.7 Hz), 112.3(d,J=24.3 Hz), 106.9, 84.4, 57.7, 39.4, 28.0, 23.1; HR-MS(ESI)m/z: Calcd for C30H29N2O4FNa{[M+Na]+}523.2004, found 523.1990。
3-((1,1′-联苯)-4-基)-2-氧代-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7d): 白色固体,收率63%, m.p.156~158 ℃;1H NMR(400 MHz, CDCl3)δ: 7.95(d,J=8.1 Hz, 1H), 7.54(d,J=1.2 Hz, 1H), 7.50(d,J=8.7 Hz, 3H), 7.41(t,J=7.5 Hz, 2H), 7.34(dd,J=16.6, 8.0 Hz, 7H), 7.27(d,J=9.7 Hz, 1H), 7.20(t,J=7.2 Hz, 1H), 7.12(d,J=7.4 Hz, 1H), 6.77(d,J=6.0 Hz, 2H), 4.00~3.81(m, 1H), 3.24(dd,J=13.2 Hz, 7.0 Hz, 1H), 2.84(dd,J=13.2 Hz, 8.4 Hz, 1H), 1.75(s, 3H), 1.60(s, 9H);13C NMR(100 MHz, CDCl3)δ: 176.2, 168.3, 149.2, 140.5, 140.4, 139.9, 139.6, 138.1, 132.1, 130.4, 129.8, 128.7, 128.4, 128.3, 127.6, 127.4, 127.3, 127.0, 125.0, 124.6, 1145.0, 107.4, 84.2, 57.3, 39.7, 28.0, 23.1; HR-MS(ESI)m/z: Calcd for C36H34N2O4Na{[M+Na]+}581.2411, found 581.2382。
3-(5-甲基噻吩-3-基)-2-氧代-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7e): 棕黄色油状液体,收率68%;1H NMR(400 MHz, CDCl3)δ: 7.90(d,J=8.2 Hz, 1H), 7.36~7.26(m, 5H), 7.20~7.15(m, 2H), 6.87~6.64(m, 4H), 4.03~3.78(m, 1H), 3.06(dd,J=13.3 Hz, 7.1 Hz, 1H), 2.73(dd,J=13.3 Hz, 8.4 Hz, 1H), 2.40(s, 3H), 1.75(s, 3H), 1.60(s, 9H);13C NMR(100 MHz, CDCl3)δ: 175.6, 168.2, 149.2, 140.5, 139.7, 139.5, 139.3, 130.3, 132.1, 129.8, 128.4, 128.3, 128.2, 124.7, 124.6, 124.5, 120.2, 114.9, 107.4, 84.1, 55.4, 40.1, 28.0, 23.1, 15.4;. HR-MS(ESI)m/z: Calcd for C29H30N2O4SNa{[M+Na]+}525.1818, found 525.1817。
5-甲基-2-氧代-3(3-(N-苯基乙酰胺)烯丙基)-3-(对甲苯基)吲哚-1-羧酸叔丁酯(7f): 淡黄色油状液体, 收率63%;1H NMR(400 MHz, Acetone-d6)δ: 7.80(d,J=8.2 Hz, 1H), 7.38(d,J=7.7 Hz, 4H), 7.23~7.05(m, 5H), 6.98(s, 1H), 6.92(d,J=6.7 Hz, 2H), 3.91~3.72(m, 1H), 3.08(dd,J=13.0 Hz, 8.0 Hz, 1H), 2.90(dd,J=13.0 Hz, 7.5 Hz, 1H), 2.27(s, 6H), 1.70(s, 3H), 1.58(s, 9H);13C NMR(100 MHz, Acetone-d6)δ: 175.8, 167.1, 149.3, 139.9, 137.6, 137.2, 137.0, 133.8, 132.1, 131.1, 129.8, 129.1, 128.7, 128.5, 128.2, 127.0, 125.3, 114.4, 106.1, 83.3, 57.5, 38.5, 27.4, 22.1, 20.2, 20.0; HRMS(ESI)m/z: Calcd for C32H34N2NaO4{[M+Na]+}533.2411, found 533.2386。
3-(4-甲氧基苯基)-2-氧基-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7g): 淡黄色油状液体,收率66%;1H NMR(400 MHz, CDCl3)δ: 7.91(d,J=8.1 Hz, 1H), 7.31(m, 5H), 7.18(m, 3H), 7.07(d,J=8.3 Hz, 1H), 6.81(d,J=8.9 Hz, 2H), 6.76(d,J=6.3 Hz, 2H), 4.02~3.83(m, 1H), 3.76(s, 3H), 3.16(dd,J=13.2 Hz, 7.0 Hz, 1H), 2.75(dd,J=13.3, 8.4 Hz, 1H), 1.74(s, 3H), 1.59(s, 9H);13C NMR(100 MHz, CDCl3)δ: 176.5, 168.3, 159.0, 149.3, 139.8, 132.0, 131.1, 130.6, 129.8, 128.4, 128.3, 128.2, 128.1, 125.0, 124.5, 114.9, 113.9, 107.7, 84.1, 56.9, 55.3, 39.8, 28.1, 23.1; HRMS(ESI)m/z: Calcd for C31H32N2O5Na{[M+Na]+}535.2203, found 535.2181。
5-甲基-2-氧代-3-苯基-3-(3-(N-苯基乙酰胺)烯丙基)吲哚-1-羧酸叔丁酯(7h): 无色油状液体,收率64%;1H NMR(400 MHz, CDCl3)δ: 7.79(d,J=8.3 Hz, 1H), 7.36~7.24(m, 9H), 7.12(d,J=9.4 Hz, 1H), 6.85(s, 1H), 6.79(d,J=6.9 Hz, 2H), 3.99~3.86(m, 1H), 3.16(dd,J=13.6 Hz, 7.5 Hz, 1H), 2.80(dd,J=13.2 Hz, 8.4 Hz, 1H), 2.32(s, 3H), 1.76(s, 3H), 1.59(s, 9H);13C NMR(100 MHz, CDCl3)δ: 176.4, 168.2, 149.3, 139.7, 139.2, 137.4, 134.1, 132.0, 130.5, 129.8, 128.7, 128.5, 128.5, 128.3, 127.6, 127.2, 125.4, 114.7, 107.6, 84.0, 57.5, 39.4, 28.1, 23.1, 21.2; HR-MS(ESI)m/z: Calcd for C31H32N2O4Na{[M+Na]+}519.2254, found 519.2237。
2-氧代-3-苯基-3-(3-(N-(间甲苯基)乙酰胺基)丙基)吲哚-1-羧酸叔丁酯(7i): 无色油状液体,收率62%;1H NMR(400 MHz, CDCl3)δ: 7.93(d,J=8.1 Hz, 1H), 7.36~7.24(m, 7H), 7.18(q,J=7.6 Hz, 2H), 7.08(d,J=7.5 Hz, 2H), 6.57(s, 2H), 4.01~3.76(m, 1H), 3.20(dd,J=13.2 Hz, 7.0 Hz, 1H), 2.81(dd,J=13.3 Hz, 8.3 Hz, 1H), 2.31(s, 3H), 1.74(s, 3H), 1.59(s, 9H);13C NMR(100 MHz, CDCl3)δ: 200.3, 176.2, 168.3, 149.3, 139.9, 139.4, 139.1, 131.9, 130.5, 129.5, 129.1, 128.8, 128.5, 128.2, 127.6, 127.2, 125.3, 125.1, 124.5, 114.9, 107.1, 84.2, 57.5, 39.6, 28.0, 23.0, 21.2; HR-MS(ESI)m/z: Calcd for C31H32N2O4Na{[M+Na]+}519.2254, found 519.2238。
3-(3-(N-(4-(叔丁基)苯基)乙酰胺)烯丙基)-2-氧代-3-苯基吲哚-1-羧酸叔丁酯(7j): 白色固体,收率60%, m.p.134~138 ℃;1H NMR(400 MHz, Acetone-d6)δ: 7.93(d,J=8.2 Hz, 1H), 7.39(d,J=8.5 Hz, 3H), 7.36~7.25(m, 6H), 7.19~7.10(m, 2H), 6.84(d,J=8.3 Hz, 2H), 3.76~3.65(m, 1H), 3.14(dd,J=13.1 Hz, 8.8 Hz, 1H), 2.93(dd,J=14.0 Hz, 6.5 Hz, 1H), 1.70(s, 3H), 1.61(s, 9H), 1.32(s, 9H);13C NMR(100 MHz, Acetone-d6)δ: 176.2, 168.0, 151.9, 150.0, 140.7, 137.9, 132.8, 131.6, 129.2, 129.0, 128.8, 128.2, 127.8, 127.3, 125.6, 125.1, 115.5, 106.6, 84.3, 58.5, 39.5, 35.1, 31.5, 28.1, 22.9; HR-MS(ESI)m/z: Calcd for C34H38N2O4Na{[M+Na]+}561.2724, found 561.2745。
3-(3-(N-(4-溴苯基)乙酰胺)烯丙基)-2-氧代-3-苯基吲哚-1-羧酸叔丁酯(7k): 黄色油状液体,收率67%;1H NMR(400 MHz, CDCl3)δ: 7.92(d,J=8.2 Hz, 1H), 7.45(d,J=8.4 Hz, 2H), 7.36(t,J=7.9 Hz, 1H), 7.31~7.23(m, 6H), 7.19(t,J=7.5 Hz, 1H), 7.09(d,J=6.9 Hz, 1H), 6.63(d,J=8.0 Hz, 2H), 3.90(s, 1H), 3.23(dd,J=13.2 Hz, 7.0 Hz, 1H), 2.78(dd,J=13.2 Hz, 8.4 Hz, 1H), 1.75(s, 3H), 1.61(s, 9H);13C NMR(100 MHz, CDCl3)δ:176.1, 168.1, 149.3, 139.8, 139.0, 138.6, 131.9, 133.1, 130.4, 130.2, 128.6, 128.3, 127.7, 127.1, 125.0, 124.7, 122.3, 114.9, 107.9, 84.4, 57.5, 39.6, 28.1, 23.0; HR-MS(ESI)m/z: Calcd for C30H29N2O4Br{[M+Na]+}583.1203, found 583.1193。
3-(3-(N-(3-氯苯基)乙酰胺)烯丙基)-2-氧代-3-苯基吲哚-1-羧酸叔丁酯(7l): 淡黄色油状液体,收率66%;1H NMR(400 MHz, CDCl3)δ: 7.93(d,J=8.1 Hz, 1H), 7.38~7.32(m, 1H), 7.27(m, 8H), 7.18(t,J=7.5 Hz, 1H), 7.08(d,J=7.5 Hz, 1H), 6.80(s, 1H), 6.67(d,J=6.6 Hz, 1H), 3.96~3.81(m, 1H), 3.21(dd,J=13.3 Hz, 7.2 Hz, 1H), 2.80(dd,J=13.3 Hz, 8.9 Hz, 1H), 1.77(s, 3H), 1.60(s, 9H);13C NMR(100 MHz, CDCl3)δ: 176.2, 149.2, 140.8, 139.8, 139.0, 135.2, 131.7, 130.8, 130.3, 128.8, 128.6, 128.4, 127.7, 127.2, 126.9, 125.0, 124.6, 115.1, 107.9, 84.4, 57.5, 39.6, 28.0, 23.0; HR-MS(ESI)m/z: Calcd for C30H29N2O4Cl{[M+Na]+}539.1708, found 539.1705。
2 结果与讨论
2.1 反应条件的考察
为了确定基本的反应条件,初步按照室温条件下2 mL甲苯作为溶剂反应12 h,按表1进行相关实验,确定了磷酸催化剂的催化效果以及需要在氩气和分子筛的保护下进行反应。在没有分子筛和氩气保护的情况下,反应不能进行,联烯6会被分解成化合物4。

表1 反应条件的初步确定
(1) 反应时间对收率的影响
在化合物315 mg(0.5 mmol),联烯617 mg(1 mmol),磷酸催化剂10%, 2 mL甲苯和50 mg分子筛(4 Å)以及氩气保护的条件下,室温下考察不同时间反应收率的变化,结果见表3。由表3可知随着反应时间的增加,收率有着小幅提升,当反应24 h后,收率提升已经不明显。因此确定最佳反应时间为24 h。

表2 反应时间对7收率的影响
(2) 反应温度对反应的影响
其他反应条件与(1)节相同,在反应24 h情况下考察反应温度对反应收率的影响,结果见表3。由表3可知,当温度降至0 ℃不再反应,在室温情况下达到最优收率,但是当温度继续上升,收率有所下降,并且联烯消失。

表3 反应温度对7收率的影响
(3) 溶剂对收率的影响
其他反应条件与(2)节相同,在室温下考察溶剂对反应收率的影响,结果见表4。由表4可见,大多数溶剂条件下都没有反应,多数取代苯溶剂收率相近,最优溶剂为CCl4,收率为67%。

表4 溶剂对收率的影响
2.2 反应机理推测
根据参考文献[28],提出了可能的机理:首先3-芳基-2-吲哚酮在磷酸催化下互变成烯醇式,紧接着磷酸氧上的孤对电子作为路易斯碱活化烯醇式中的氢质子,同时磷酸的氢质子活化联烯,接下来被活化的两个底物发生加成反应得到目标产物(Chart 2)。

Chart 2
提供了一种简便的方法来合成3,3-二取代吲哚酮类化合物。该反应的原料廉价易得,底物适用范围广,反应条件温和经济高效,符合原子经济学理念。最后提出了该反应可能的机理,磷酸作为双功能团催化剂来同时活化两个底物。
