低碳水化合物饮食干预在促进肥胖型多囊卵巢综合征患者受孕中的作用
2022-01-12孙金金
孙金金 孙 林 陶 晶
辽宁省大连市妇幼保健院产五病房,辽宁大连 116021
多囊卵巢综合征(polycystic ovary syndrome,PCOS)是常见的女性内分泌紊乱性疾病,其在育龄女性中的发病率为5%~10%[1]。PCOS 同时也是一种代谢异常疾病,机体内糖代谢和激素分泌异常,雄激素水平上升,且存在胰岛素抵抗,患者容易出现腹型肥胖。 肥胖会使脂肪细胞对胰岛素的敏感性下调, 加剧胰岛素抵抗,促进雄激素水平进一步升高,形成恶性循环[2]。 调查发现, 约有60%的PCOS 存在肥胖或超重的现象,且PCOS 和肥胖之间存在着密切的联系, 肥胖型PCOS 患者的内分泌代谢紊乱程度较非肥胖型患者要更严重,对脉冲性促性腺激素释放激素的促排卵反应降低,因此受孕的概率更低[3-4]。 针对肥胖型PCOS 患者,适当减重有助于减轻胰岛素抵抗,改善生殖内分泌紊乱,促进卵巢功能恢复[5]。 饮食干预是控制体重的主要方法之一, 近年来低碳水化合物饮食逐渐成为肥胖症患者饮食干预的热点。 研究显示,低碳水化合物饮食对于肥胖症患者有明显的减重作用[6-7]。 本研究选取大连市妇幼保健院收治的86 例肥胖型PCOS 患者作为研究对象,探讨低碳水化合物饮食干预在促进肥胖型PCOS 患者受孕中的临床作用,现报道如下。
1 资料与方法
1.1 一般资料
选取 2018 年12 月至 2019 年 12 月大连市妇幼保健院收治的86 例肥胖型PCOS 患者作为研究对象, 采用随机数字表法将其分成研究组和对照组,每组 43 例。对照组患者,年龄 22~40 岁,平均(35.6±4.4)岁;病程 5~39 个月,平均(15.6±2.4)个月。研究组患者,年龄 23~39 岁,平均(35.3±4.2)岁;病程 5~41 个月,平均(15.8±2.5)个月。两组的一般资料比较,差异无统计学意义(P>0.05),具有可比性。 本研究已经获得医院医学伦理委员会审核批准,患者均知情同意。纳入标准:①经临床诊断确诊为 PCOS;②BMI≥28 kg/m2;③年龄20~40 岁,有生育需求;④自愿参与研究。 排除标准:①有严重的脏器功能衰竭;②合并其他内分泌疾病;③存在卵巢功能性疾病;④确诊为糖尿病;⑤伴侣存在生殖功能异常。
1.2 方法
两组患者均予以药物对症治疗[二甲双胍(贵州圣济堂制药有限公司,批号:20190107)+炔雌醇环丙孕酮片(Schering GmbH & Co. Produktions KG,批号:20190211)]和常规护理干预,包括用药指导、病情宣教及适当运动等。
对照组给予饮食常规指导,以低糖、低盐、低脂饮食为主,多吃蔬菜水果,少吃辛辣食物。
研究组患者予以低碳水化合物饮食干预。在减重期,使用含25 mg 碳水化合物的低糖营养棒代替主食,每次1 根,2 次/d,蔬菜和肉类可适当食用,控制每日摄入总热量应为 900~1300 kcal, 维持 4 周。 过渡期中,可根据患者的饮食喜好制订相应的低碳水营养餐,可以食用主食,但是碳水化合物的摄入占比应控制在25%~30%,每日摄入总热量控制在 900~1300 kcal,维持4 周。进入维持期后,可适当调整营养餐中碳水化合物的占比至35%~45%, 每天摄入总热量控制在1300~1600 kcal,维持4 周。 干预期间督促患者严格按营养餐标准进行饮食,了解患者的体重变化,并及时调整摄入总热量和碳水化合物的占比。
1.3 观察指标
记录两组患者干预前后的体重指数(body mass index,BMI)、体脂率、空腹胰岛素(fasting insulin,FINS)、空腹血糖(fasting blood glucose,FBG)以及睾酮(testis,T)、促卵泡激素(follicle-stimulating hormone,FSH)、促黄体生成素(luteinizing hormone,LH)等激素水平的变化情况,并随访1 年,统计两组干预后1 年内的月经周期恢复正常率和受孕成功率。 其中FINS 采用化学发光法测定;FBG 采用葡萄糖氧化酶法测定;T、FSH、LH 水平使用拜耳公司的ACS180 化学发光仪, 采用全自动化学发光方法进行测定。
1.4 统计学方法
采用SPSS 20.0 统计学软件进行数据分析, 计量资料以均数±标准差()表示,采用 t 检验;计数资料以频数和百分率(%)比较,采用 χ2检验,以 P<0.05为差异有统计学意义。
2 结果
2.1 两组患者干预前后各项代谢指标变化的比较
干预前,两组患者的 BMI、体脂率、FINS、FBG 以及各项激素水平比较,差异无统计学意义(P>0.05)。干预后,两组患者的 BMI、体脂率、FINS、FBG、T 和 LH水平均低于干预前,差异有统计学意义(P<0.05);两组干预后的FSH 水平与本组干预前比较,差异无统计学意义(P>0.05)。 研究组干预后的BMI、体脂率、FINS、FBG、T 和LH 水平低于对照组, 差异有统计学意义(P<0.05); 研究组干预后的 FSH 水平与对照组比较,差异无统计学意义(P>0.05)(表 1)。
表1 两组患者干预前后各项代谢指标变化的比较()
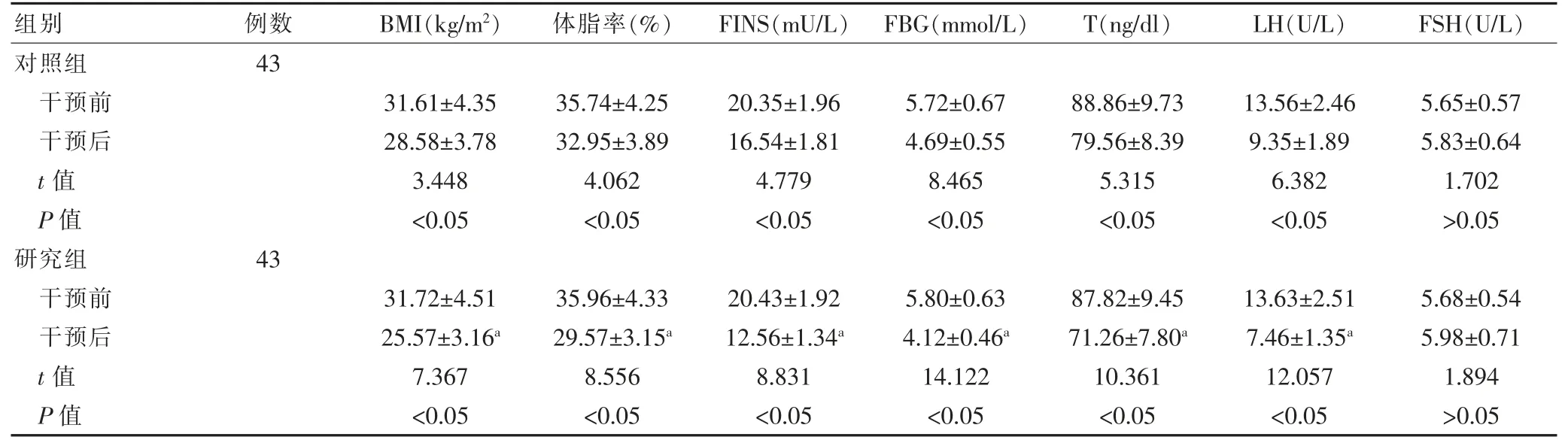
表1 两组患者干预前后各项代谢指标变化的比较()
与对照组同期比较,aP<0.05
组别 例数 BMI(kg/m2) 体脂率(%) FINS(mU/L) FBG(mmol/L) T(ng/dl) LH(U/L) FSH(U/L)对照组干预前干预后t 值P 值研究组干预前干预后t 值P 值43 31.61±4.35 28.58±3.78 3.448<0.05 35.74±4.25 32.95±3.89 4.062<0.05 20.35±1.96 16.54±1.81 4.779<0.05 5.72±0.67 4.69±0.55 8.465<0.05 88.86±9.73 79.56±8.39 5.315<0.05 13.56±2.46 9.35±1.89 6.382<0.05 5.65±0.57 5.83±0.64 1.702>0.05 43 31.72±4.51 25.57±3.16a 7.367<0.05 35.96±4.33 29.57±3.15a 8.556<0.05 20.43±1.92 12.56±1.34a 8.831<0.05 5.80±0.63 4.12±0.46a 14.122<0.05 87.82±9.45 71.26±7.80a 10.361<0.05 13.63±2.51 7.46±1.35a 12.057<0.05 5.68±0.54 5.98±0.71 1.894>0.05
2.2 两组月经周期恢复正常率和受孕成功率的比较
随访结果显示,研究组的月经周期恢复正常率和受孕成功率高于对照组,差异有统计学意义(P<0.05)(表 2)。
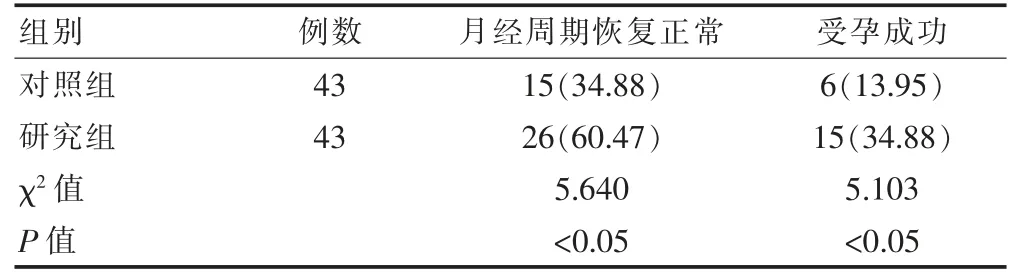
表2 两组的月经周期恢复正常率和受孕成功率比较[n(%)]
3 讨论
近年来,PCOS 的发病率在不断上升[8],而PCOS和肥胖之间有着密切的关联。 PCOS 患者多数伴有肥胖症状,肥胖人群中PCOS 的发病率也显著高于非肥胖人群[9]。 PCOS 患者的胰岛素抵抗会造成中枢神经-内分泌系统调节失调,而肥胖又会促进抵抗素等多种与胰岛素抵抗相关的内分泌激素和因子的释放,进而加重胰岛素抵抗,两者之间互相促进,形成恶性循环,进一步加剧PCOS 患者的糖代谢紊乱和生殖内分泌紊乱,影响患者受孕[10-11]。 有研究显示,积极的减重治疗对于改善胰岛素抵抗有较好的效果,体重指数与胰岛素抵抗指数之间存在一定的正相关性,体重指数降低,胰岛素的敏感性会随之上升[12-13]。 因此,饮食干预成为肥胖型PCOS 除药物治疗外的重要干预措施。 碳水化合物是日常饮食中热量的主要来源,摄入碳水化合物过剩,血糖过高,胰岛素过度分泌,脂肪合成增多,是造成肥胖的直接原因之一。 常规饮食指导的减重效果不佳,而低碳水化合物饮食中通过控制每日摄入的总热量,降低碳水化合物的比例,能减少脂肪的合成,起到更好的减重效果[11-12]。 本研究中,干预后研究组的BMI、体脂率水平均低于对照组,再次验证了低碳水饮食能帮助肥胖型PCOS 患者更好地降低BMI 和体脂含量[14];干预后,研究组的 FINS、FBG、T和LH 水平均低于对照组,差异有统计学意义(P<0.05); 且研究组患者的月经周期恢复正常率和受孕成功率高于对照组,差异有统计学意义(P<0.05),与王金梅等[15]的研究结果一致。 肥胖型PCOS 患者的护理中应用低碳水化合物饮食干预进行减重后能切断肥胖和胰岛素抵抗的恶性循环, 增加胰岛素敏感性,促进糖代谢改善, 对于降低PCOS 患者的高雄激素血症、改善生殖内分泌紊乱也有一定的效果,进而起到促进排卵和受孕的作用。 本研究样本量有限,因此结果可能有所偏倚; 低碳水化合物饮食干预对改善PCOS 患者生殖内分泌紊乱的确切作用和具体机制还需进一步探讨,且在临床应用时如何平衡三大营养素的比例,以避免过低的碳水化合物对于受孕后胎儿发育造成不良影响也是临床以后需要解决的问题。
综上所述,在肥胖型PCOS 患者的护理中应用低碳水化合物饮食干预,能有效降低体重和体脂,促进糖代谢和生殖内分泌的改善,起到一定的促进受孕的效果。
