糖相关分子在疾病中作用的研究进展
2022-01-10沈旦枫芦鑫荣邹琳王蕾孔维溧袁舒颖陈妍雯孙桂芹陈力
沈旦枫,芦鑫荣,邹琳,王蕾,孔维溧,袁舒颖,陈妍雯,孙桂芹,陈力*
(1. 复旦大学基础医学院病原生物学系医学分子病毒学教育部/卫生部重点实验室,上海 200032;2. 永道致远科学技术有限公司,上海 200120;3. 先思达生物科技有限公司,江苏 南京 211800;4. 浙江中医药大学医学技术与信息工程学院,浙江 杭州 310053)
1 引言
近年来,多种技术被用来分析糖蛋白和N-聚糖。早期研究主要依赖于凝集素结合方法[1],它可以鉴定出现在蛋白[2]、细胞[3]和组织[4]上的特定表位。高效液相色谱(high-performance liquid chromatography,HPLC)[5-6]和 质 谱(mass spectrometry,MS)[7-8]等技术拓展了糖组学研究领域。目前,反相色谱(reverse phase chromatography,PRC)[9-10]、亲水相互作用色谱(hydrophilic interaction chromatography,HILIC)[11-12]、多孔石墨碳(porous graphitic carbon,PGC)[13]和毛细管电泳(capillary electrophoresis,CE)[14]等多项技术被报道用于聚糖特征的分析。
糖相关分子与疾病间的关联,是一个开放的研究领域。本文对肿瘤、感染性疾病和遗传病共23个糖相关分子[包括聚糖、糖蛋白、凝集素和糖蛋白甘露糖糖苷酶(glycoprotein mannosidase,gpM)等(见表1)]的研究进展进行了回顾和展望。
2 癌症中的糖相关分子
癌症是仅次于心血管疾病的第二大致死病因。近年来,虽然医学技术和医疗手段突飞猛进,但癌症的早筛早诊仍存在困难,又因癌症预后不良,导致癌症患者的存活率很低。常规诊断方法(包括超声[15]、磁共振成像[16]和活检[17]等)取决于肿瘤的表型特性,对于癌症早期检测效率不高。癌症是一种多阶段性疾病(multistage disease),其发生和发展与一系列遗传学(genetic)或表观遗传学的(epigenetic)变化有关。这些变化会干扰细胞信号通路,引发致瘤性转化(tumorigenic transformation),导致恶性肿瘤的发生。癌症发生的过程中,人体会分泌高水平的生物标志物分子[18]进入尿液、血液、肿瘤组织或其他组织。因此,对癌症标志物分子有效的早期检测为癌症病人的筛查和诊断提供了可靠方法。该过程不仅可以帮助对癌症病理性进展进行评估,还可以预测不同癌症的预后,以及药物治疗的应答情况。目前,一系列癌症标志物已经被批准用于临床诊断和预后,但是仍存在着假阳性或假阴性的问题,在特异性及敏感性方面也有待提高。这可能与病人间的分子不均一性以及患癌器官处于多个癌症阶段相关[19],因此,寻找新的敏感性高、特异性强的单一标志物分子具有重大意义[20]。
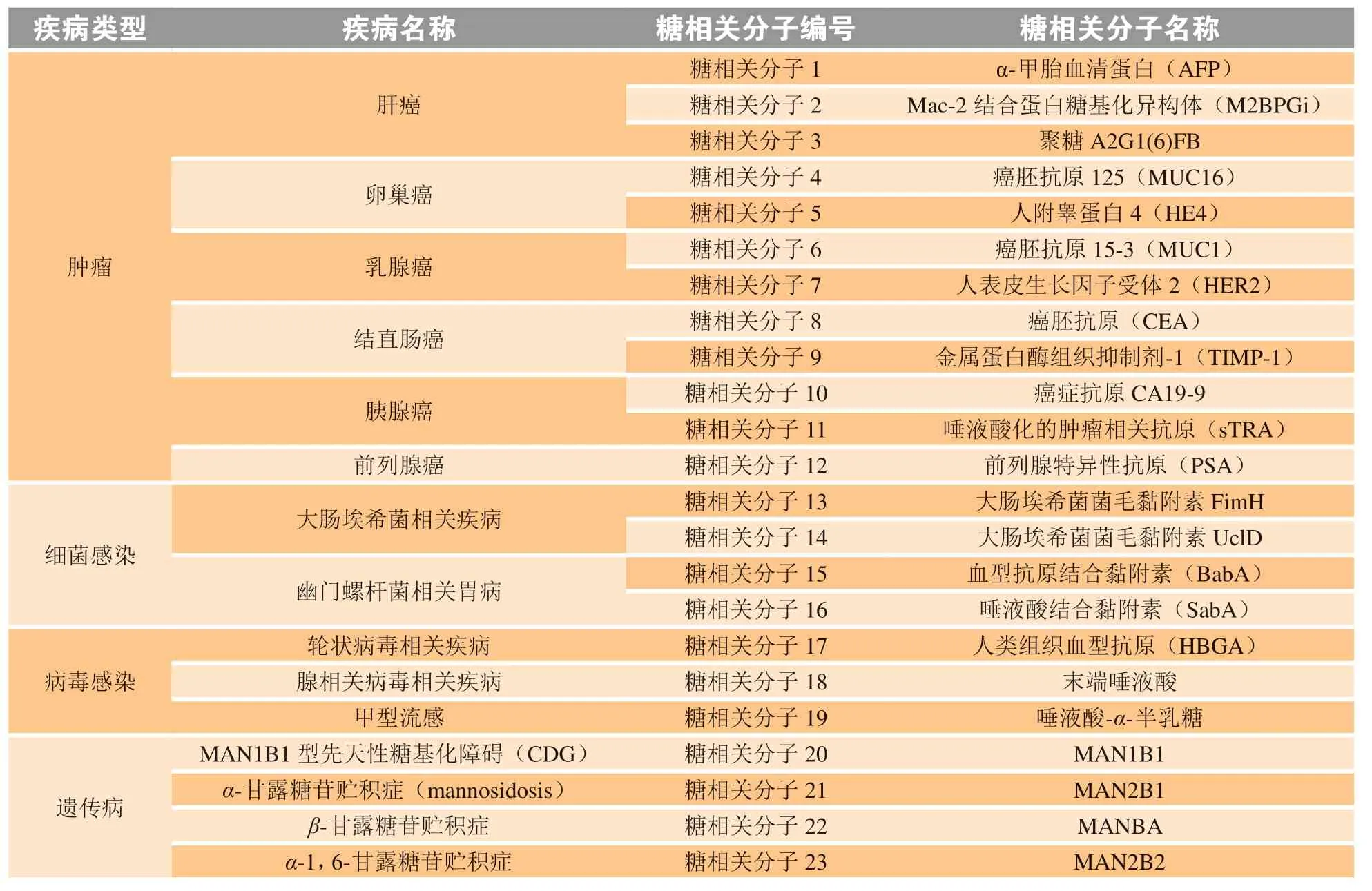
表 1 与肿瘤、感染性疾病和遗传病相关的23种糖相关分子Table 1 23 Saccharide-related molecules in tumors, infections and genetic diseases
目前针对癌症的人体聚糖变化和糖蛋白生物标志物的探索相对较少[21],但聚糖组成和结构的变化是癌症发生的常见特征,且参与癌细胞的转移和黏附,因此糖组学的未来发展可以为肿瘤的诊断和治疗提供重要信息[22-23]。由于糖基化将蛋白质结构复杂性提高了几个数量级,糖组学研究关注的将是高度动态的生物标志物分子(highly dynamic biomarker),对癌症的诊断、预后和治疗具有评估参考价值。
2.1 肝癌相关血清糖蛋白和聚糖标志物分子
2.1.1 糖相关分子1——α-甲胎血清蛋白 AFP是相对分子质量为70 000的糖蛋白,主要由卵黄囊和胎儿肝脏产生。胎儿血清AFP在孕早期(first trimester)的末期,浓度最高可达到3h 106~ 5h 106μg · L-1[24],足月(term)后降至1h 105~ 2h 106μg · L-1,并在出生后快速降低到成人参考值(0.5 ~ 15 μg · L-1)。母亲血清中的AFP在孕期也会上升,并在妊娠30 ~ 32周达到顶峰(200 ~ 300 μg · L-1)。在某些病理状态下,血清AFP表达水平升高,可以作为某些潜在疾病的指示物,如肝细胞癌(hepatocellular carcinoma,HCC)[25]、胰腺癌、胃肠道癌、睾丸生殖细胞癌及脑癌等[26]。尽管对特定癌症类型的特异性较低,AFP仍然是目前最好的HCC血清标志物。有研究报道,当把血清中AFP浓度的临界值设定为20 μg · L-1,其在HCC中的检测敏感性为41% ~ 65%,特异性为80% ~ 94%。AFP浓度升高提示与HCC肿瘤增大相关,但在癌症早期,其检测敏感性较低。在另一项研究中,当把AFP临界值设定为10.9 μg · L-1,其在HCC早期阶段检测敏感性为66%[27]。
AFP只有一个N-糖基化位点,以双天线型糖链修饰,在癌症发展过程产生末端唾液酸化和核心岩藻糖基化修饰等变化[28]。岩藻糖基化水平升高提示与HCC发展有关[29],可以被小扁豆凝集素(Lens culinaris lectin,LCA)检测。由于在HCC早期,低水平的AFP作为标志物特异性较差,因此AFP中能与LCA反应的部分(即AFP-L3)与AFP的比例,成为新一代HCC检测指标[30-31]。AFP-L3/AFP比例临界值为10%时,对于AFP血清浓度超过10 μg · L-1的病人,该检测指标在HCC发展全阶段的检测敏感性达到60%,特异性达到90%。美国FDA在2006年批准AFP-L3作为患肝癌风险的检测指标[32]。随着检测AFP-L3方法学的进步,目前科研人员已经能够在AFP浓度为2 μg · L-1条件下对样本进行诊断。
2.1.2 糖相关分子2——Mac-2结合蛋白糖基化异构体 M2BPGi是由肝脏星状细胞(hepatic stellate cell,HSC)表达的糖蛋白,在HSC和Kupffer细胞之间作为信使分子,促进纤维化。M2BPGi带有多分支型N-聚糖结构,被唾液酸修饰。紫藤植物凝集素(wisteria floribunda agglutinin,WFA)能够识别M2BPGi,推断其N-聚糖或O-聚糖带有乳糖胺单元。
自2013年起,M2BPGi作为一种新型的、非侵入性的、快速检测的血清学糖标志物,用于评估慢性乙型肝炎(chronic hepatitis B,CHB)和慢性丙型肝炎(chronic hepatitis C,CHC)病人的肝纤维化程度[33-34]。目前,多项研究对血清M2BPGi预测CHB病人患HCC风险的可靠性进行了评估。患有HCC的病人其血清M2BPGi含量明显高于未患有HCC的人群。当设定血清M2BPGi临界值为0.68 COI(cut-off index)时,对HCC病人诊断敏感性大于90%,特异性大于80%[35]。Jun等[36]研究发现,在预测HCC的发生时M2BPGi是比AFP更有效的检测指标。
2.1.3 糖 相 关 分 子3——聚 糖A2G1(6)FB 聚糖A2G1(6)FB,是一种带有核心岩藻糖和二等分N-乙酰氨基葡萄糖的双天线N-聚糖结构[37]。二分支GlcNAc结构可以被植物血球凝集素(phytohaemagglutinin E4,PHA-E4)所识别结合。另外,Higashi等[37]对4例病人血清的研究结果提示,A2G1(6)FB存在于免疫球蛋白(Ig)重链上。由于A2G1(6)FB带有一个核心岩藻糖修饰,因此该结构可以被LCA识别。相对于非HCC患者,在HCV感染发展成HCC的患者中,血清A2G1(6)FB含量显著提高。在早期HCC患者中,可以检测到A2G1(6)FB结构的存在。HCC患者血清中的A2G1(6)FB含量与AFP无相关性,因此同时使用A2G1(6)FB和AFP等传统标志物,可以提高HCC诊断的准确性。
2.2 卵巢癌相关糖蛋白标志物分子
2.2.1 糖相关分子4——MUC16 MUC16又被称作癌症抗原125(CA125),能够被抗OVCA433卵巢癌细胞系单克隆抗体识别[38]。MUC16是目前已知最大的跨膜黏蛋白,相对分子质量可达2 000 000[39]。MUC16由支气管、子宫内膜、卵巢和角膜等组织上皮细胞表达。MUC16可以保护细胞,其跨膜结构的胞外域部分脱落后进入血液。MUC16被用作诊断卵巢癌并监测癌症进程的标志物分子。然而有研究报道,在一些非妇科癌症病人以及患有子宫内膜异位症等良性疾病的病人,甚至处于经期和孕期的女性血清中也发现MUC16浓度升高。尽管存在着非特异性和不准确性,目前仍然将MUC16浓度检测与超声联合,作为诊断恶性卵巢肿瘤的标准手段[40]。也有研究报道尝试利用MUC16糖型区分鉴别子宫内膜异位症与卵巢癌,评价卵巢癌的临床分期、细胞学分级和组织学类型[41-43]。卵巢癌病人MUC16上唾液酸化的Tn抗原(STn)富集,而子宫内膜异位症病人MUC16上STn含量远低于卵巢癌病人[41]。凝集素微矩阵试验检测MUC16和MUC1聚糖结构STn和Tn可以鉴别良性卵巢肿瘤与侵袭性上皮性卵巢/小管癌,特异性达到61.1 %,敏感性达到90%[42],具有鉴别诊断卵巢癌的应用前景。
2.2.2 糖相关分子5——人附睾蛋白4 HE4是相对分子质量为23 000 ~ 27 000的糖蛋白,N末端带有一段疏水性信号肽,第15号氨基酸为N-糖基化位点。在上皮性卵巢癌中,作为分泌型糖蛋白,HE4常常上调表达[44-46]。在良性妇科疾病以及低恶化潜能肿瘤条件下,HE4表达水平低于MUC16。在某些子宫内膜癌和卵巢癌中未检测到MUC16的表达,但是却能检测到HE4的表达。2008年,FDA批准了HE4酶联免疫试验(enzyme immunoassay,EIA)检测试剂盒作为卵巢癌检测的方法学手段,底物检测浓度在15 ~ 900 pmol · L-1之间[47]。多项研究结果表明,以HE4作为卵巢癌检测标志物,其特异性显著高于标志物MUC16(93%vs78%)。此外,在早期卵巢癌鉴定中,HE4要优于MUC16[48]。2011年,FDA批准将HE4和MUC16联合使用的方法,即卵巢恶性肿瘤风险算法(risk of ovarian malignancy algorithm,ROMA),用于鉴定在出现卵巢附件肿块女性患者中发现恶性肿瘤的可能性,ROMA测试检测早期和晚期卵巢癌的能力均优于单个生物标志物[49-51]。尽管已经明确HE4是糖基化修饰的蛋白,但糖组学对于HE4功能的调控目前仍不清楚,HE4糖型结构对于卵巢癌诊断和预后的意义需要更深入的探索[52-53]。
2.3 乳腺癌相关糖蛋白标志物分子
2.3.1 糖相关分子6——MUC1 MUC1又被称为癌症抗原15-3(CA15-3),是一种由多数腺上皮细胞表达的跨膜黏蛋白,带有高度O-糖基化修饰。许多类型癌细胞的表面均发现有MUC1表达[54],例如乳腺癌、卵巢癌、肺癌、胰腺癌和前列腺癌。脱落入血的MUC1可以被多种抗黏蛋白抗原的单克隆抗体检测到,这些单克隆抗体可以识别MUC1分子的不同部位[55-57]。尽管将MUC1单独作为标志物进行癌症筛查缺乏特异性,但目前在乳腺癌的诊断中将MUC1和其他血清标志物共同作为检测指标。
乳腺癌病人血清MUC1糖基化的变化提示癌症早期诊断的可能。与健康组织中的MUC1相比,乳腺恶性肿瘤中MUC1的糖基化程度更高,带有异常O-连接寡糖的MUC1肽片段从上皮细胞表面脱落并分泌到血清中。利用HPLC对进入血清的O-聚糖结构进行分析发现[58],Core1型O-聚糖结构占83%,Core2型O-聚糖结构占17%,且大部分O-聚糖都带有较高程度的唾液酸修饰。另外,在肿瘤细胞中发现MUC1截短化的聚糖结构带有短的唾液酸侧链修饰,包括Thomsen-Friedenreich抗原(T抗原)、Tn抗原,以及它们各自的被唾液酸修饰的衍生物——sTn和α-2,6-唾液酸化的T抗原。由于MUC1抗原在肿瘤组织大量表达且糖基化异常,因此肿瘤相关的糖肽和表位被认为是肿瘤免疫治疗和免疫诊断的具有吸引力的靶点,目前正在进行深入研究[59-61]。
2.3.2 糖相关分子7——人表皮生长因子受体2 HER2又称CD340,由基因ERBB2编码。它是相对分子质量为185 000的糖蛋白,包括3个结构域:相对分子质量为105 000的胞外结构域(extracellular domain,ECD)、跨膜亲脂性片段,以及具有酪氨酸激酶活性的胞内结构域。ECD可以从HER2受体上经切割脱落进入血液[62]。HER2在20% ~ 30%的乳腺癌病人中高表达,引起侵袭性肿瘤类型的产生,导致生存率降低,可以作为单抗治疗或其他疗法的靶点。HER2 ECD与MUC1联合检测在乳腺癌早期阶段鉴别高风险乳腺癌病人具有参考价值。这2个在较差无病生存期的独立的指示物,可以用来鉴定哪些病人需要更积极疗法和加强监测。血清和肿瘤组织的HER2浓度具有相关性,另外血清HER2浓度也反映病人对化疗的应答。HER2 ECD含有多个潜在糖基化位点,但其聚糖结构不明确,有待深入探索。
2.4 结直肠癌相关糖蛋白标志物分子
2.4.1 糖相关分子8——癌胚抗原 CEA相对分子质量为180 000,属于免疫球蛋白超家族,是糖基磷脂酰肌醇(glycosylphosphatidylinositol,GPI)锚定蛋白,固定在细胞表面。正常情况下,CEA在胎儿发育期间,由胃肠道组织的黏膜细胞产生,在孕中期第19周浓度达到最高(80 ~ 100 μg · L-1),足月新生儿体内降低(至50 μg · L-1)。妊娠期间,CEA在母体血清中不会升高,因为它不会穿过胎盘,并且在健康的成年男女血清中仅以非常低的浓度存在(小于2.5 μg · L-1)。在重度吸烟人群中或在某些病理条件下,如结直肠癌、胃癌等,血清CEA浓度可以达到5 μg · L-1。因为CEA的浓度升高要比其他临床指标早数月,所以CEA常被用作结直肠癌分期、监测手术切除后结肠癌复发或扩散的标志物。
与野生型细胞株相比,在CD44双敲低的结肠癌细胞系LS174T细胞中表达的CEA带有高度的唾液酸和岩藻糖修饰,而且与选凝素(selectin)的亲合力增加,提示这些糖型变化与癌细胞转移扩散相关。在CEA分子中,N-连接的寡糖相对分子质量占其50%以上,这也进一步提示糖基化修饰以及糖型变化对癌症诊断具有一定的重要意义。
2.4.2 糖相关分子9——金属蛋白酶组织抑制剂-1 TIMP-1是相对分子质量为28 000左右的分泌型糖蛋白,其主要包括2个结构域:N末端结构域具有基质金属蛋白酶(matrix metalloproteinase,MMP)抑制活性,C末端结构域和CD63相互作用,诱导β1整合素的构象活化,激活MAPK信号通路。TIMP-1主要功能是作为MMP抑制剂,调控MMP的蛋白水解活性,促进肿瘤生长,抑制肿瘤细胞凋亡。除此之外,研究发现TIMP-1以非MMP依赖性的方式,调控肿瘤细胞凋亡和增殖[63]。TIMP-1异常的β-1,6-N-乙酰氨基葡萄糖和多聚乳糖胺表达以及唾液酸修饰增多被报道与癌细胞侵袭和迁移有关[64]。
TIMP-1被认为可以作为结直肠癌(CRC)的早期检测指示物。Holten-Andersen等[65]研究发现,血清中当设置特异性为98%时,使用TIMP-1鉴定结肠癌的敏感性为63%,鉴定直肠癌的敏感性为36%;当设置特异性为95%时,使用TIMP-1鉴定结肠癌的敏感性为65%,鉴定直肠癌的敏感性为42%。
2.5 胰腺癌相关聚糖标志物分子
2.5.1 糖相关分子10——癌症抗原CA19-9 1979年,CA19-9首次被描述为被单克隆抗体NS-19-9识别的肿瘤抗原[66],在血清中主要以唾液黏蛋白形式存在,是一种唾液酸化的Lea(sLea)血型物质,在由内胚层细胞分化而来的多种上皮类恶性肿瘤中可见增高,以胰腺癌增高最为显著,是胰腺癌最重要且应用最广泛的生物标志物之一。因此,CA19-9主要同其他标志物(如CEA)联合使用进行胰腺癌的检测和管理[67]。在用其他方法获得其他证据之前,CA19-9表达量增加是患胰腺癌最主要的标志。CA19-9检测最大的不利之处在于,sLea结构并不是胰腺癌组织特异性表达的,另外在一些健康人体血清中也能检测到低浓度CA19-9。目前,CA19-9除了作为胰腺癌的检测标志物外,还作为HCC和胆管癌的预后标志物。HCC患者中CA19-9血清浓度超过100 U ·mL-1,提示总生存期较差;而在胆管癌患者中,血清CA19-9浓度超过150 U · mL-1,说明总体生存期较差。
2.5.2 糖相关分子11——唾液酸化的肿瘤相关抗原Brian B. Haab实验室报道了一种新型胰腺癌检测标志物——sTRA[68-69]。在一项涉及38例病人的试验中,研究人员发现sTRA在胰腺临近肿瘤组织中表达量升高。对CA19-9和sTRA双重染色细胞数多的患者,手术后的肿瘤进展时间更长。肿瘤进展时间短(少于2年)的患者或双染色细胞数少,或单染色细胞含量高。这种区分短肿瘤进展时间和长肿瘤进展时间的模式,敏感性为90%,特异性达到80%[70]。另外,相对于sTRA未升高患者,sTRA升高的癌症病人更有可能对化疗产生耐药。因此对胰腺癌病人而言,sTRA的检测可以帮助指导用药。
2.6 前列腺癌相关糖蛋白标志物分子
PSA又被称作激肽释放酶3(kallikrein-3,KLK3),已被广泛用于筛选男性前列腺癌。PSA是激肽释放酶家族成员,由前列腺上皮细胞和尿道旁腺分泌。它是相对分子质量为28 400 的糖蛋白,带有一个糖基化位点,根据是否被糖基化修饰可分为糖基化亚型多肽和非糖基化亚型多肽(gp28/p26、gp22/p20、gp18/p16和gp12/p10)[71]。
在一些前列腺疾病[如前列腺炎、前列腺增生(benign prostatic hyperplasia,BPH)、前列腺癌等]中,前列腺上皮破损会导致PSA扩散进入上皮周围组织,引起循环系统中PSA浓度上升。健康男性血清PSA维持较低浓度(40岁之前低于2.5 μg · L-1,70岁以后为6.5 μg · L-1左右),浓度高于4 μg · L-1提示前列腺癌或前列腺增生。血清PSA筛查结合直肠指检(digital rectal exam,DRE)和前列腺活检标本的Gleason分级已被FDA批准用于前列腺癌的早期检测[72]。对于前列腺癌与前列腺增生的常规鉴别诊断主要是区分两者PSA糖型的微不均一性[73-74]。
有研究报道,前列腺癌病人血清中PSA岩藻糖基化和唾液酸化修饰发生变化[75-76]。另一项研究发现,与血清中PSA相比,岩藻糖基化PSA能更好区分侵袭性前列腺癌和非侵袭性前列腺癌[77]。与健康人相比,前列腺癌病人血清PSA上的N-聚糖末端的半乳糖残基被唾液酸残基以α-2,3-糖苷键连接修饰[78-79],增强了与识别α-2,3-唾液酸的凝集素Maackia amurensis agglutinin(MMA)的结合作用[80]。Yoneyama等[81]开发了一种利用磁性微珠免疫试验检测末端α-2,3-唾液酸化的PSA的方法,对于前列腺癌的诊断敏感性达到90.2%,特异性达到64.2%。
3 糖相关分子介导多种病原体感染
许多细菌病原体和宿主间存在着聚糖介导的相互作用,这些聚糖结构与细菌黏附、侵袭和免疫逃逸相关,还可以作为毒素受体分子。一些细菌病原体通过糖苷酶修饰更改宿主聚糖结构,暴露结合靶点、降解宿主聚糖或改变宿主糖蛋白功能。凝集素、聚糖和黏蛋白矩阵等鉴定结果表明,细菌与宿主间由聚糖介导的相互作用,对病原体定植、持续性感染和致病等至关重要。病毒附着在细胞表面受体上是感染的第一步。许多哺乳动物病毒能够识别细胞表面糖蛋白或糖脂上的聚糖结构。尽管聚糖是哺乳动物细胞普遍存在的成分,但其末端结构在不同细胞以及不同组织间存在着差异,这种差异造成了病毒感染不同组织和不同物种的趋向性。
3.1 多种凝集素分子介导细菌感染
3.1.1 糖相关分子13——FimH和糖相关分子14——UclD 大肠埃希菌(Escherichia coli,E. coli)是一种重要的人类病原体,可引起多种疾病,包括肠炎、尿路感染(urinary tract infection,UTI)和脑膜炎等。例如尿路致病性大肠埃希菌(uropathogenicE.coli,UPEC)是UTI的主要病原[82]。大肠埃希菌通过几种不同类型的菌毛(pili)黏附到宿主表面这些菌毛的结合特异性决定了宿主和组织的趋向性。1型菌毛的末端带有凝集素FimH,介导与宿主细胞表面甘露糖的结合[83]。定殖于大肠的大肠埃希菌上的FimH偏向于结合单甘露糖基化的聚糖结构,而尿路感染相关的大肠埃希菌偏向于结合甘露糖聚糖结构。UPEC对甘露糖聚糖结构的偏好性已被用于开发甘露糖衍生药物进行FimH的拮抗治疗。
另一种大肠埃希菌菌毛黏附素UclD,具有凝集素功能。UclD凝集素结构域与结肠上皮细胞结合,用O-糖苷酶预处理以除去上皮细胞上O-连接的聚糖后,这种结合作用受到抑制,表明UclD与宿主细胞上的1个或多个O-连接的聚糖相互作用。
3.1.2 糖相关分子15——BabA和糖相关分子16——SabA 幽门螺杆菌(Helicobacter pylori,H. pylori)为革兰阴性菌,定殖于人体胃黏膜。有1% ~ 3%阳性感染者最终发展为胃癌。人体胃黏膜和上皮层细胞被高度糖基化,幽门螺杆菌通过2种凝集素结合糖基化结构,即BabA[84]和SabA[85]。
BabA特异性识别岩藻糖基化修饰的聚糖结构(如Lewis B),这种类型的聚糖结构可表达在胃上皮细胞表面。BabA介导的黏附具有pH依赖性,在较高pH环境中具有较强的黏附能力。SabA对唾液酸修饰的Lewis X(sLex)和唾液酸化的Lewis A(sLea)结构具有特异性。在健康人体胃黏膜表面只表达低水平唾液酸结构。当幽门螺杆菌建立慢性感染后,黏膜表面的唾液酸表达水平升高,表明幽门螺杆菌会影响宿主胃部糖组学结构。
3.2 聚糖介导病毒感染
3.2.1 糖相关分子17——人类组织血型抗原 轮状病毒(rotavirus,RV)是引起婴儿腹泻病的常见病原体。RV感染宿主细胞的第一步,是由病毒VP4刺突蛋白上的VP8*结构域介导结合细胞表面的聚糖。RV识别不同类型HBGA,造成病毒感染人体宿主或动物宿主的差异。P[ 14]型RV能够特异性结合A型HBGA结构[86],这种结构在偶蹄类动物和人体中都存在,这可能是P[ 14]型RV产生种间传播的基础。Liu等[87]报道了1株P[ 19]型RV,能够感染动物(如猪),却不感染人体。P[ 19]型RV不但能结合HBGA中的三糖结构(Gal-β-1,3-GlcNAc-β-1,3-Gal),也能结合黏蛋白核心结构2、4和6亚型中的核心二糖(GlcNAc-β-1,6-GalNAc)。另外,P[ 19]型RV结合聚糖矩阵分析显示,在三糖Gal-β-1,3-GlcNAc-β-1,3-Gal末端添加α-1,3-半乳糖、α-1,3-N-乙酰氨基半乳糖或α-1,2-岩藻糖(即H型HBGA),会增强识别信号,而Lewis表位的α-1,4-岩藻糖会阻断识别信号。这个现象可以解释P[ 19]型RV很少会感染人体。因为90%以上人群都是Lewis阳性,只有10%左右是Lewis阴性的HBGA型人群。另有报道,P[ 4]、P[ 6]和P[ 8]型RV主要结合H型HBGA[88]。
3.2.2 糖相关分子18——末端唾液酸 目前,已经报道的腺相关病毒(adeno-associated virus,AAV)分离株超过100种,其中感染人类和其他灵长类的AAV血清型有13种(AAV1-13)。由于它们都能够将外源基因包装运输至不同类型组织而不引起疾病,因此目前被批准开展基因疗法的相关研究[89]。不同AAV在序列上有60% ~ 90%的一致性,在体内外显示出不同的细胞趋向性、组织趋向性及转导效率。据报道,病毒感染细胞的能力和转导细胞的效率,决定于病毒衣壳识别细胞表面聚糖的特异性。AAV1能够结合N-聚糖上连接的α-2,3-和α-2,6-唾液酸[90];AAV2、AAV3和AAV13结合硫酸类肝素蛋白聚糖(heparan sulfate proteoglycan,HSPG)[91];AAV4结合O-聚糖上的α-2,3-唾液酸;AAV5结合N-聚糖上的α-2,3-唾液酸[92];AAV6既能结合硫酸类肝素,也能结合N-聚糖上的α-2,3-和α-2,6-唾液酸[93];AAV9主要结合N-聚糖末端半乳糖[94];AAV7、AAV8、AAV10、AAV11、AAV12结合聚糖的研究正在进行中。
3.2.3 糖相关分子19——唾液酸-α-半乳糖 甲型流感病毒属于正黏病毒科,是引起季节性流感的主要病原体。病毒糖蛋白血凝素(hemagglutinin,HA)结合宿主上皮细胞上的唾液酸化的聚糖受体分子是病毒感染和传播的启动步骤。研究报道,HA从对唾液酸-α-2,3-半乳糖的结合特异性转换至对唾液酸-α-2,6-半乳糖的结合特异性,是甲型流感病毒从感染禽宿主转变为感染人宿主的关键因素。另外,除唾液酸的连键方式外,内部糖类分子也会影响病毒结合特异性。Gambaryan等[95]发现人流感病毒HA对唾液酸-α-2,6-半乳糖-β-1,4-GlcNAc和唾液酸-α-2,6-半乳糖-β-1,4-Glc这2种聚糖结构有不同的结合能力。另外有研究发现,不同属源的禽流感病毒能共同识别α-2,6-唾液酸化的聚糖结构,但是额外的聚糖修饰会引起结合能力的差异[96]。
4 人体糖蛋白甘露糖糖苷酶活性受限或表达水平异常与疾病的关系
自然界中存在多种特异性糖苷酶,能对不同类型聚糖进行剪切[97-98]。人体细胞内糖蛋白或分泌型糖蛋白,其N-聚糖从高甘露糖型加工至复合型或杂合型,是糖蛋白定位或黏附的关键步骤,gpM是该过程的重要参与者。gpM相关基因突变会引起gpM活性丧失,引起遗传性疾病。目前针对gpM基因缺陷的治疗手段包括基因疗法、干细胞移植和酶替代疗法等。
4.1 糖蛋白甘露糖糖苷酶系统的生物学功能
每一个细胞都有自己独特的gpM系统。gpM系统由不同的gpM组合而成,在胞内胞外发挥作用。生理条件下,gpM系统主要参与内源糖蛋白聚糖水解加工、内源糖蛋白正确折叠为二级结构,以及外源糖蛋白聚糖降解等重要的生物学过程。在病理条件下,人体内gpM相关基因缺陷会造成遗传性疾病,其表达水平异常可能引起肿瘤的发生和发展。
首先,gpM参与内源糖蛋白聚糖的水解加工,人体中糖蛋白N-糖基化修饰是一个多步骤过程,其中gpM对含有甘露糖的聚糖剪切加工,形成不同的蛋白寡糖链。高甘露糖型聚糖,即富含多个(5 ~ 9个)甘露糖的聚糖,代表着糖蛋白糖基化修饰的早期阶段[99]。在内质网和高尔基体经过gpM修剪至仅带有5个甘露糖残基(见图1),随后再被N-乙酰氨基葡萄糖、半乳糖和唾液酸等进行修饰。
其次,gpM系统参与内源糖蛋白质控。错误折叠的糖蛋白在内质网中降解,该降解过程被称为内质网相关性降解(endoplasmic reticulum-associated degradation,ERAD)[100]。ERAD需 要MAN1A1和MAN1B1参与,切除糖蛋白聚糖上3 ~ 4个α-1,2-连接的甘露糖,末端甘露糖的切除是糖蛋白靶向进入ERAD途径的信号[101](见图2)。高表达MAN1A1可以加快ERAD底物的降解速度,而敲低MAN1A1会使ERAD降解过程处于静止状态[102]。
此外,gpM还参与外源糖蛋白聚糖的降解。外源糖蛋白进入溶酶体内被降解时,溶酶体α-gpM(MAN2B1与MAN2B2)以及β-gpM(MANBA)分别负责对糖蛋白上的α-甘露糖和β-甘露糖进行切除(见图3)。被释放的甘露糖可被运出溶酶体,重新用于内源性糖蛋白上聚糖的合成[103]。
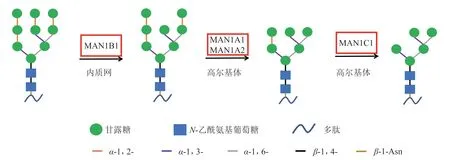
图 1 人体糖蛋白甘露糖糖苷酶系统对糖蛋白进行糖基化修饰的过程Figure 1 The process of glycosylation modification of glycoprotein by gpM system
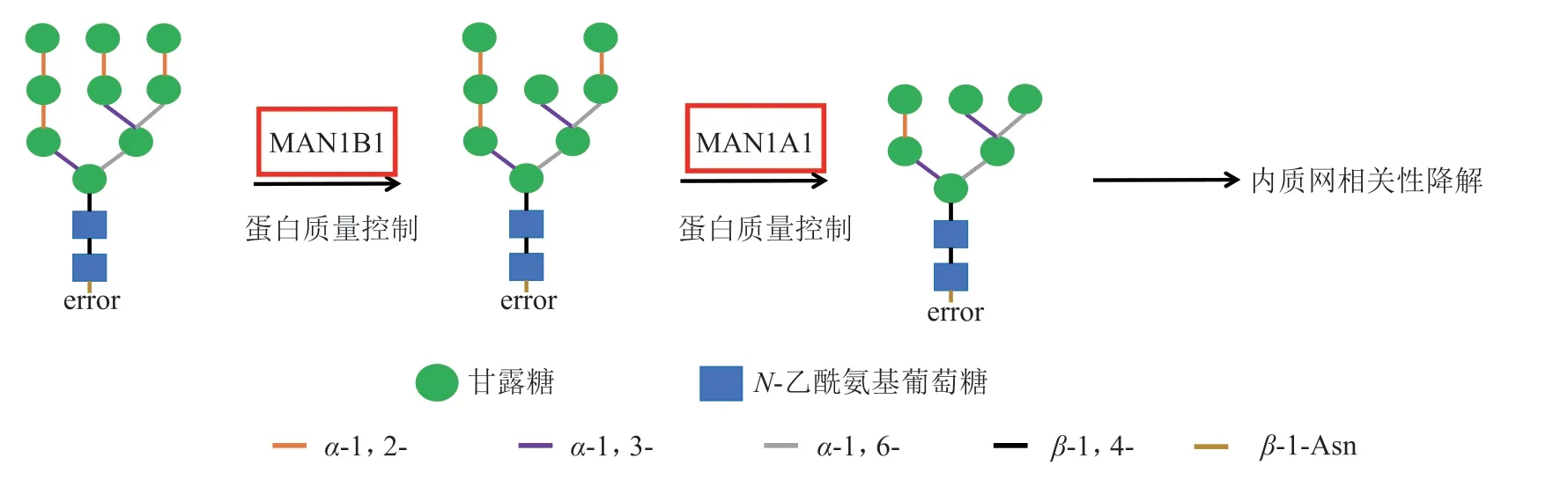
图 2 糖蛋白甘露糖糖苷酶系统参与的内质网相关性降解过程Figure 2 The endoplasmic reticulum-associated degradation process involving gpM system
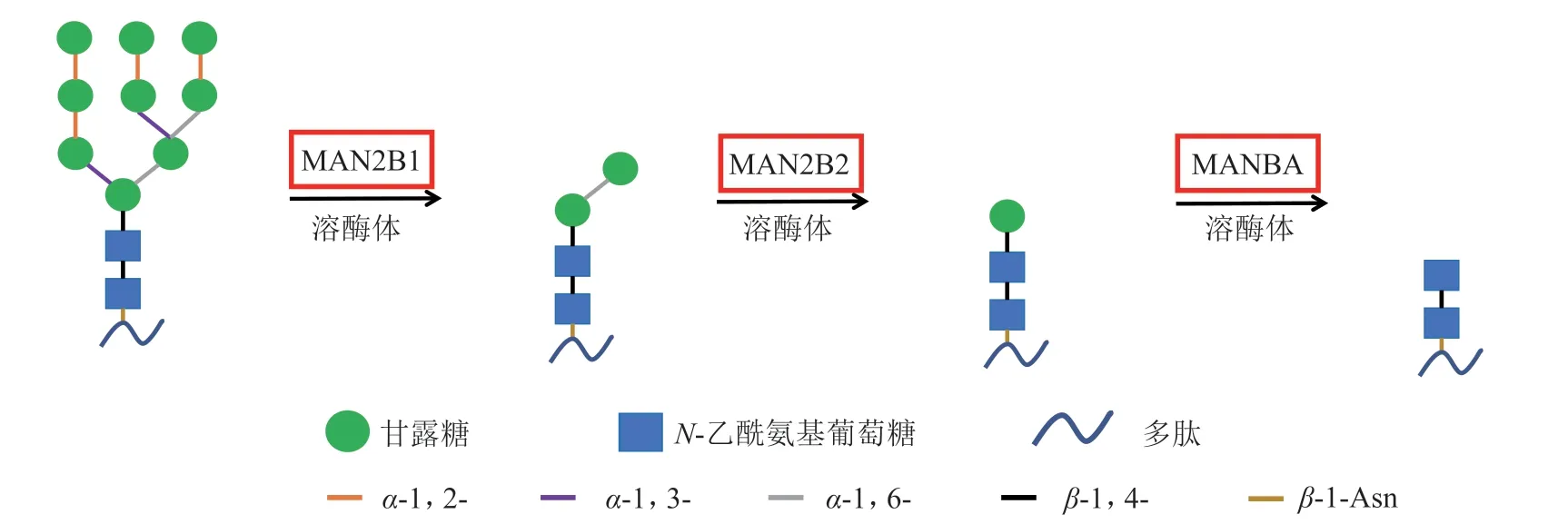
图 3 溶酶体中糖蛋白甘露糖糖苷酶对糖蛋白N-聚糖中甘露糖的降解过程Figure 3 The degradation process of N-glycan in glycoprotein by lysosomal gpM
4.2 糖蛋白甘露糖糖苷酶基因缺陷或表达异常引起的疾病
4.2.1 糖 相 关 分 子20——MAN1B1 MAN1B1是一种α-1,2-gpM,在内质网内负责将N-聚糖前体结 构Man9GlcNAc2中 间 分 支 的 末 端α-1,2-甘 露糖切除(见图2),产生Man8GlcNAc2结构。有报道称,MAN1B1还能作为错误折叠蛋白检查点(checkpoint),以及作为凝集素,在错误折叠蛋白进入降解途径前将其回收重新进入内质网再修饰加工[104]。gpM基因MAN1B1缺陷会引起MAN1B1型CDG[104],主要症状表现为智力障碍、动作迟缓、肌张力减退和躯体肥胖等,其他症状包括轻微面部畸形,关节活动异常和皮肤松弛[105]。
4.2.2 糖相关分子21——MAN2B1和糖相关分子22——MANBA MAN2B1能将大部分α-1,2-、α-1,3-和α-1,6-糖苷键连接的甘露糖从N-聚糖上切除,而MANBA负责切除β-1,4-甘露糖,两者是溶酶体糖蛋白降解的重要参与者。溶酶体中gpM缺陷会引起糖蛋白降解受阻,使得所有组织中都会产生甘露聚糖的积累,最终损伤细胞功能,引起细胞凋亡,这种症状被称为甘露糖苷贮积症[106]。MAN2B1缺陷引起α-甘露糖苷贮积症,症状包括智力障碍、听力受损、运动机能失调、面部粗陋和肌肉骨骼畸形等[107];MANBA缺陷引起β-甘露糖苷贮积症,症状除智力障碍和听力受损外,还包括上呼吸道反复感染,血管角质瘤和肝脾肿大等[108]。
4.2.3 糖相关分子23——MAN2B2 溶酶体中的gpM——MAN2B2负责降解核心四糖Man2GlcNAc2中α-1,6-连接的核心甘露糖。目前已有报道在p.Asp38Asn错义突变体病人体内发现大量Man2GlcNAc2积累,提示末端α-1,6-甘露糖的存在。Asp38位于锌结合域,其突变体可能引起MAN2B2失活。MAN2B2突变体病人出现免疫缺陷、免疫失调、斜视和神经发育障碍等症状[109]。
5 结语
蛋白的糖基化修饰,是一类特殊的翻译后修饰。其主要特点,是在糖链与蛋白共价连接后,在糖链上发生的再修饰。此糖链再修饰过程,涉及到上百种不同功能的基因,产生了多种结构及功能不同的糖链。我们认为,共价联接在糖蛋白上的糖链,可载有物种特异[110]、组织特异、生理特异及病理特异的生物快速识别信号(biological quick recognition signal),是一种独立于DNA、RNA及蛋白的新的生物信号。本文的主要关注点,是糖链在病理及药学研究中的近况及展望。
研究已表明,糖蛋白和聚糖参与恶性肿瘤的发生和发展[111],癌细胞相关糖基化异常为新诊断和新治疗提供了新的切入点[112]。位于细胞表面的糖链及识别蛋白,在病原体黏附、定植和侵袭过程中发挥了重要的作用,已成为重要的药物靶点。具有类似凝集素竞争性结合功能的糖类分子,可用于抑制HIV、Ebola病毒和UPEC等病原体的感染。毒性小、特异性强的糖相关分子,将是未来抗感染药物的新的竞争点。真核生物50%以上蛋白为糖基化修饰蛋白[113],聚糖分子在维持蛋白结构稳定的同时,决定蛋白在细胞内定位及胞外的靶向输送。包括gpM在内的多种糖苷酶维持人体内糖基化修饰过程,对这一领域的探索,将为先天性(如CDG等罕见病)、遗传性及后天继发性的功能缺失类疾病,打开一个新的窗口。
