蛋白质糖基化与衰老相关性疾病关系的研究进展
2022-01-10滕云飞苏东明梁秀彬
滕云飞,苏东明*,梁秀彬
(1. 南京医科大学病理学系,江苏 南京 211166;2. 南京医科大学病理生理学系,江苏 南京 211166)
1 糖基化修饰简介
蛋白质糖基化(protein glycosylation)是指碳水化合物分子通过共价键附着到蛋白质功能基团的过程,主要是指聚糖(glycan)与蛋白质结合的酶促反应,其影响蛋白质在细胞内的折叠和运输,从而在多种细胞信号传导和通信事件中发挥重要作用。N-连接糖基化(N-linked glycosylation)和O-连接糖基化是两种最常见的蛋白质糖基化类型。N-连接糖基化是指在内质网(endoplasmic reticulum,ER)和高尔基体(Golgi apparatus,GA)内,聚糖通过新生肽链的一致序列天冬酰胺-X-丝氨酸/苏氨酸中的游离氨基与新生多肽上的天冬酰胺残基相连接[1-2]。O-连接糖基化则可以发生在蛋白质序列中的丝氨酸或苏氨酸残基的任何羟基上[3]。
大多数细胞在其表面表达和分泌的蛋白质都被聚糖修饰[4]。不同类型的聚糖其单糖单元的数量、类型和顺序均不同,且由不同的酶催化合成。最常见的单糖有岩藻糖、半乳糖、葡萄糖、甘露糖、N-乙酰半乳糖胺、N-乙酰氨基葡萄糖(GlcNAc)、唾液酸和木糖[4]。细胞表面和分泌的蛋白质上附着的聚糖通过改变被修饰蛋白质的功能参与细胞内和细胞间的生物学过程[5];同时也参与病毒感染的分子识别过程、炎症过程中的细胞黏附和肿瘤转移等病理过程[6]。此外,蛋白质与聚糖的相互作用在影响疾病进展的许多过程中发挥作用[7]。在癌症[8]、糖尿病和炎症患者经常出现糖基化异常的情况[9]。
2 糖基化与衰老
在过去的几十年中,人们不断寻找能够识别衰老与衰老相关疾病的生物标志物。美国老龄化研究联合会(AFAR)总结了9个“衰老特征”,包括表观遗传学变化(例如甲基化、磷酸化、泛素化、糖基化)、蛋白稳定性的丧失、营养感知缺失、线粒体功能障碍、细胞衰老、干细胞耗竭、细胞间信号传递的改变、基因组不稳定以及端粒磨损[10]。疾病常由遗传变异、表观遗传失调和环境等多种因素驱动。糖基化作为翻译后修饰(post-translational modification,PTM)的重要方式,可以反映这些因素相互作用的实时状态,并有望成为这些多因素疾病诊断和评价预后的潜在标志[11]。在衰老过程中,蛋白质的糖基化也不断发生改变。Vanhooren等[12]研究表明,人类在40岁之后,人体内蛋白质N-糖基化的修饰会导致某些类型的糖型的增加,甚至形成新糖型。
随着人类年龄的增长,血液中3种主要的糖蛋白[血清、血浆和免疫球蛋白(Ig)]中主要的N-糖链结构均会出现明显的变化。Ig是一组与先天免疫和获得性免疫有关的糖蛋白,约占人体血浆蛋白的20%。在所有的Ig中,IgG的含量最为丰富,因此在糖组学的研究中经常检测IgG蛋白附着的糖链变化。IgG参与的全身炎症反应,受到附着在IgG Fc部分2条重链的保守区域Asn297的N-聚糖的调节。N-聚糖通过改变Fc部分的构象、与不同受体和凝集素的亲和力控制IgG的炎症特性[13-14]。人血清中存在30多种IgG糖型[15]。人IgG中的大部分FcN-糖链为半乳糖基化,中性IgG糖链由大约40%不含半乳糖的中性糖链组成,40%以上的中性糖链含有单端半乳糖,20%的中性糖链含有2个末端的半乳糖[16]。半乳糖基化聚糖水平的降低与衰老和免疫激活直接相关[16-17]。
半乳糖基N-连接低聚糖(NG0A2F和NG0A2FB)随年龄增加而增加,而去唾液酸半乳糖核心岩藻糖基化二天线N-聚糖(NA2F)随年龄的增加而减少[18]。在50岁以前,这3种聚糖随年龄的变化不明显,而在41 ~ 50岁和51 ~ 60岁年龄组之间的差异则有统计学意义[19]。这些发现表明,人血清中低聚糖的半乳糖基化和岩藻糖基化水平是与年龄相关的指标[18],表明与年龄相关的生理变化发生在50岁前后。半乳糖基化大多随着年龄的增长而减少。此外,非半乳糖基化糖肽在老年人中更为丰富。有研究发现,在中年时含有平分型N-乙酰氨基葡萄糖(GlcNAc)的IgG中非半乳糖基化糖肽水平降低,是家族长寿的早期特征[20]。
在成年人中,唾液酸化与半乳糖基化一样,也随着年龄的增长而减少。随着逐步进入更年期,45 ~ 60岁左右的女性表现出半乳糖基化和唾液酸糖水平的显著下降。在较为年轻的个体中,平分型GlcNAc的发生率增加,并在较年长时达到平台期[21]。不同的是,在儿童中,Fc半乳糖基化随年龄增长保持相对恒定,而IgG发生等分(bisection)增加,发生岩藻糖基化和唾液酸化则减少[22]。图1显示了与衰老相关的糖基化改变的一般趋势。
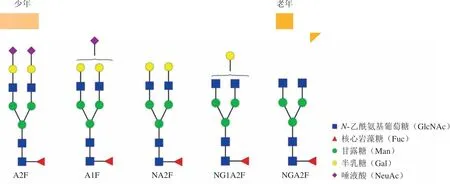
图 1 与衰老相关的糖基化改变趋势Figure 1 Trends in glycation changes associated with aging
一款名为GlycoAgeTest的检测项目通过计算NGA2F和NA2F这2个聚糖比值的对数来预测衰老过程中可能发生的疾病。GlycoAgeTest的衰老指标在40岁前保持稳定,随着年龄增长逐渐增加,90岁达到峰值[12]。老年痴呆患者的糖基因测试水平高于同年龄的健康个体。有专家认为,GlycoAgeTest检测比用年龄参数评估人的衰老程度更有临床价值。
能够找到在衰老过程中发生糖基化修饰的特异蛋白也非常重要。例如,随年龄的增长,人体内的IgG发生糖基化改变,诱导了该糖蛋白的促炎修饰[23-24]。这些修饰能够促进炎症恶性循环,并可能诱导周围组织的细胞凋亡[25]。
Ruhaak等[26]还 发 现α1-抗 胰 蛋 白酶(αAT)富集组分的糖基化程度与实际年龄相关;αAT富集部分中的这些聚糖也是心血管疾病和代谢性疾病的标志物。另有学者发现蛋白C(protein C)、纤溶酶原(plasminogen)[27-28]和α-2-巨球蛋白(α-2-macroglobulin,α2M)[29]等其他蛋白质的糖基化修饰水平随年龄改变而不同[27-29]。其中,α2M是一种糖基化的广谱抑制剂,可抑制一些参与凝血的蛋白酶功能。Wide等[30]还分析了幼儿血液循环中糖蛋白激素促甲状腺激素(TSH)的N-聚糖组成。TSH分子在细胞内的高尔基体中进行翻译后修饰,主要是在蛋白分子上添加N-聚糖的分支和末端阴离子单糖残基。TSH分子的翻译后修饰会影响其在不同的生理和病理情况下的生物学特性。与成人相比,儿童的N-糖基化程度较低,而年龄较小的儿童的唾液酸化水平最低[30]。
除了血液标本,皮肤也是反映衰老的重要标志。在皮肤糖组学中,表皮具有大量的高甘露糖N-糖基化蛋白,这些蛋白在角质层脂质重塑、脱屑和维持皮肤屏障功能中发挥作用。与年轻皮肤相比,老年皮肤角质层中高甘露糖聚糖的水平显著下降[31]。
3 糖基化与衰老相关性疾病
多年来,人们一直认为衰老是一种容易引发许多疾病的病理过程[32],最近出现了“年龄相关性疾病”一词[33]。衰老与这些疾病发病之间存在共同发生机制,包括压力适应、蛋白质平衡丧失、干细胞耗竭、代谢紊乱、大分子损伤、表观遗传修饰和炎症反应[34-36]。与年龄相关的疾病的发生可以被视作衰老加速的表现,我们迫切需要发现一些标志物,能够帮助区分生物学年龄(biological age)和时间年龄(chronological age),以便识别哪些人更有可能患上与衰老相关性疾病[35]。
3.1 在癌症中聚糖的改变
目前,与癌症相关的特异性糖蛋白及其相应的聚糖已经受到高度关注。岩藻糖基化是肿瘤中最重要的糖基化类型之一,它调节黏附分子和生长因子受体的生物学功能。因此,岩藻糖基化的改变可能为癌症治疗提供一种新的策略[37-38]。
研究人员通过不断观察不同类型的癌症在疾病演变过程中的糖基化状态,对9种N-多糖结构进行比较,发现血清N-聚糖图谱在胃癌的发展过程中发生了改变。经过对单个N-糖链结构的丰度分析,他们发现核心岩藻糖基化结构的丰度在胃癌中显著降低,与结直肠癌相似[39]。这一发现无疑有助于胃癌的早期诊断。可以相信,进一步研究癌症发生和发展的各个阶段中糖基化的变化可能会对胃癌的诊断、监测和筛查有很大的帮助[40]。
N-葡聚糖α-1,3-岩藻糖基化三天聚糖(NA3Fb)可作为乙型肝炎病毒(HBV)感染后的肝硬化及肝细胞癌(HCC)的标志[41-43],与非酒精性脂肪性肝炎中的水平具有明显差异[44]。在肝脏纤维化中YKL-40的血清含量明显升高[45]。在使用CCl4构建的大鼠肝脏纤维化模型中进行的研究表明,N-糖链图谱可作为一种理想的血清生物标志[46],使用二乙基亚硝胺(DENA)构建的大鼠肝纤维化、肝硬化、肝癌模型验证了这些血清聚糖的改变[47-48]。血清N-糖基分析是从肝硬化患者中筛选肝癌患者的一种创新方法,可以更好地筛查、随访和治疗肝硬化和肝癌患者。
N-葡聚糖具有潜在的乳腺癌诊断潜力[49-50]。Hu等[51]认为,血浆糖组学的相关检测指标可以作为肺癌无创诊断和评价预后的新型生物标志物。通过量化α链甘露聚糖、α-2,6-唾液酸化、β-1,4-分支、β-1,6-分支、4链GlcNAc和触角岩藻糖基化等聚糖特征,可以预测处于不同阶段肺癌患者的生存率。大多数的肺癌患者聚糖特征与其吸烟状况、年龄、性别和组织学亚型无关。
肝脏合成的糖蛋白——结合珠蛋白(haptoglobin)是食管癌、胃癌、结肠癌、胆囊癌、胰腺癌、前列腺癌和卵巢癌的生物标志物。该蛋白含有天冬氨酸184、天冬氨酸207、天冬氨酸211和天冬氨酸241等4个糖基化位点。据报道,在肝癌、胃癌、卵巢癌和胰腺癌患者的血清中,所有双天线N-聚糖均增加,未经核心岩藻糖基化修饰的三天线N-聚糖则减少,核心岩藻糖基化的聚糖增加[48,52-54]。由于参与分支形成和岩藻糖基化的糖基转移酶在不同的器官和组织中的表达是不同的,因此理论上N-糖基化结合珠蛋白在N-糖链结构上应存在差异,然而在食管癌、胃癌、结肠癌、胆囊癌、胰腺癌和前列腺癌中,研究人员发现N-糖链结构或岩藻糖基化并无差异,这提示癌症患者血清中的结合珠蛋白可能是在肝脏中产生的[55]。
目前尚未发现在所有癌症中都会发生变化的N-聚糖。除胰腺癌外,四天线N-聚糖在其他癌症患者血清中的水平均有增加,表明四天线N-聚糖是不同类型的癌症中N-聚糖共同的结构特征。然而,人们还未能在不同癌症中观察到可供相互比较的N-聚糖图谱。目前也没有研究表明,不同类型的癌症都具有独一无二的N-聚糖图谱。如果想通过分析血清中异常的N-聚糖来区分不同类别的癌症为时尚早[52]。
3.2 糖组学与老年神经退行性病变
神经退行性疾病的特征是神经元的功能丧失和死亡,其往往会影响老年患者的日常生活,并增加社会负担[56]。人们发现,在阿尔茨海默病(Alzheimer's disease,AD)、肌萎缩性侧索硬化症(amyotrophic lateral sclerosis,ALS)或帕金森病(Parkinson’s disease,PD)等神经退行性疾病的患者体内都存在聚糖的改变。AD是一种常见的、与年龄相关的慢性神经退行性疾病[57],其主要表现为认知障碍[6]。AD患者的免疫反应不仅出现于大脑,而且还会在外周血中有所反映。作为炎症和/或免疫反应受损的临床标志物,人们可以通过测量IgG Fc糖基化的水平来监测AD的进展[58]。AD患者在血液中往往会出现炎症介质和促炎IgG Fc糖型水平的升高[58]。而在AD中复杂的半乳糖基化和唾液酸化形式的数量较低,并存在性别差异。在AD发病之前,女性中半乳糖基化水平下降,而在男性中则成相反变化趋势。这说明,与男性患者相比,女性抑制周围炎症的能力可能较低[58]。相关研究发现,一些可导致或加速衰老过程的疾病,如AD[59-60]或创伤后应激障碍会影响免疫系统并加速细胞衰老,这些改变会影响动物和人类的N-糖链图谱和代谢[60-61]。
3.3 代谢综合征及相关疾病中糖蛋白的变化
代谢综合征(metabolic syndrome,MetS)是一组包括高血压、中心性肥胖、胰岛素抵抗和致动脉粥样硬化性血脂代谢紊乱的状态。随着年龄的增长,MetS的患病率也相应增加。这会增加动脉粥样硬化性心血管疾病(CVD)的发生风险[62]。
NGA2FB和NA3F水平在患有甲亢的妇女体内显著升高。与健康的同龄人相比,患有MetS的女性的NG1A2F显著降低。与不伴有MetS的老年患者相比,老年MetS患者的NGA2FB和NA3F水平升高,而NG1A2F水平更低。这项研究证实了在老年人体内存在与代谢风险有关的N-聚糖水平异常。此外,研究结果表明,N-聚糖谱的变化不仅与老年代谢风险有关,还受到体力活动的影响[63]。Testa等[64]报道,患有MetS的老年妇女NGA2FB和NA3F水平增加,NG1A2F水平下降。此外,NA3和NA4水平的降低与坚持体力活动有关[63]。人体血浆的N-糖链可以准确反映人类新陈代谢的变化,并可能成为MetS的潜在生物标志物[65]。
高血压也是与MetS相关的危险因素,在老年人中发病率较高[66]。IgG的糖基化改变与血压状态有关,随着血压升高,其半乳糖基化水平降低[67]。在炎症性肠病(IBD)[68]和AD[58]的相关研究中,研究人员也发现了完全相同的关联。AD患者血液中的炎症介质蛋白和促炎IgG Fc聚糖水平增加,提示全身处于炎症状态。此外,已知外周炎症状态引起的糖谱变化也与性别有关[58]。因此,亚类特异性IgG FcN-糖基化图谱有望成为高血压引起的炎症和代谢紊乱的生物标志[69]。
除了高血压之外,血脂异常也是MetS的危险因素。在血脂异常的患者中,血脂与半乳糖和唾液酸的减少以及平分型N-乙酰氨基葡萄糖的增加有关,这可能与伴随着血脂异常的慢性炎症有关。此外,基于在不同的疾病状态下IgGN-糖基化所具有的特征,其有望成为血脂异常的潜在生物标志[70]。
糖尿病、高血压、衰老及其相关危险因素,均可引起慢性肾脏疾病[71]。IgG半乳糖基化、唾液酸化和平分型N-乙酰氨基葡萄糖特征的14个糖链特征与肾脏损伤相关,提示了IgG糖基化在肾功能中的作用。这一发现为阐明慢性肾脏疾病的病理生理学机制、发现潜在的诊断和治疗靶点提供了新的思路[71]。
3.4 慢性炎症疾病中糖蛋白的改变
类风湿性关节炎是一种老年人常见的慢性自身免疫性炎症性疾病,与患者体内蛋白糖基化、瓜氨酰化和氨甲酰化密切相关。由于临床上缺乏针对类风湿性关节炎患者的可靠诊断和随访指标,研究人员对类风湿性关节炎患者展开了血液糖基化分析工作及相关探索。人体内如存在2个无乳糖基化聚糖(FA1和A2)和1个双半乳糖基化双天线聚糖(FA2BG2S2),会增加类风湿性关节炎发生的可能性;人体内如存在双乳糖基化和双唾液酸化聚糖(聚糖A2BG2S2),则该病发生的几率很低[72]。类风湿性关节炎患者重链CH2区保守的N-糖链(Asn297)半乳糖基化程度降低,并与疾病的严重程度成正比、与疾病发生的风险相关[73-74]。
IgG半乳糖基化与类风湿性关节炎的治疗效果密切相关。甲氨蝶呤和雷米卡等治疗药物会改善类风湿性关节炎患者的IgG半乳糖基化水平[73]。IgGN-糖基化在类风湿性关节炎确诊前就会发生改变,表明聚糖链参与疾病的病理过程[74]。另一项研究通过检测IgG异常糖基化证明类风湿性关节炎体液免疫失调。这种失调至少在症状出现前3.5年就开始了。研究结果表明,异常的IgG半乳糖基化大大早于关节炎和类风湿性关节炎的诊断,并且选择性地存在于抗瓜氨酸肽自身抗体部分[75]。这些N-糖基的早期变化可能有助于创建一种早期诊断类风湿性关节炎的特异性测试,并足以评估疾病的进展、缓解和治疗状况[74]。此外,类风湿性关节炎患者体内IgG的半乳糖基化与病情严重程度和病程有关。与关节炎病程小于5年的患者相比,病程较长(超过15年)的RA患者体内的半乳糖比例显著降低。在类风湿性关节炎患者中观察到IgG的半乳糖基化降低,这与类风湿性关节炎的严重程度和病程相关,可用于监测早期关节炎的进展[76]。
3.5 糖组学与2型糖尿病
2型糖尿病(type 2 diabetes mellitus,T2DM)是一种非胰岛素依赖性的慢性代谢疾病,好发于中老年人。T2DM是一种由多种致病因素引起的疾病,包括遗传变异、表观遗传调控、翻译后修饰、获得性环境因素以及它们在多组学水平上的相互作用。在T2DM患者中可检测到不含半乳糖的琼脂糖基化聚糖的减少、单半乳糖基化的聚糖和岩藻糖基化结构的增加,这些IgG糖链特征能够显示炎症反应和生物老化状态,增加了患T2DM的风险[9]。除此以外,NG1A2F显著减少[64]。T2DM患者中的N-糖链FA2G2和FA2BG2(均为中性多糖)水平随年龄增长而降低,而N-糖链A2[ 3]BG1S[ 3]1(单唾液酸糖)水平随年龄增长而升高[77];α-2,3-链接和α-2,6-唾液酸化岩藻糖基化多糖随年龄增长而增加,而非岩藻糖基化多糖随年龄增长而减少[78]。通过对不同人群生物学年龄的研究发现,岩藻糖基化的二分GlcNAc水平升高[23-24],这表明T2DM患者可能处于一种慢性炎症状态,或者是一种生物老化状态[9]。因此,IgGN-糖基化的特异性改变使之有望成为T2DM的诊断以及从T2DM进展到心血管疾病或肾功能衰竭的潜在炎性观测指标。
4 结语与展望
衰老的研究是医学生物学研究中非常重要的一环。随着有关老化的生物标志物的研究不断深入,糖组学作为后基因组技术,可以对衰老实时或纵向分析,正在成为衰老相关病理状态潜在的生物标志。
在许多关于衰老和衰老相关性疾病的糖组学研究中,聚糖都发生了不同的改变。糖基化的异常可以帮助我们区分不同的疾病,识别潜在的诊断和预后生物标志物。在临床研究中,比较不同疾病的聚糖水平往往会导致不一致的结果,可能是由于不同种群甚至不同环境中糖类的多样性所致。疾病可以在人群中表现出多样性,而聚糖特性可被认为是系统理解复杂疾病的一条新的研究途径。
